Contents
ActHIB [Haemophilus b Conjugate Vaccine (Tetanus Toxoid Conjugate)]
Solution for Intramuscular Injection
Initial U.S. Approval: 1993
处方信息要点
这些重点并不包括安全有效使用ActHIB所需的所有信息。请参阅ActHIB的完整处方信息。
嗜血杆菌结合疫苗(破伤风类毒素结合疫苗) 肌肉注射溶液
美国首次批准日期:1993年
———— 适应症和用法————
●ActHIB是一种疫苗,用于预防由b型流感嗜血杆菌引起的侵袭性疾病,ActHIB疫苗被批准用于婴儿和2个月至5岁儿童的4剂系列(1)
————剂量和用法————-
仅用于肌肉注射
肌肉注射4剂系列(每剂0.5 mL):
●在婴儿2个月、4个月和6月龄时一次系列接种的3剂疫苗。(2.1)
●在15- 18月龄时给予单次加强剂量。(2.1)
————剂型和强度—————
注射液:将在所提供的0.4%氯化钠稀释液中复溶的冻干粉。复溶后的单次剂量为0.5 mL(3)
————— 禁忌症————
前1剂任何药物后出现严重过敏反应(如过敏反应)
b型流感嗜血杆菌或含破伤风类毒素的疫苗或ActHIB疫苗的任何成分。(4)
————警告和注意事项————
●如果在接受含破伤风类毒素的疫苗后6周内发生吉兰-巴雷综合征,则必须评估接种ActHIB疫苗的潜在益处和风险。(5.2)
————不良反应—————
在2-20月龄的儿童中接种ActHIB疫苗后,不良反应的发生率因剂量数和接受者年龄而异:
●2个月至16月龄的儿童接种任何剂量后最常见的全身反应是烦躁/易怒(75%)。伤心欲绝的哭泣(58%)和活动减少/嗜睡(51%)。(6.1)
●在15-20月龄的儿童中,压痛(20%)是单剂接种后最常见的局部反应。(6.1)
要报告可疑的不良反应,请联系 赛诺菲巴斯德公司药物警戒部,宾夕法尼亚州斯威夫特沃特市发现大道18370号,电话1-800-822-2463(1-800-疫苗)或VAERS 1-800-822-7967或http://vaers.hhs.gov.
有关患者咨询信息,请参见第17节。
修订日期:2022年3月
| 完整的处方信息:内容* | 11描述 *未列出完整处方信息中省略的章节或小节。 |
完整的处方信息:
1适应症和用法
ActHIB是一种疫苗,用于预防由b型流感嗜血杆菌引起的侵袭性疾病。ActHIB获准用于2个月至5岁的儿童。
2剂量和用法
仅供肌肉注射使用
2.1免疫系列
ActHIB疫苗以4剂系列(每剂0.5 mL)的形式提供,具体如下:
在婴儿2、4和6月龄时接种单剂疫苗的3剂系列疫苗。
15至18月龄时的单次加强剂量。
2.2复溶
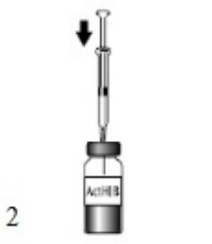
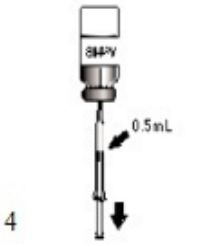
ActHIB疫苗是一种注射液,以单剂量冻干疫苗小瓶(第1瓶,共2瓶)的形式提供,仅用随附的生理盐水稀释剂(0.4%氯化钠)复溶(第2瓶,共2瓶)。要复溶ActHIB疫苗,抽取0.6 mL生理盐水稀释液并注入冻干ActHIB疫苗的小瓶中。搅动小瓶以确保完全复溶。复溶的ActHIB疫苗将呈现透明无色。抽取0.5 mL剂量的复溶疫苗并进行肌肉注射。复溶后,如果未接种ActHIB疫苗,请立即储存在2至8℃(35至46℉)下,并在24小时内接种。注射前应重新搅拌储存的疫苗。参见图1、2、3和4。
用生理盐水稀释液(0.4%氯化钠)复溶ActHIB疫苗的说明
| 图1.对稀释剂瓶塞进行消毒,注射针头,并根据指示抽取0.6 mL0.4%氯化钠稀释剂。
| 图2.清洁ActHIB疫苗塞,将注射器针头插入小瓶,并注射全部量的稀释剂。
|
| 图3.充分搅动小瓶。
| 图4.复溶后,抽取0.5 mL复溶疫苗并肌内注射.
|
2.3接种
只要溶液和容器允许,注射用药品在接种前应目视检查是否有颗粒物质和/或变色。如果存在上述任何一种情况,则不应接种疫苗。
ActHIB疫苗以单剂量(0.5 mL)通过肌肉注射的方式注射到大腿前外侧或三角肌。丢弃未使用的部分。
不要静脉注射、皮内注射或皮下注射本品。
ActHIB疫苗不应与其他注射用产品在同一注射器中混合。
3剂型和强度
ActHIB疫苗是一种注射用溶液,以单剂量冻干粉小瓶形式提供,用所提供的0.4%氯化钠稀释剂复溶。复溶后的单剂量为0.5 mL。
4禁忌症
4.1过敏
前1剂b型流感嗜血杆菌或破伤风类毒素的疫苗或疫苗的任何成分后出现严重过敏反应(如过敏反应)是使用ActHIB疫苗的禁忌症【参见说明(11)】.
5警告和注意事项
5.1急性过敏反应的管理
如果出现急性过敏反应,必须准备好肾上腺素和其他合适的药物。
5.2格林-巴利综合征
如果在接种含破伤风类毒素的疫苗后6周内出现格林-巴利综合征,则应在仔细考虑潜在益处和可能风险的基础上决定是否接种任何含破伤风类毒素的疫苗,包括ActHIB疫苗。
5.3免疫活性改变
在免疫抑制人群中,包括接受免疫抑制治疗的人群,可能无法获得预期的抗体反应。
5.4疫苗有效性的局限性
接种ActHIB疫苗可能无法保护100%的个体。
5.5破伤风免疫接种
ActHIB疫苗免疫不能替代常规破伤风免疫。
5.6对实验室测试的干扰
在接受含b型流感嗜血杆菌疫苗后1至2周内,对b型流感嗜血杆菌引起的疑似疾病可能没有诊断价值,包括ActHIB【参见药物相互作用(7.3)】。
6不良反应
6.1临床试验经验
由于临床试验是在差异很大的条件下进行的,因此在一种疫苗的临床试验中观察到的不良反应率不能直接与另一种疫苗的临床试验中的不良反应率进行比较,并且可能无法反映实际观察到的不良反应率。
在美国临床试验期间,已有7000多名婴幼儿(≤2岁)接种了至少1剂ActHIB疫苗。其中,1,064名年龄在12至24个月的受试者仅接种了ActHIB疫苗,他们报告没有出现严重或危及生命的不良反应。(1) (2)
与ActHIB疫苗相关的不良反应一般在24小时后消退,并且在免疫接种后不会持续超过48小时。
在美国的一项试验中,对110名15至20月龄的儿童进行了ActHIB疫苗的安全性评估。所有儿童都接种了3剂b型流感嗜血杆菌结合疫苗(ActHIB疫苗或以前许可的b型嗜血杆菌结合疫苗)在大约2、4和6月龄时接种。接种ActHIB疫苗后48小时内发生的选定请求注射部位和全身不良反应的发生率见表1。
表1:15至20月龄的儿童接种ActHIB疫苗后6、24和48小时的局部和全身反应(2)
| 不良事件 | 接种后6小时 | 接种后24小时 | 接种后48小时 |
| 局部(%) | N=110 | N=110 | N=110 |
| 柔软 | 20.0 | 8.2 | 0.9 |
| 红斑 (>1”) | 0.0 | 0.9 | 0.0 |
| 硬结* | 5.5 | 3.6 | 0.9 |
| 膨胀 | 3.6 | 1.8 | 0.0 |
| 全身(%) | N=103-110 | N=105-110 | N=104-110 |
| 发热 (>102.2℉) (>39.0℃) | 0 | 1.0 | 1.9 |
| 过敏性 | 27.3 | 20.9 | 12.7 |
| 睡意 | 36.4 | 17.3 | 12.7 |
| 厌食 | 12.7 | 10.0 | 6.4 |
| 呕吐 | 0.9 | 0.9 | 0.9 |
| 持续的哭泣 | 0 | 0 | 0 |
| 不寻常的叫声 | 0 | 0 | 0 |
*硬结是指有无肿胀的硬度。
在一项美国临床试验(P3T06)中,1,454名儿童在2月龄时接种了1剂ActHIB疫苗,并在4月龄和6月龄时接种了后续剂量的疫苗(同时在2月龄、4月龄和6月龄时接种了DAPTACEL(一种美国许可的白喉、破伤风和百日咳疫苗)、IPOL(一种美国许可的灭活脊髓灰质炎疫苗)和PCV7(肺炎球菌结合疫苗,7价)以及乙肝疫苗)。在15- 16月龄时,418名儿童接种了第4剂ActHIB和DAPTACEL疫苗。任何剂量后最常见的全身反应(超过50%的参与者)是活动减少/嗜睡、烦躁/易怒和伤心过度的哭泣。
表2:在研究P3T06中,接种后0-3天内严重引起系统性不良反应的儿童数量(百分比)
| 全身反应 | DAPTACEL+ IPOL + ActHIB疫苗 | DAPTACEL + ActHIB疫苗 | ||
| 剂量1 N = 1390-1406 % | 剂量2 N= 1346-1360 % | 剂量3 N= 1301-1312 % | 剂量4 N=379-381 % | |
| 发烧*† ≥38.0℃ >38.5℃ >39.5℃ | 9.3 1.6 0.1 | 16.1 4.3 0.4 | 15.8 5.1 0.3 | 8.7 3.2 0.8 |
| 减少活动/昏睡‡ 任何 中度 严重 | 51.1 24.3 1.2 | 37.4 15.8 1.4 | 33.2 12.7 0.6 | 24.1 9.2 0.3 |
| 伤心欲绝的哭泣 任何 ≥1小时 ≥3小时 | 58.5 16.4 2.2 | 51.4 16.0 3.4 | 47.9 12.2 1.4 | 36.2 10.5 1.8 |
| 烦躁/易怒 任何 ≥1小时 ≥3小时 | 75.8 33.3 5.6 | 70.7 30.5 5.5 | 67.1 26.2 4.3 | 53.8 19.4 4.5 |
注意。–研究参与者的年龄从1.3个月到19.5个月不等。
*发热基于记录的实际温度,未对测量路线进行调整。
†第1-3剂组合后,通过腋窝、直肠或其他途径测量体温或未记录体温的比例分别为44.8%、54.0%、1.0%和0.1%。第4次接种后,通过腋窝、直肠或其他途径测量体温或未记录体温的比例分别为61.1%、36.6%、1.7%和0.5%。
‡中度:干扰或限制日常活动;重度:残疾,对日常活动不感兴趣。
在P3T06研究中,在接种1-3剂DAPTACEL+ IPOL + ActHIB疫苗后的30天内,1,455名参与者中有50名(3.4%)出现严重不良事件(SAE)。研究者确定在接种三种疫苗的第1剂疫苗当天发生的一例癫痫发作伴呼吸暂停的严重不良事件可能相关。在第4剂后的30天内,418名(1.0%)接受DAPTACEL + ActHIB疫苗的参与者中有4名出现了严重的不良事件。调查人员认为没有一项与疫苗研究有关。
6.2上市后体验
在ActHIB疫苗获批后使用期间,自发报告了以下事件。由于这些事件是由规模不确定的人群自愿报告的,因此并不总是能够可靠地估计其频率或建立与疫苗暴露的因果关系。
●免疫系统疾病:
过敏反应、其他过敏/超敏反应(包括荨麻疹、血管性水肿)
.●神经系统疾病:
抽搐
●全身疾病和接种部位条件:
四肢广泛肿胀、外周水肿、瘙痒、皮疹(包括全身皮疹)
7药物相互作用
7.1与其他疫苗同时接种
在临床试验中,ActHIB疫苗在不同的部位与一种或多种以下疫苗同时接种:DTaP;麻疹、腮腺炎和风疹疫苗;乙肝疫苗;和灭活脊髓灰质炎疫苗(IPV)。当ActHIB疫苗与这些疫苗同时但在不同的部位接种时,未显示出对单个抗原的抗体反应受损。(2)
7.2免疫抑制治疗
免疫抑制疗法,包括放疗、抗代谢药、烷化剂、细胞毒性药物和皮质类固醇(使用超过生理剂量)可能会降低对ActHIB疫苗的免疫反应【参见警告和注意事项(5.3)】.
7.3对实验室测试的干扰
从一些疫苗接种者的尿液中检测到来自b嗜血杆菌结合疫苗的b嗜血杆菌荚膜多糖。在接种含b型流感嗜血杆菌疫苗后1至2周内,尿液抗原检测对因b型流感嗜血杆菌引起的疑似疾病可能没有诊断价值,包括ActHIB【参见警告和注意事项(5.6)】。
8在特定人群中使用
8.1怀孕
ActHIB未被批准用于6岁及以上的个体。没有可用的人类或动物数据来评估怀孕期间与疫苗相关的风险。
8.2哺乳
ActHIB未被批准用于6岁及以上的个体。尚无人类或动物数据可用于评估ActHIB对牛奶产量的影响、其在母乳中的存在或其对母乳喂养婴儿的影响。
8.4儿科使用
尚未确定ActHIB在6周以下婴儿和6岁及以上儿童和青少年中的安全性和有效性【参见剂量和接种(2.1)].
11描述
ActHIB疫苗是一种无菌冻干粉末,用生理盐水稀释液(0.4%氯化钠)复溶,仅用于肌肉注射。.该疫苗由b型流感嗜血杆菌荚膜多糖(聚核糖基-核糖醇-磷酸,PRP)组成,这是一种高分子量聚合物,来自流感嗜血杆菌b型菌株1482,在半合成培养基中生长,与破伤风类毒素共价结合。(4)冻干的ActHIB疫苗粉和生理盐水稀释剂不含防腐剂。破伤风类毒素是通过提取、硫酸铵纯化和福尔马林灭活毒素从破伤风梭菌(哈佛菌株)培养物中制备的。(5)培养基含有乳源性原料(酪蛋白衍生物)。通过计算,进一步的制造工艺步骤将残余甲醛降低到每剂低于0.5μg(mcg)的水平。类毒素在结合过程之前过滤灭菌。ActHIB疫苗的效力在每批中通过对每剂中PRP多糖和蛋白质含量的限制以及疫苗中多糖和蛋白质的比例(称为高分子量结合物)来规定。
当用生理盐水稀释液(0.4%氯化钠)复溶ActHIB时,每0.5 mL剂量配制成含有10μg纯化荚膜多糖,与24μg灭活破伤风类毒素和8.5%蔗糖结合。
ActHIB疫苗和稀释剂的瓶塞不是用天然橡胶乳胶制成的。
12临床药理学
12.1作用机制
流感嗜血杆菌是一种革兰氏阴性球菌。大多数b型流感嗜血杆菌菌株导致侵袭性疾病(如败血症和脑膜炎)疾病。
对ActHIB疫苗的反应是典型的对抗原的T依赖性免疫反应。由ActHIB疫苗诱导的抗荚膜PRP抗体的主要同种型是IgG。(6)先前接种过两剂或3剂ActHIB疫苗的12个月或更大的儿童中显示出IgG的加强反应。在免疫后的血清中显示了对b型流感嗜血杆菌的杀菌活性,并与ActHIB疫苗诱导的抗PRP抗体应答相关。(1)
接种未偶联的PRP疫苗后,>1.0 mcg/mL的流感嗜血杆菌荚膜多糖(抗-PRP)的抗体滴度与24个月以上儿童对侵袭性b型流感嗜血杆菌疾病的长期保护相关。(7)虽然该阈值与结合疫苗免疫后临床保护的相关性尚不清楚,特别是考虑到诱导的免疫记忆,但该水平仍被视为长期保护的指标。(8)在临床研究中,在初次接种后(2个月、4个月和6个月)90%的婴儿和在15至19月龄时接受加强剂量后超过98%的婴儿中,ActHIB疫苗平均诱导抗PRP水平≥1.0 μg/ mL。(1)
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未评估ActHIB疫苗的致癌或致突变潜力或对男性生育能力的损害。
14临床研究
14.1 ActHIB疫苗在2、4和6月龄儿童中的免疫原性
美国国立卫生研究院(NIH)支持的两项临床试验比较了在种族混合儿童人群中对三种b型流感嗜血杆菌结合疫苗的抗PRP抗体反应。这些研究是在田纳西州进行的(9)(表3)以及明尼苏达州、密苏里州和德克萨斯州(10)(表4),在2、4和6月龄婴儿中接种ActHIB疫苗和其他疫苗的b型流感嗜血杆菌结合疫苗。全部 b型流感嗜血杆菌结合疫苗与OPV疫苗和全细胞百白破疫苗在不同的地点同时接种。OPV疫苗和全细胞百白破疫苗目前都没有在美国获得许可或分发。
表3:在2、4和6月龄时接种两剂或3剂b型流感嗜血杆菌疫苗后的抗PRP抗体反应——田纳西州(9)
| MK, | N* | 几何平均浓度 ( μg/ mL) | 免后第3剂% ≥1.0 μg/ mL | ||
| 2月龄,免前 | 6月龄,免后第2剂 | 7月龄,免后第3剂 | |||
| PRP-T† (ActHIB疫苗) | 65 | 0.10 | 0.30 | 3.64 | 83% |
| PRP-OMP‡ (PedvaxHIB) | 64 | 0.11 | 0.84 | 不适用的 | 50%§ |
| HbOC¶ (HibTITER) | 61 | 0.07 | 0.13 | 3.08 | 75% |
* N =儿童人数
† b型流感嗜血杆菌结合疫苗(破伤风类毒素结合疫苗)
‡ b型流感嗜血杆菌结合疫苗(脑膜炎球菌蛋白结合物)
§显示了推荐的2剂初次免疫系列后的血清转化
¶ b型流感嗜血杆菌结合疫苗(白喉CRM197蛋白结合物)
N/A =不适用本对比试验,尽管第3剂数据已经公布
表4:在2月龄、4月龄和6月龄接种两个或三个剂量系列的b型流感嗜血杆菌疫苗后的抗PRP抗体反应–明尼苏达州、密苏里州、 得克萨斯州(10)
| 疫苗 | N* | 几何平均浓度 ( μg/ mL) | 免后第3剂†% ≥1.0 μg/ mL | ||
| 2月龄,免前 | 6月龄,免后第2剂 | 7月龄,免后第3剂† | |||
| PRP-T† (ActHIB疫苗) | 142 | 0.25 | 1.25 | 6.37 | 97% |
| PRP-OMP§ (PedvaxHIB) | 149 | 0.18 | 4.00 | 不适用的 | 85%¶ |
| HbOC# (HibTITER) | 167 | 0.17 | 0.45 | 6.31 | 90% |
* N =儿童人数
†接种第3剂疫苗后,分别从PRP T疫苗组和HbOC疫苗组的86名和110名婴儿中获得 b型流感嗜血杆菌结合疫苗(破伤风类毒素结合疫苗)血清
§ b型流感嗜血杆菌结合疫苗(脑膜炎球菌蛋白结合物)
¶显示了推荐的2剂初次免疫系列后的血清转化
# b型流感嗜血杆菌结合疫苗(白喉CRM197蛋白结合物)
N/A =不适用本对比试验,尽管第3剂数据已经公布(10)
美洲土著居民患b型流感嗜血杆菌疾病的发病率很高,并被观察到对b型流感嗜血杆菌结合疫苗的免疫应答较低。在一项招募阿拉斯加土著美国人的临床研究中,在6周、4个月和6月龄时接种3剂系列ActHIB疫苗后,75%的受试者在7月龄时(最后一次接种疫苗后1个月)抗PRP抗体滴度≥1.0 μg/ mL。(11)
14.2 ActHIB疫苗在12至24月龄儿童中的免疫原性
在四项独立的研究中,年龄在12至24月龄的儿童,如果以前没有接受过 b型流感嗜血杆菌结合疫苗接种用单剂ActHIB疫苗(表5).。12至15月龄的儿童抗PRP抗体应答的几何平均浓度(GMC)为5.12 μg/ mL(90%应答≥1.0 μg/ mL),17至24月龄的儿童为4.4 μg/ mL(82%应答≥1.0 μg/ mL)。(2)
表5:用单剂ActHIB免疫的12至24月龄的儿童中的抗PRP抗体反应
| 年龄层 | N* | 几何平均浓度 ( μg/ mL) | 具有以下特征的受试者百分比 ≥1.0 μg/ mL | ||
| 免前 | 免后† | 免前 | 免后† | ||
| 12到15月龄 | 256 | 0.06 | 5.12 | 1.6 | 90.2 |
| 17至24月龄 | 81 | 0.10 | 4.40 | 3.7 | 81.5 |
* N =儿童人数
†免疫接种后约1个月测量的免疫接种后反应
ActHIB疫苗已被发现对镰状细胞性贫血的儿童具有免疫原性,这种情况可能导致对b型流感嗜血杆菌疾病的易感性增加。在间隔两个月接种两剂ActHIB疫苗后,89%的儿童(平均年龄11个月)的抗PRP抗体滴度≥1.0 μg/ mL。这与接种两剂ActHIB疫苗后同龄无镰状细胞贫血儿童的抗PRP抗体水平相当。(12)
15 考文献
1赛诺菲巴斯德有限公司的存档数据。
2赛诺菲巴斯德公司的存档数据。
3 Rothstein EP,等。三种b型流感嗜血杆菌结合疫苗免疫后抗遗尿症的比较。儿科传染病杂志10:311-314,1991。
4 Chu CY,等。b型流感嗜血杆菌和肺炎球菌型6A多糖-蛋白结合物免疫原性的进一步研究。感染免疫40:245-246,1983。
5米勒·JH等在可复制培养基上生产高效白喉毒素(100 Lf)。免疫学杂志40:21-32,1941年。
6 Holmes SJ,等。四种b型流感嗜血杆菌结合疫苗在17至19个月儿童中的免疫原性。儿科杂志118:364-371,1991年。
7 Peltola H,等。使用荚膜多糖疫苗预防流感嗜血杆菌感染。英国医学杂志310:1561- 1566,1984年。
8免疫实践咨询委员会的建议(ACIP)。
b型嗜血杆菌结合疫苗用于预防婴儿和两个月以上儿童的b型流感嗜血杆菌疾病。MMWR 40:第RR- 1号,1991年。
9 Decker MD,等。四种b型流感嗜血杆菌结合疫苗的婴儿对比试验。《儿科杂志>第120卷第184- 189页,1992年。
10 Granoff DM,等。三种b型流感嗜血杆菌结合疫苗在婴儿中的免疫原性差异。《儿科杂志>第121期:187- 194页,1992年。
11 Bulkow LR等。四种b型流感嗜血杆菌结合疫苗在阿拉斯加土著婴儿中的免疫原性比较。儿科传染病杂志12:484-92,1993。
12 Kaplan SL,et al .患有镰状血红蛋白病或恶性肿瘤的儿童以及全身性b型流感嗜血杆菌感染后b型流感嗜血杆菌多糖-破伤风蛋白结合疫苗的免疫原性。儿科杂志120:367-370,1992年。
13美国疫苗不良事件报告系统。1990年MMWR 39:730-733。
14疾控中心。国家儿童疫苗伤害法案:要求永久疫苗接种记录和疫苗接种后报告选定事件。MMWR 37:197-200,1988年。
15 1986年国家儿童疫苗伤害法(1987年修订)。
16如何供应/储存和搬运
16.1如何供应
单剂量冻干疫苗瓶(第1瓶,共2瓶)(NDC 49281-547-58)与单剂量稀释剂瓶(第2瓶,共2瓶)(NDC 49281-546-58)包装在一起。每包5瓶(NDC 49281- 545-03)。
ActHIB疫苗和稀释剂的瓶塞不是用天然橡胶乳胶制成的。
16.2储存和搬运
在2至8℃(35至46℉)下储存与生理盐水稀释剂(0.4%氯化钠)包装在一起的冻干ActHIB疫苗。不要冷冻。丢弃未使用的部分。
17患者咨询信息
1986年国家儿童疫苗伤害法案要求在免疫接种前向患者、父母或监护人提供疫苗信息声明。
告知患者、父母或监护人疫苗的潜在益处和风险以及完成免疫接种系列的重要性,除非存在进一步免疫接种的禁忌症。除此之外,必须告知父母和监护人与使用ActHIB疫苗或其他含有类似成分的疫苗暂时相关的潜在不良反应。在接种ActHIB疫苗之前,医疗保健提供者应询问父母或监护人有关接受免疫接种的婴儿或儿童的近期健康状况。作为儿童免疫记录的一部分,应记录接种疫苗的日期、批号和制造商。(13)(14)(15)疫苗接种者和监护人必须向其医疗保健提供者和/或疫苗不良事件报告系统报告接种疫苗后的任何不良反应(VAERS)。
ActHIB、DAPTACEL和IPOL是赛诺菲巴斯德公司的注册商标。
PedvaxHIB是默克公司的注册商标。
HibTITER是Nuron Biotech的注册商标。
截至2022年3月的产品信息。
制造商:
赛诺菲巴斯德有限公司
分发人:
赛诺菲巴斯德公司。
美国宾夕法尼亚州斯威夫特沃特18370
Hits: 60