Progress fighting pancreatic cancer – one of the deadliest malignancies
更好的治疗效果可能来自于新药、增强免疫系统的策略以及更早地识别疾病。
- 2026年2月4日
- 8 min read
- 经过可知杂志
确诊胰腺癌无疑是晴天霹雳。虽然它仅占美国癌症病例的 3%左右,却是最致命的癌症之一,而且正朝着一个令人震惊的方向发展:预计到 2030 年, 胰腺癌在美国的死亡人数将超过除肺癌以外的任何其他癌症 。这种看似矛盾的现象之所以出现,是因为其他癌症的筛查和治疗取得了长足的进步,而胰腺癌的诊断和治疗仍然十分棘手。
尽管如此,加州埃尔塞贡多胰腺癌行动网络的首席科学和医疗官安娜·伯肯布利特表示,希望依然存在。该网络致力于支持相关研究并为患者提供帮助。科学家们正在测试一些能够抑制癌症驱动基因的新药,这些基因曾被认为无法用药物治疗。他们正在训练患者的免疫系统,使其能够攻击那些曾经被认为人体免疫系统无法识别的肿瘤。此外,他们还在利用人工智能技术,在胰腺癌早期脆弱阶段进行检测。
“我们的目标是将胰腺癌变成一种可治愈的疾病,”位于纽约长岛的卢斯特加滕基金会研究副总裁安德鲁·拉克曼说道,该基金会致力于支持胰腺癌的科学研究。或者至少,“让它成为一种可以生存、可以过上舒适生活,并且能够转变为慢性病的疾病。”
胰腺癌的五年生存率仅为 13%,令人堪忧。部分原因是胰腺肿瘤会被致密的瘢痕样组织包裹,阻碍药物和免疫细胞的吸收。小肿瘤发展迅速,但往往在扩散之前难以察觉,导致外科医生难以彻底切除所有癌细胞。
目前最大的希望之一是研发靶向 KRAS 蛋白的药物,KRAS 蛋白是细胞生长控制机制的一部分。在超过 90%的胰腺癌中,KRAS 的突变版本会持续处于“开启”状态,导致细胞不受控制地分裂。
癌症生物学家们很想找到一个可以插入 KRAS 基因的“小洞”,但他们一直找不到合适的地方。“有人跟我形容 KRAS 就像一个油腻的小球……上面根本没有可以插入抑制剂的‘小口袋’,”纽约冷泉港实验室的癌症生物学家佩奇·弗格森说道。她曾与人合著一篇关于胰腺癌治疗挑战的文章,发表在 2025 年 《癌症生物学年度评论》 上。
因此,研究人员另辟蹊径:他们设计了一种能与另一种细胞蛋白结合的药物。这种药物/蛋白组合能够捕获 KRAS 基因,抑制其活性。在一项早期试验中,38 名接受药物 daraxonrasib 治疗的胰腺癌患者平均生存期超过 8 个月 ,且病情未恶化。接受治疗的患者血液中的肿瘤 DNA 含量也较低 。
该药物的研发公司,位于加州雷德伍德城的 Revolution Medicines 公司, 正在进行一项更大规模的试验 。预计结果将于 2026 年中期公布,但美国食品药品监督管理局(FDA)已经提供了快速审批通道 。
疫苗研发进展
另一种引起关注的方法是疫苗。这些治疗性疫苗与预防感染的疫苗不同——它们用于已经患有癌症的人,训练免疫系统清除现有的或复发的肿瘤细胞。
与普通疫苗一样,癌症疫苗也提供某种免疫系统视为外来有害分子的物质。在这种情况下,这种分子是由癌细胞产生的,因此免疫系统应该攻击癌细胞。美国食品药品监督管理局(FDA)于 2010 年批准了首个治疗性癌症疫苗 ,用于治疗前列腺癌,目前针对其他癌症的疫苗正在进行试验 。
胰腺癌对早期增强患者自身免疫系统的尝试都产生了抵抗。“它有一种惊人的能力,能够阻止免疫系统攻击,并告诉免疫系统不要理会它,”拉克曼说道。
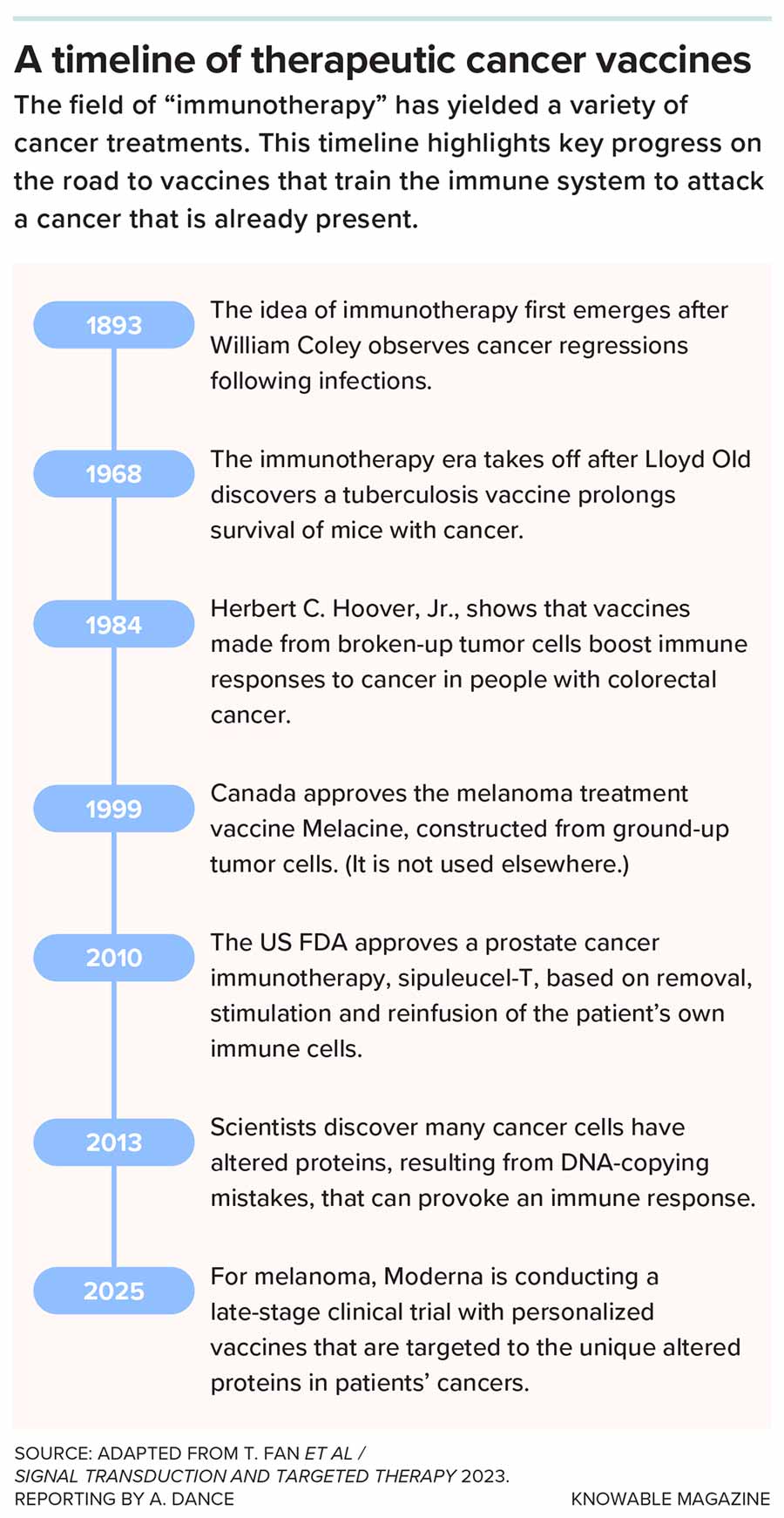
休斯顿德克萨斯大学 MD 安德森癌症中心的肿瘤内科医生舒巴姆·潘特表示,部分原因是肿瘤周围致密的组织如同“堡垒”一般。但如果将这层“堡垒”及其内部的肿瘤切除,残留的癌细胞就会失去保护。潘特及其同事推断,疫苗或许能够刺激免疫系统清除这些残余癌细胞。
科学家们与波士顿的 Elicio Therapeutics 公司合作,测试了一种含有两种突变 KRAS 蛋白片段的疫苗。他们希望这种疫苗能够训练免疫系统攻击含有这些突变的癌细胞。
研究团队进行了一项小型试验,纳入了 20 名胰腺癌患者和 5 名结直肠癌患者。在接受肿瘤切除手术后,21 名患者体内产生了针对癌细胞的活性免疫 T 细胞 。潘特表示,其中 17 名反应最强的患者“预后非常好”。他们血液中的肿瘤 DNA 含量下降,13 名患者在接种第一剂疫苗三年后仍然存活。
受到鼓舞,该团队研发出一种针对所有七种常见 KRAS 突变的疫苗。在一项更大规模的试验中,他们正在 158 人身上测试这种疫苗 。
纽约纪念斯隆-凯特琳癌症中心正在测试一种不同的疫苗。斯隆-凯特琳癌症中心奥拉扬癌症疫苗中心主任、外科医生兼科学家维诺德·巴拉钱德兰表示,科学家们首先仔细观察了少数胰腺癌患者,这些患者存活超过五年,不到十分之一。他们发现,幸存者体内会产生针对癌症的免疫反应 ,但免疫细胞并没有攻击突变的 KRAS 基因,而是攻击癌细胞 DNA 复制错误导致随机突变而产生的其他异常蛋白质。巴拉钱德兰说,当这些突变蛋白质出现在癌细胞表面时,就对免疫系统发出了“危险信号”。
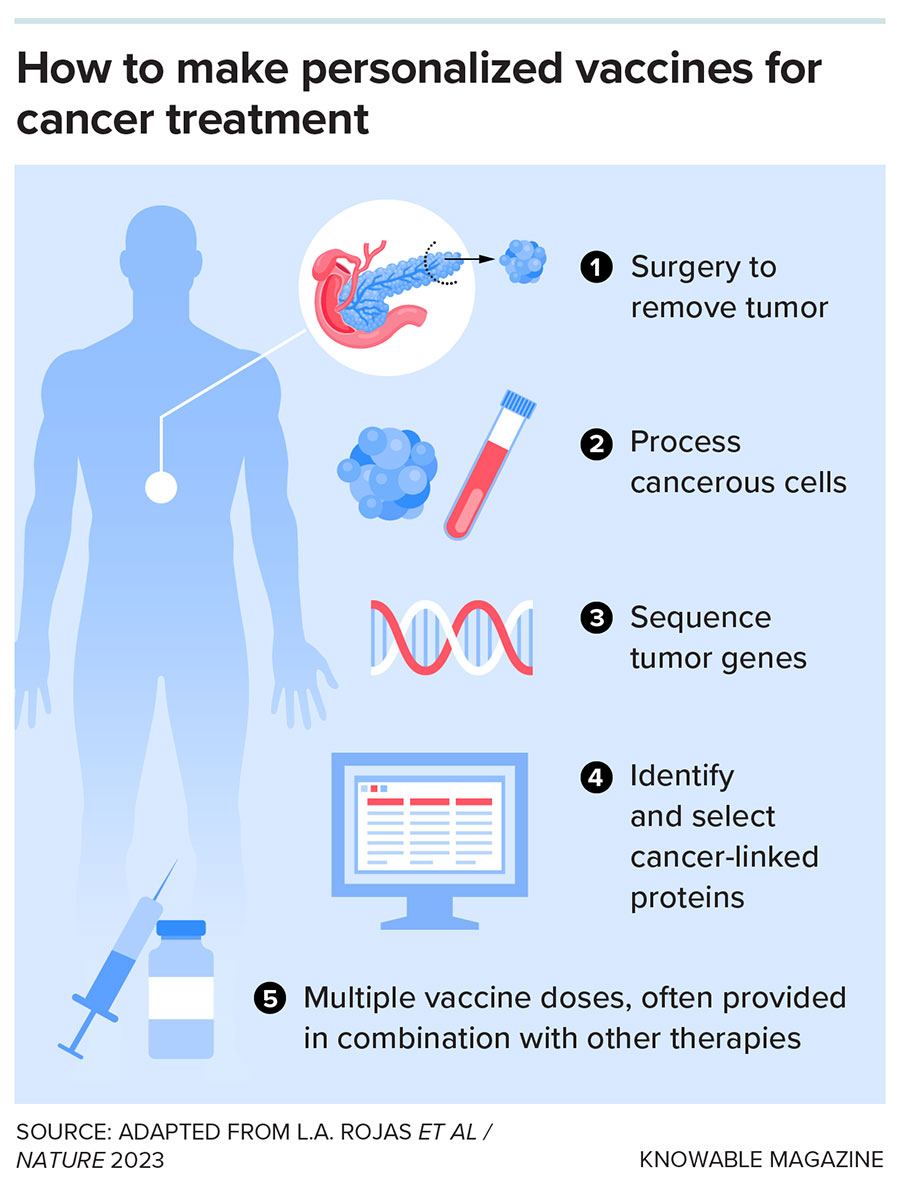
巴拉钱德兰希望让更多胰腺癌患者受益。因此,他和他的同事为试验参与者提供了定制疫苗,这些疫苗与他们的特定基因突变相匹配,由德国美因茨的 BioNTech 公司和美国加州南旧金山的基因泰克公司联合研发。
在早期试验中,疫苗使 16 名患者中的 8 名产生了针对突变蛋白的免疫 T 细胞 ,并且这些 T 细胞持续存在数年 。与无应答者相比,应答者的癌症无复发期也更长。所有 8 名应答者在治疗后至少存活了两年。一项更大规模的国际试验正在进行中。
推动早期诊断
阻止胰腺癌的另一种方法是尽早诊断,以便在癌症扩散之前切除肿瘤。
位于加州门洛帕克的 GRAIL 等诊断公司致力于通过筛查血液中的肿瘤 DNA 来检测胰腺癌和其他癌症。GRAIL 于 10 月在欧洲肿瘤内科学会大会上公布了其最新研究结果 :在 23161 名 50 岁及以上、近期无癌症病史且接受至少一年随访的人群中,该检测发现了 133 例癌症迹象 ,其中包括后来确诊的胰腺癌。在这些被正确诊断的癌症中,约有一半处于早期阶段。
但这项检测也出现了错误,有83人被误诊为癌症。弗格森表示,即使是非常好的检测也会有假阳性结果,而且胰腺癌非常罕见,大规模筛查会造成很多错误。因此,许多医生更倾向于只对高危人群进行筛查。
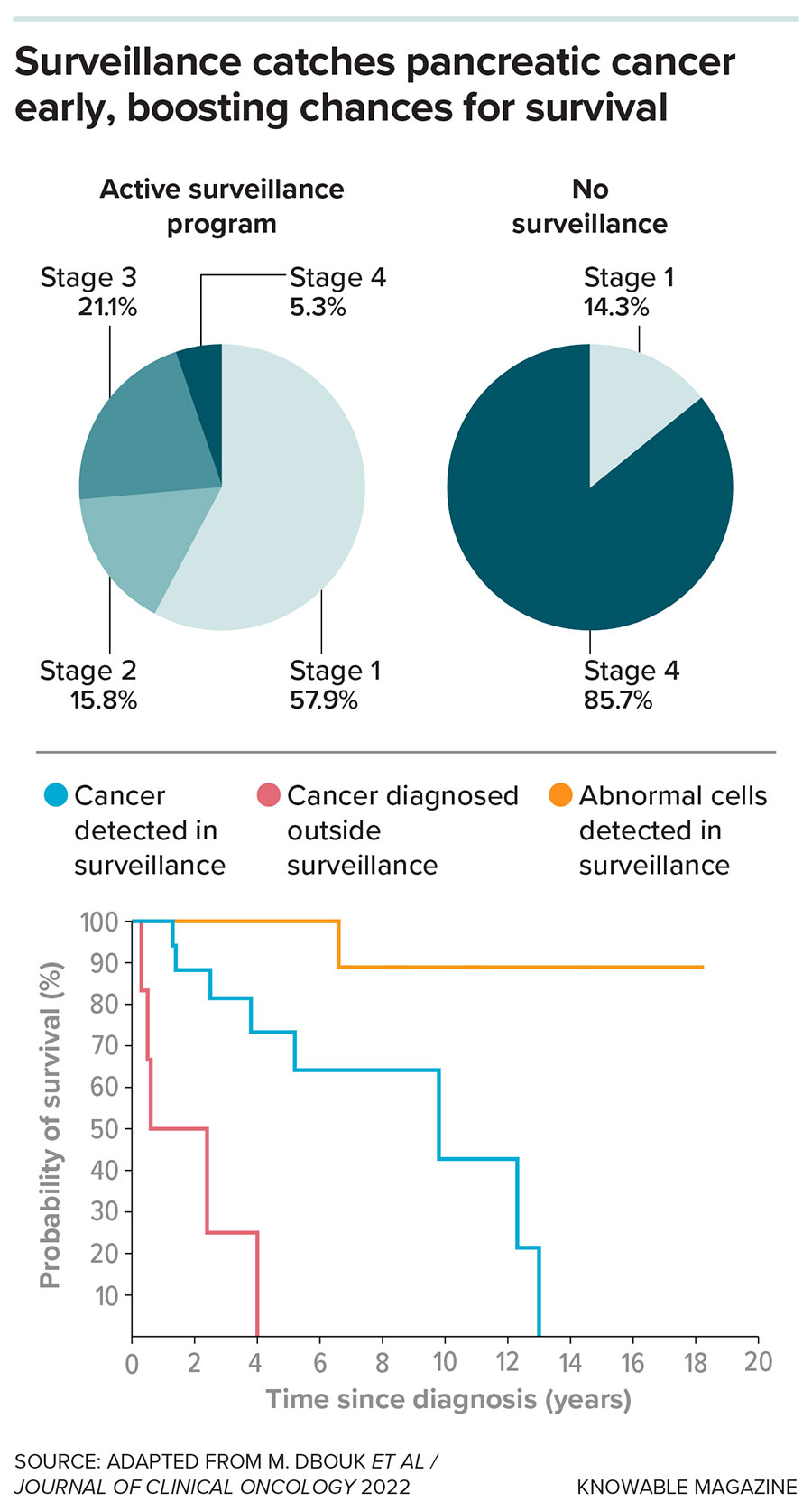
约翰·霍普金斯大学医学院(位于巴尔的摩)的胃肠病学家兼胰腺病学家文卡塔·阿克辛塔拉(Venkata Akshintala)表示,这一群体包括患有胰腺异常(例如囊肿)的人,以及携带癌症相关基因突变或有胰腺癌家族史的人。他是约翰·霍普金斯大学及其他临床中心开展的长期胰腺癌筛查研究的研究员之一。该研究旨在通过 DNA、胰腺分泌物或影像学检查,识别高危人群中早期癌症的迹象。
筛查似乎有效。“我们通常能在早期发现癌症,”阿克辛塔拉说。在 1731 名 CAPS 参与者中,有 19 人在接受监测期间被确诊。研究人员在 2022 年报告称,他们的平均生存期接近十年 ,而那些在确诊时未接受监测的人的平均生存期仅为 1.5 年。
约翰·霍普金斯大学的研究人员认为,利用人工智能识别胰腺癌相关的模式,尤其是在像阿克辛塔拉这样的胃肠病学家研究的黑白斑驳状内镜超声图像中,存在着改进的空间。这些图像是胃肠病学家用来寻找早期病变迹象的。该团队在 2024 年消化疾病周会议上报告称,将人工智能与医生的专业知识相结合,比单独使用任何一种方法都能更准确地预测癌症的进展。
回到 MD 安德森癌症中心,胃肠病学家苏雷什·查里正在研究胰腺癌早期诊断的另一个有希望的线索:近期血糖检测结果显示类似 2 型糖尿病,且通常伴有不明原因的体重下降。正常情况下,胰腺通过释放激素来控制血糖。但查里说,在这种情况下,“胰腺癌会导致你的葡萄糖代谢紊乱”。
查里及其同事在一项医疗记录研究中发现,结合血糖变化和体重减轻的风险评分能够准确预测九名最终确诊胰腺癌患者中的七名。查里指出,大多数高分者并未患胰腺癌,但这项筛查缩小了可能需要进一步检查的人群范围。基于这项研究,他希望测试一种临床方法,即让高分者在血糖检测结果出来后的 15 天内接受一次人工智能辅助的 CT 扫描。
这些正在研发的检测和治疗方法可能意味着胰腺癌不会永远是最致命的癌症之一。“我认为在未来10年内,”伯肯布利特说,“我们会看到生存率的提高。”
Hits: 0
- 什么是甲状腺癌?
- 甲状腺癌的检查
- 导致人类癌症的 7 种病毒
- 年轻人的癌症发病率呈上升趋势:关于筛查和风险的知识
- 世界卫生组织表示,十分之四的癌症是可以预防的
- 对抗胰腺癌(最致命的恶性肿瘤之一)的进展
