Contents
SARS-CoV-2 mRNA vaccines sensitize tumours to immune checkpoint blockade
自然 volume 647, pages488–497 ( 2025 )
摘要
免疫检查点抑制剂(ICIs)可延长许多癌症患者的生存期,但对缺乏预存免疫力的患者无效 1,2,3,4,5,6,7,8,9 。 尽管个性化 mRNA 癌症疫苗可通过引导免疫攻击预先选定的抗原来增强肿瘤对 ICIs 的敏感性,但其生产过程复杂且耗时,限制了个性化疫苗的应用 10,11,12,13,14 。 本文研究表明,靶向 SARS-CoV-2 的 mRNA 疫苗也能增强肿瘤对 ICIs 的敏感性。在临床前模型中,SARS-CoV-2 mRNA 疫苗可显著提高 I 型干扰素水平,从而使固有免疫细胞能够启动靶向肿瘤相关抗原的 CD8 + T 细胞。对于免疫冷肿瘤,需要同时进行免疫检查点抑制剂(ICI)治疗才能达到最大疗效,因为这类肿瘤的反应表现为 PD-L1 表达增加。在人体中也发现了类似的疫苗接种反应相关因素,包括 I 型干扰素水平升高、健康志愿者体内髓系-淋巴系细胞活化以及肿瘤细胞 PD-L1 表达增加。此外,在多个大型回顾性队列研究中,在开始 ICI 治疗后 100 天内接种 SARS-CoV-2 mRNA 疫苗与中位生存期和三年总生存期的显著改善相关。这种获益在免疫冷肿瘤患者中也同样存在。综上所述,这些结果表明,目前临床可用的靶向非肿瘤相关抗原的 mRNA 疫苗是有效的免疫调节剂,能够增强肿瘤对 ICI 的敏感性。
主要的
尽管免疫检查点抑制剂(ICIs)能显著改善部分患者的生存期,但大多数患者无法从中获益 1,2,3,4,5,6,7,8,9 。 这种疗效不佳的原因在于肿瘤微环境(TME)具有免疫抑制特性,其特征是耐受性树突状细胞(DCs)、髓系抑制细胞和调节性 T 细胞,并且在某些组织学类型中,免疫治疗开始前肿瘤内 PD-L1 表达水平较低即可预测这种免疫抑制特性。然而,目前尚无临床可用的方法通过改变 TME 来改善 ICI 的疗效。我们近期报道,全身性注射高免疫原性 mRNA 纳米颗粒可诱导类似病毒血症的细胞因子/趋化因子反应,从而重置全身和肿瘤内免疫微环境,使耐药肿瘤对 ICIs 重新敏感 10,11,12,14 。 尽管我们和其他研究者正在开发的个性化 mRNA 疫苗仍处于临床评估阶段( NCT04573140 ) 12 ,但 COVID-19 mRNA 疫苗也能强烈刺激细胞因子分泌 15 ,并且目前已有多个病例报告显示,患者在接种 COVID-19 mRNA 疫苗后肿瘤自发消退 16,17 。然而,COVID-19 mRNA 疫苗对免疫疗法的影响尚不清楚。
本文报道,SARS-CoV-2 刺突蛋白 mRNA 疫苗诱导的先天免疫反应能够重置癌症免疫治疗周期,并启动适应性免疫,从而与免疫检查点抑制剂(ICIs)产生协同作用。我们发现,在非小细胞肺癌(NSCLC)和黑色素瘤患者中,于 ICI 治疗开始后 100 天内接种 SARS-CoV-2 mRNA 疫苗可显著改善总生存期(OS)。在临床前模型中,我们发现这种效应需要 I 型干扰素(IFN)的激增,从而增强淋巴器官中抗原呈递细胞(APC)对 T 细胞的启动作用。尽管肿瘤细胞可通过增加 PD-L1 表达来抑制这些启动的免疫反应,但联合使用 ICIs 仍能维持 T 细胞反应,并诱导针对肿瘤相关抗原的表位扩散。我们揭示了接种 COVID-19 mRNA 疫苗的人类也出现了类似的反应相关性,包括 IFNα 生成增加、先天性和适应性免疫激活以及肿瘤 PD-L1 表达增加。总之,我们的研究结果表明,目前临床可用的靶向非肿瘤抗原的 mRNA 疫苗是有效的免疫调节剂,能够增强肿瘤对免疫检查点抑制剂的敏感性。
新冠疫苗接种可提高生存率
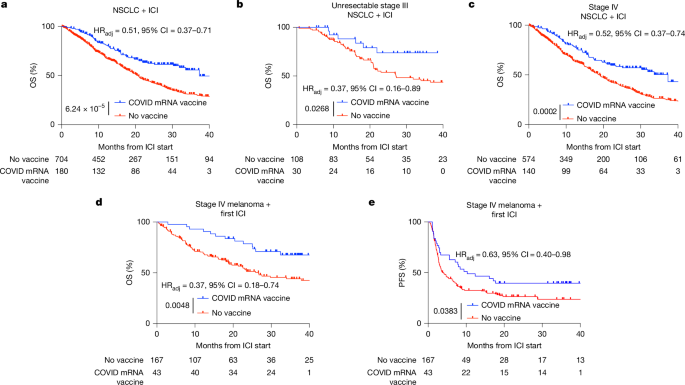
为了确定 COVID-19 mRNA 疫苗是否与免疫检查点阻断疗法的疗效改善相关,我们首先比较了 2015 年 1 月至 2022 年 9 月期间在德克萨斯大学 MD 安德森癌症中心 (MDACC) 接受治疗的 III/IV 期非小细胞肺癌 (NSCLC) 患者队列的总生存期 (OS)(补充表 1a )。我们确定了 180 例在免疫检查点抑制剂 (ICI) 治疗开始后 100 天内接种了 COVID mRNA 疫苗的患者,以及 704 例接受 ICI 治疗但未接种 COVID 疫苗的患者(补充表 1a )。在 180 例在 ICI 治疗开始后 100 天内接种了 mRNA 疫苗的患者中,117 例接种了 BNT162b2 疫苗,63 例接种了 mRNA-1273 疫苗(扩展数据图 1a )。在 ICI 开始后的 100 天内,24 人仅接受了初次免疫,57 人仅接受了加强免疫,93 人同时接受了初次免疫和加强免疫,5 人接受了 2 次加强免疫,1 人接受了初次免疫和 2 次加强免疫(扩展数据图 1b );在 100 天内,81 人接受了 1 剂 COVID-19 mRNA 疫苗,98 人接受了 2 剂,1 人接受了 3 剂(扩展数据图 1c )。在使用 Cox 比例风险回归控制 39 个协变量(包括临床分期、组织学、类固醇使用、体能状态、突变状态、合并症和治疗年份)后,我们发现,在开始 ICI 治疗后 100 天内接种 COVID-19 mRNA 疫苗与中位 OS(20.6 个月 vs 37.3 个月)和 3 年 OS(30.8% vs 55.7%,调整后风险比 (HR adj = 0.51,95% 置信区间 (CI) = 0.37–0.71, P < 0.0001))的显著改善相关(图 1a 和补充表 2 和 3 )。 对于 III 期不可切除的非小细胞肺癌(NSCLC)患者(调整后 HR = 0.37,95% CI = 0.16–0.89, P = 0.0268)(图 1b 和补充表 4 和 5 )以及 IV 期 NSCLC 患者( 调整后 HR = 0.52,95% CI = 0.37–0.74, P = 0.0002)(图 1c 和补充表 6 和 7 ),均观察到类似的生存优势;对于接种过任何疫苗生产商的 mRNA 疫苗的患者(扩展数据图 1a ),以及对于既往接种过或未接种过 COVID-19 mRNA 疫苗的患者(扩展数据图 1b ),也观察到类似的生存优势。在免疫检查点抑制剂(ICI)治疗开始前后 100 天内接种过两种疫苗的患者,其总生存期(OS)与仅接种过一种疫苗的患者相似(扩展数据图 1c )。即使仅考虑在首次免疫检查点抑制剂(ICI)治疗前 100 天内接种过最近一次 mRNA 疫苗的患者(扩展数据图 1d ),将疫苗接种窗口期缩短至 50 天而非 100 天(扩展数据图 1e ),仅考虑在疫情期间接受治疗的患者(扩展数据图 1f ),校正永生时间偏倚后(扩展数据图 1g ),以及采用倾向评分匹配(PSM;扩展数据图 1h、i ),这些结果仍然一致。在化疗后 100 天内接种过 COVID-19 疫苗(由于不同药物组间存在显著异质性和患者数量有限,该组不包括靶向治疗)但未接受 ICI 治疗的患者,其生存获益也未达到可检测到的水平(扩展数据图 2a )。同样,在开始 ICI 治疗前 100 天内接种过肺炎或流感疫苗的患者(扩展数据图 1b)的生存获益也未达到可检测到的水平。 2b–e )以及可切除的 III 期肿瘤患者(扩展数据图)。 2f,g)生存率没有提高。
图 a – e 分别展示了接受免疫检查点抑制剂(ICI)治疗的非小细胞肺癌(NSCLC)(图 a – c )或转移性黑色素瘤(图 d 、 e )患者的生存情况,这些患者在开始 ICI 治疗后 100 天内接种了 COVID-19 mRNA 疫苗,或未接种 COVID-19 mRNA 疫苗。图中显示了所有 NSCLC 患者(图 a )、不可切除的 III 期 NSCLC 患者(图 b )、IV 期 NSCLC 患者( 图 c )以及转移性黑色素瘤患者(图 d 和 e ) 的生存情况。P 值和校正后的风险比(HR adj) 采用双侧 Cox 比例风险回归模型计算( 见补充表 3、5、7、9 和 11 ), 该模型纳入了所有在单因素分析中与生存显著相关的变量( 见补充表 2、4、6、8 和 10 ) 。每个时间点的风险患者人数标注在各图下方。
随后,我们对另一组接受首次免疫检查点抑制剂(ICI)治疗转移性黑色素瘤的患者重复了上述分析,其中包括 43 例在开始 ICI 治疗后 100 天内接种了 COVID-19 mRNA 疫苗的患者和 167 例未接种 COVID-19 疫苗的患者(补充表 1b )。在接种 mRNA 疫苗的患者中,21 例接种了 BNT162b2,22 例接种了 mRNA-1273(扩展数据图 3a );6 例仅接种了初次免疫,8 例仅接种了加强免疫,16 例接种了初次免疫和加强免疫,13 例在我们关注的时间段内接种了 2 剂加强免疫(扩展数据图 3b );14 例在 100 天内接种了 1 剂 COVID-19 mRNA 疫苗,29 例接种了 2 剂(扩展数据图 3c )。在采用 Cox 比例风险回归模型,校正了包括组织学类型、类固醇使用情况、体能状态、突变状态、合并症和治疗年份在内的协变量后,我们发现,在开始免疫检查点抑制剂(ICI)治疗后 100 天内接种 COVID-19 mRNA 疫苗与总生存期(OS)的显著改善相关(中位 OS 为 26.67 个月,而未达到预期;36 个月 OS 为 44.1%,而未达到预期; 调整后 HR=0.37,95% CI=0.18–0.74, P =0.0048)(图 1d 和补充表 8 和 9 ),以及无进展生存期(PFS)的显著改善相关(中位 PFS 为 4.0 个月,而未达到预期;36 个月 PFS 为 23.7%,而未达到预期; 调整后 HR=0.63,95% CI=0.40–0.98, P =0.0048)。 0.0383)(图 1e 和补充表 10 和 11 )。这些效应在两家疫苗生产商(扩展数据图 3a )、初免和加强疫苗(扩展数据图 3b )、接受单剂或多剂疫苗的患者(扩展数据图)中再次相似。 3c ),当分析仅限于在开始免疫检查点抑制剂(ICI)治疗前接种疫苗的患者时(扩展数据图 3d ),当分析仅限于在疫情期间接受治疗的患者时(扩展数据图 3e、f ),以及当分析范围扩大到包括接受二线或三线治疗的患者以及无远处转移的患者时(扩展数据图 3g-i ),生存优势依然存在。此外,倾向性评分匹配(PSM)进一步放大了生存优势(总生存期:HR = 0.44,95% CI = 0.18-0.77, P = 0.0063;无进展生存期:HR = 0.46,95% CI = 0.27-0.77, P = 0.0022)(扩展数据图 3j、k )。
I 型干扰素介导 RNA 疫苗免疫
为了验证在人体中观察到的效应是否能在动物身上重现,我们重新制备了市售的 COVID-19 mRNA 疫苗,并将其与免疫检查点抑制剂(ICIs)联合用于荷瘤动物。由于 SARS-CoV-2 刺突蛋白的序列已被完全测定,我们合成了辉瑞/BioNTech 疫苗(BNT162b2)中使用的已发表的 mRNA 构建体,并根据 mRNA 的大小(扩展数据图 4a、b )和体内给药后诱导中和抗体的能力(扩展数据图 4c )验证了合成的准确性。 mRNA 被封装在脂质纳米颗粒(LNP)中,其封装效率、粒径分布、多分散性和电荷均符合 BNT162b2 临床制剂的规格范围 18 (扩展数据图 4d-g )。我们发现,缓冲液条件会对电荷产生显著影响,导致净正电荷(扩展数据图 4h )。我们选择小鼠 B16F0 黑色素瘤和 Lewis 肺癌(LLC)作为模型来测试刺突蛋白 RNA-LNP 疫苗的免疫原性和有效性,因为该疫苗在这些临床环境中有效,而且这两种肿瘤模型对免疫检查点抑制剂(ICI)的反应较差。我们首先用两剂疫苗联合 ICI 治疗小鼠。我们发现,对于肿瘤体积约为 80 mm³ 的已建立 B16F0 肿瘤的小鼠(图 2a 和扩展数据图 5a ),对于皮下 (sc) LLC 的小鼠(图 2b 和扩展数据图 5b),以及对于肿瘤体积约为 100 mm³ 的已建立 sc LLC 的小鼠(图 2c 和扩展数据图 5b ),该方案均优于单独的单药治疗。 5c )。在已建立 LLC 的小鼠中,我们发现未经治疗的小鼠肺部存在转移性病灶,单药治疗组与对照组相似,但联合治疗组显著减少(扩展数据图 5d、e )。我们还发现,在 ICI 治疗前使用 RNA-LNPs 与同时治疗组的效果相似(扩展数据图 5f )。接下来,我们测试了 RNA-LNPs 是否能抑制原位肺内肿瘤的生长。我们将 LLC 细胞原位植入,并从第 3 天开始进行治疗。在该模型中,RNA-LNPs 与 ICI 联合治疗显著抑制了肿瘤生长,肺重量显著降低(扩展数据图 5g )。
a ,接种 B16F0 细胞的小鼠的实验设计和肿瘤体积。分组包括未处理组(UT; n = 7)、抗 PD-1 组( n = 8)、RNA-LNP 组( n = 8)和 RNA-LNP+抗 PD-1 组( n = 8)。mAb,单克隆抗体 。b ,接种 LLC 细胞的小鼠的实验设计和肿瘤体积。分组包括未处理组( n = 8)、抗 PD-1 组( n = 9)、RNA-LNP 组( n = 9)和 RNA-LNP+抗 PD-1 组( n = 9) 。c ,接种 LLC 细胞的小鼠的实验设计和肿瘤体积测量。分组包括未处理组(n = 9)、抗 PD-1 组( n = 10)、RNA-LNP 组 (n = 7)和 RNA-LNP+PD-1 组( n = 8)。 d ,接种 B16F0 细胞的小鼠的实验设计和肿瘤体积。每组 n =12。e , 接种单次 RNA-LNP 疫苗 24 小时后(第 3 天),对B16F0-tumour-bearing只小鼠(每组 n =8)进行血浆 IFNα酶联免疫吸附试验(ELISA) 。f – i ,接种第三次疫苗后 24 小时内(第 3、6 和 20 天),对携带 B16F0 肿瘤的小鼠脾脏细胞进行细胞表型分析(每组 n =5),包括活化(CD80 + CD86 + )树突状细胞(DC)( f )和巨噬细胞( g )的百分比 。h , i ,活化成熟树突状细胞(DC)( h )和巨噬细胞( i )上 PD-L1 的中位荧光强度(MFI)。 j – o ,对接种疫苗 2 后 24 小时(第 10 天和第 13 天)携带 B16F10-ova 肿瘤的小鼠的肿瘤引流淋巴结 (tdLN) 和脾脏中的髓系细胞进行抗原呈递表征。 图中显示了表达 MHC-II 的 CD45 + 细胞的总百分比 ( j )、表达 SIINFEKL 的 MHC-II + 细胞的百分比 ( k )、表达活化标志物 CD86 的 SIINFEKL 表达 MHC-II + 细胞的百分比 ( l )、MHC-II + Ly6C + CD45 + 细胞的百分比 ( m )、SIINFEKL + MHC-II + Ly6C + 细胞占所有 CD45 + 细胞的百分比 ( n ) 以及 Ly6C + MHC-II + 细胞占所有 SIINFEKL 表达细胞的百分比 ( o )。每组 n = 4 只生物学独立的实验小鼠。采用双因素方差分析 (ANOVA)/混合效应分析(Geisser-Greenhouse 校正)( a – d )和双尾非配对 t 检验( e – o )确定显著性 。n 表示生物学独立样本的数量。对于箱线图,须线延伸至最高值和最低值,箱体上下限分别表示第一四分位数和第三四分位数,中心线表示中位数。 对于 a – d ,数据以平均值±标准误表示。
接下来,我们试图了解靶向刺突蛋白的 RNA-LNP 介导这些抗肿瘤作用的机制。为此,我们使用了 B16F0 早期治疗模型,分别采用或不采用细胞因子阻断抗体。在该模型中,RNA-LNP 和 PD-L1 阻断均能带来数值上的生存获益,但统计学意义不显著。然而,RNA-LNP 与 PD-L1 阻断的联合治疗显著抑制了肿瘤生长(图 2d 和扩展数据图 6a、b )。尽管我们之前已证实 IFNα在 mRNA 疫苗的免疫应答中发挥作用,但最近的证据表明,IL-1 信号通路在靶向 COVID-19 刺突蛋白的特定 RNA-LNP 的免疫应答中起主导作用 15 。因此,我们使用阻断 IL-1 和 IFNα受体的抗体评估了各信号通路的重要性。阻断 IL-1R 对肿瘤生长没有影响,但当使用 IFNAR1 单克隆抗体阻断 I 型干扰素信号通路时,抗肿瘤反应完全消失(图 2d )。此外,直接给予超生理剂量的 I 型干扰素可重现抗肿瘤效应(扩展数据图 6c )。然而,使用低分子量(LMW)聚肌苷酸胞苷酸(poly(I:C))刺激 I 型干扰素信号通路并未诱导类似的免疫反应(扩展数据图 6d )。这些结果凸显了干扰素在驱动先天性和适应性免疫中的重要性,以及在免疫检查点抑制剂(ICIs)存在的情况下,使用市售 mRNA 制剂可以调控和重置免疫设定点,使其从耐受状态转向效应免疫反应的能力。
接下来,我们试图评估其他 mRNA 种类是否也能产生类似的抗肿瘤作用。我们首先对 mRNA 编码的蛋白质进行改造,用编码巨细胞病毒抗原 pp65 的 mRNA 替换刺突蛋白 mRNA。pp65 在人脑胶质瘤中过表达,但在 B16F0 细胞中不表达。我们发现这两组之间的抗肿瘤活性没有显著差异,这表明 mRNA 本身的先天免疫识别是 mRNA 疫苗发挥抗肿瘤作用的主要驱动因素(扩展数据图 6e,f )。
由于在 COVID-19 mRNA 疫苗中用 N1- 甲基假尿苷代替尿苷以降低先天免疫激活,我们假设用尿苷替代 N1- 甲基假尿苷来激活模式识别受体,可以增强先天免疫激活和抗肿瘤活性。正如预期的那样,在 pp65 mRNA 中用尿苷替代 N1- 甲基假尿苷与免疫检查点抑制剂(ICI)的协同作用进一步增强(扩展数据图 6e,f )。然而,在刺突蛋白 mRNA 中用尿苷替代 N1- 甲基假尿苷仅使抗肿瘤反应在数值上有所改善(扩展数据图 6e,f ),这表明先天免疫感知是一个多因素过程,可能受到特定 mRNA 结构的影响。
随后,我们开展了进一步的研究,以确定 RNA-LNPs 如何诱导抗肿瘤免疫。先前的研究表明,RNA-LNPs 可通过刺激细胞内双链 RNA(dsRNA)传感器 MDA5 来刺激 I 型干扰素的产生 19 。然而,RNA-LNPs 激活该传感器的机制尚不清楚。为了进一步了解这一机制,我们首先通过检测我们制备的单链 RNA(ssRNA)产品中 dsRNA 的污染水平,排除了 dsRNA 在我们疫苗中的作用。我们发现 mRNA 中 dsRNA/ssRNA 的比例为 0.011%(扩展数据图 7a )。然后,我们重复了肿瘤生长曲线实验,并加入了额外的 dsRNA 去除方案 20 。通过这一步骤,我们成功去除了所有可检测到的 dsRNA 污染(扩展数据图 7a )。重要的是,我们发现,使用该方法完全消除 dsRNA 后,抗肿瘤疗效并未发生改变(扩展数据图 7b )。此外,我们发现,在缺乏 RIG-I(dsRNA 的关键传感器和 I 型干扰素反应的激活因子)的小鼠中,RNA-LNP 给药后,I 型干扰素的活性并未降低(扩展数据图 7c )。综上所述,这些数据表明,dsRNA 并非我们临床前模型中抗肿瘤效应的主要原因。
接下来,我们测试了特定 LNP 构建体在相同 mRNA 输入量下是否会影响抗肿瘤免疫。我们发现,以脂质颗粒聚集体(LPA)形式制备的阴离子脂质体复合物并未产生类似的抗肿瘤效应(扩展数据图 7b )。鉴于既往文献报道高级 RNA 结构也可能刺激 MDA5 活化 21 ,我们假设 RNA-LNP 可能形成高级结构。与此假设一致,我们发现从 RNA-LNP 中提取的 RNA 含有与 dsRNA 质量相似的高分子量二级结构(扩展数据图 7d 和补充图 1 )。结合先前关于 RNA-LNP 而非单独的 ssRNA 可激活 MDA5 的报道,这些数据可能提示一种机制:LNP 的包封作用形成高分子量二级结构,从而激活双链传感机制(即 MDA5),进而诱导 I 型干扰素的产生。
RNA 疫苗可刺激先天免疫
接下来,我们试图更好地了解 RNA-LNP 对固有免疫细胞的影响。在 RNA-LNP 组和联合治疗组中,IFNα水平显著升高,同时伴有其他 T 辅助细胞 1 型趋化因子(图 2e 和扩展数据图 8 )。这种细胞因子/趋化因子反应的激增与单独使用 RNA-LNP 或联合免疫检查点抑制剂(ICI)治疗的小鼠淋巴器官中髓系细胞活化的增加相关。用编码刺突蛋白的 RNA-LNP 治疗后,淋巴网状器官中抗原呈递细胞(APC)的活化迅速增强,包括树突状细胞(DC)、巨噬细胞和表达 MHC II 类分子(MHC-II)的 Ly6C + 细胞,而 IFNAR1 阻断剂可抑制这种活化(图 2f-i ,扩展数据图 9a、b ,补充表 12 和补充图 2 )。尽管这种反应依赖于干扰素信号传导,但仅通过全身性 IFNα 与 ICI 联合给药无法达到这种反应的强度(图 2f–i 和扩展数据图 9a,b )。
髓系细胞活化延伸至肿瘤部位,其中 RNA-LNP 的接收与 IFNAR1 依赖性的活化 Ly6C + 髓系细胞增加相关(扩展数据图 9c 和补充图 3 )。为了确定髓系细胞活化增强是否与肿瘤抗原呈递增强相对应,我们在第 10 天和第 13 天用表达鸡卵清蛋白的 B16F10 肿瘤(B16F10-OVA)治疗小鼠,并使用流式细胞术评估 MHC-I 上卵清蛋白的呈递情况。我们发现,在共刺激分子存在的情况下,编码刺突蛋白的 RNA-LNP 刺激抗原呈递细胞(APC)在淋巴器官中呈递肿瘤抗原(图 2j-l 和补充图 4 )。值得注意的是,在共刺激分子存在的情况下,肿瘤抗原的呈递在 Ly6C + MHC-II + 细胞中尤为富集(图 2m-o )。
RNA 疫苗可重编程适应性免疫
除了抗原呈递细胞(APC)的迅速激活外,编码刺突蛋白的 RNA-LNP 与免疫检查点抑制剂(ICI)联合使用还能诱导 CD8 + T 淋巴细胞扩增,并显著增强效应细胞和效应记忆细胞的激活(图 3a、b ,扩展数据图 9d ,补充表 13 和补充图 5 )。与这些结果相一致的是,T 细胞和效应/效应记忆 CD8 + 细胞亚群中 PD-1 的表达增加,凸显了联合疗法快速启动 T 细胞的强大能力(扩展数据图 9e、f 和补充图 6 )。总而言之,这些结果表明,全身免疫调节在将髓系细胞募集到淋巴器官以向同源 T 细胞呈递肿瘤抗原方面发挥着重要作用。
a 、 b ,第 21 天(疫苗接种第 3、6、17 天)荷瘤小鼠脾脏中活化效应 T 细胞( a ) 和效应记忆 T 细胞( b )的百分比(每组 n =5)。c,第 21 天(疫苗接种第 14 和 17 天)从荷瘤 B16F0 小鼠脾脏中收集的 CD8 + T 细胞中四聚体阳性细胞的百分比。分组包括未治疗组( n =6)、抗 PD-1 组( n =6)、RNA-LNP 组( n =5)和 RNA-LNP+抗 PD-1 组( n =7) 。d ,脾细胞与重叠肽池共培养后,AIM + T 细胞的标准化百分比( 每种肽 5 只小鼠;例外情况见补充信息 )。图 e 、 f 分别为接种疫苗 3 后 24 小时(第 3、6 和 20 天)从接受或未接受抗 PD-L1 治疗的B16F0-tumour-bearing小鼠皮下肿瘤中 PD-1 + CD3 + 细胞的免疫荧光代表性图像( e )和盲法人工计数(每组 n=4 个肿瘤,每个肿瘤计数 4 次)( f )。图 e 中,比例尺为 100 μm。AF647,Alexa Fluor 647。 图 g 为接种 RNA-LNP 疫苗的 B16F0 荷瘤小鼠(第 14 和 17 天)肿瘤中 PD-1 + CD8 + 细胞占 CD3 + T 细胞的百分比。分组包括未治疗组( n = 7)、抗 PD-L1 治疗组( n = 8)、RNA-LNP 治疗组( n = 9)和 RNA-LNP+抗 PD-L1 治疗组( n = 7) 。h ,B16F0 肿瘤中 CD8 + T 细胞的四聚体阳性率(%)。分组包括未治疗组( n = 6)、抗 PD-1 治疗组( n = 6)、RNA-LNP 治疗组( n = 4)和 RNA-LNP+抗 PD-1 治疗组( n = 7)(RNA-LNP 治疗于第 14 天和第 17 天进行)。 i ,采用流式细胞术检测疫苗 3 接种后 24 小时(第 3、6 和 17 天)从小鼠体内分离的 B16F0 肿瘤细胞(CD45 – FSC-A+ )上的 PD-L1 表达。分组包括未处理组( n = 4)和 RNA-LNP 组( n = 5) 。j 、 k ,对疫苗 3 接种后 24 小时(第 3、6 和 21 天)从B16F0-tumour-bearing只小鼠体内分离的 PD-L1 + 肿瘤细胞(SOX10)进行盲法人工计数(每组 n = 6 个肿瘤,每个肿瘤计数 4 次)( j )和代表性图像( k )。k 图中标尺为 50 μm。j 图中,圆圈符号表示 PBS 处理,方块符号表示抗 PD-L1 处理。f 和 j 图中,颜色代表单个肿瘤。采用双尾非配对 t 检验( a – c 和 g – j )、双尾 Welch t 检验( f )以及双尾 Brown-Forsythe 和 Welch 方差分析,并进行 Dunnett T3 多重比较检验( d )来确定显著性。箱线图中,须线延伸至最高值和最低值,箱体上下限分别代表第一四分位数和第三四分位数,中线代表中位数。除非另有说明, n 值表示生物学独立样本。
为了证实刺突蛋白 RNA-LNP 介导了肿瘤反应性 T 细胞的扩增,我们从经治疗小鼠的脾脏中分离出 CD8 + 细胞,并用靶向六种黑色素瘤相关抗原(GP-100 EGSRNQDWL、GP-100 KVPRNQDWL、claudin 6 (CLDN6)、survivin、WT1 和 Trp2)中具有高预测结合亲和力的肽段的四聚体进行染色。我们发现,RNA-LNP 与免疫检查点抑制剂(ICIs)联合治疗刺激了靶向上述每种抗原的四聚体反应性 T 细胞的扩增(图 3c 和补充图 7 )。为了确认这些 T 细胞确实具有肿瘤反应性,我们使用了激活诱导标记物(AIM)检测 22,23 。在本实验中,通过检测 AIMs CD69 和 4-1BB 的串联表达,鉴定出在体外用来自相同肿瘤抗原的重叠肽库培养的抗原反应性 T 细胞(补充图 8 和补充表 14 )。利用这种方法,我们检测到经 RNA-LNPs 和 ICI 联合治疗的小鼠体内肽反应性(AIM + )CD8 + T 细胞显著增加,进一步支持了肿瘤反应性(图 3d )。这些数据证实,刺突 RNA-LNPs 能够启动免疫应答,促进肿瘤相关抗原的激活、呈递和识别,并且这种启动作用可通过与 ICI 联合治疗显著增强。
RNA 疫苗诱导 T 细胞浸润
接下来,我们评估了经治疗肿瘤中的 T 细胞群。在 B16F0 肿瘤小鼠中,我们利用免疫荧光(图 3e、f ,补充图 6 和补充表 15 )和流式细胞术(图 3g )均检测到 PD-1 + CD8 + T 细胞的大量浸润。重要的是,我们发现 RNA-LNP 和 ICIs 治疗使肿瘤浸润 CD8 + 细胞中 PD-1 的表达增加了 20 倍以上(2.39% vs. 51.363%, P < 0.0001)(图3f ),并且在经治疗的小鼠中,PD-1 + CD8 + T 细胞在总 CD3 + T 细胞群中占主导地位,而在未经治疗的小鼠中,PD-1+CD8+T 细胞仅占总 CD3 + T 细胞的一小部分(5.69% vs. 60.6%, P < 0.001)(图3g )。接下来,我们评估了这些细胞的抗原特异性。由于在富集 CD8 + 细胞后,肿瘤中的 CD8 + T 细胞数量远少于脾脏,我们将上述六种四聚体混合,构建了一种包含所有六个靶标的泛四聚体染色方法。利用这种方法,我们发现,与未接受 RNA-LNP 治疗的对照组相比,接受 RNA-LNP 和 ICI 治疗的小鼠的肿瘤浸润 CD8 + 淋巴细胞对四聚体的反应性是其两倍(3.10% vs. 7.98%, P = 0.0229)(图 3h 和补充图 7 )。
与肿瘤微环境(TME)中肿瘤反应性 T 淋巴细胞的增加相一致,我们发现刺突蛋白编码 RNA-LNP 显著提高了肿瘤细胞上 PD-L1 的表达(图 3i-k ,扩展数据图 9g、h 和补充图 9 和 10 )。阻断 IFNα信号通路可消除 PD-L1 的表达,证实了其在启动免疫治疗反应中的重要性(扩展数据图 9g、h )。综上所述,这些数据表明,刺突蛋白 RNA-LNP 可刺激活化的肿瘤反应性 CD8 + T 细胞的产生和浸润,从而克服免疫检查点抑制剂(ICIs)存在下 PD-1 和 PD-L1 的代偿性表达。
新冠疫苗塑造人类免疫力
由于人类和小鼠对 mRNA 的反应存在物种特异性差异,我们接下来试图确认在小鼠模型中发现的通路是否与人类相关。为此,我们采集了五名健康志愿者在接种 mRNA-1273 Spikevax Monovalent XBB.1.5(COVID-19 mRNA 疫苗,2023-2024 配方,50 μg mRNA)后的基线以及接种后 6 小时、24 小时、7 天和 14 天的血液和血浆样本(图 4a )。我们首先使用 NULISA-Seq 炎症因子检测板(Alamar Biosciences)评估了这些志愿者的血浆。该检测板是一种多重检测方法,旨在灵敏地检测超过 250 种免疫相关细胞因子。由于 IFNα被发现对小鼠的抗肿瘤活性至关重要,我们特别关注该蛋白在接种后 24 小时的动力学变化。值得注意的是,IFNα不仅表达上调,而且是所有时间点上调最显著的细胞因子,其浓度较基线平均升高约 280 倍,最终血浆浓度达到 1 至 10 pg ml⁻¹ (图 4b,c )。更广泛地说,IL-6 和 IFNγ是免疫后 6 小时唯一显著升高的细胞因子(图 4d )。相比之下,免疫后 24 小时,多种炎症细胞因子激增,包括 IFNα、IFNγ、IFNω和 IFNγ诱导蛋白-10(CXCL10)(图 4d 和补充图 11 )。尽管在任何时间点均未发现 IL-1 显著升高,但 IL-1 受体拮抗剂(IL1RN)在 24 小时显著升高,提示存在对 IL-1 激增的代偿反应(图 4d )。正如预期,健康个体接种 COVID-19 mRNA 疫苗后的细胞因子反应持续时间较短,所有细胞因子在 7 天内均恢复至基线水平(图 4d )。
a ,实验设计示意图,其中从五名健康受试者在基线以及接种 Spikevax (mRNA-1273) COVID-19 mRNA 疫苗后 6 小时、24 小时、7 天和 14 天采集血液样本。b 、 c ,分别展示了五名健康志愿者中 IFNα 表达从基线到 24 小时的变化。数据以倍数变化表示,使用 NULISAseq 炎症因子检测板进行测量 ( b )。浓度也使用 NULISAseq 绝对定量 (AQ) 单独测量 ( c ) 。d ,COVID-19 mRNA 疫苗接种后 6 小时、24 小时、7 天和 14 天,在 24 小时显著升高的细胞因子的动态表达情况。显著变量定义为 P < 0.05 且经固定效应线性模型分析后, log2 转换倍数变化绝对值大于 0.5 的变量。采用经错误发现率 (FDR) 校正的双尾 t 检验计算调整后的 P 值,以校正多重检验 。e 、 f 分别表示免疫后 6 小时、24 小时和 7 天时循环髓系细胞 (CD3 − CD19 − CD56 − CD11b + ) ( n = 5) ( e ) 和树突状细胞 (DC) (CD3 − CD19 − CD56 − CD11c + MHC-II + ) ( n = 5) ( f ) 上的 PD-L1 表达。g 、 h 分别表示免疫后 6 小时、24 小时、7 天和 14 天时自然杀伤细胞 (CD56 + ; n = 5) ( g ) 和 T 细胞(以 CD69 + 细胞占 CD8 + CD3 + 细胞的比例表示)( n = 5) ( h ) 的活化情况。数据为平均值±标准误差 ,P 值采用双尾配对 t 检验计算。
为了评估 COVID-19 mRNA 诱导的抗病毒细胞因子对免疫细胞的影响,我们接下来利用流式细胞术评估了循环髓系细胞的表型。与我们在小鼠模型中的发现一致,我们发现 mRNA 免疫可激活先天免疫,表现为循环 CD11b + 髓系细胞和 CD11c + 树突状细胞 (DC) 上 PD-L1 表达增加(图 4e、f ,补充表 16 和补充图 12 )。疫苗接种还与自然杀伤细胞的激活相关,表现为 CD56 high 细胞上 IL-2Rα(也称为 CD25)表达增加一倍(图 4g ),以及循环 T 细胞中 CD69 表达增加一倍(图 4h ,补充表 17 和补充图 13 )。 7 天后所有细胞的表型均已标准化,这可能是由于这些健康参与者缺乏靶标,或是活化的 T 细胞在淋巴网状结构中定位以极化为记忆细胞所致。
接下来,我们对 11 名接种了 Comirnaty 疫苗(BNT162b2,COVID-19 mRNA 疫苗,2024-2025 配方,含 30 μg mRNA)的健康志愿者重复了这项研究(扩展数据图 10a-h )。虽然我们发现细胞因子谱总体上的变化相似,但与 mRNA-1273 相比,BNT162b2(含 mRNA 较少)显著降低了 I 型干扰素和先天免疫激活(通过流式细胞术检测)(扩展数据图 10b-i )。
RNA 疫苗可增强非小细胞肺癌中的 PD-L1 表达
已知肿瘤内抗原特异性 T 细胞的浸润与肿瘤细胞 PD-L1 表达增加相关,并且在我们的临床前模型中与抗肿瘤反应相关,因此我们假设接种 COVID-19 mRNA 疫苗的患者肿瘤细胞 PD-L1 表达会更高。为了验证这一假设,我们构建了两个队列。首先,我们评估了 2315 例非小细胞肺癌(NSCLC)患者的病理报告,这些患者的活检均报告了肿瘤比例评分(TPS),并根据活检与最近一次接种 mRNA 疫苗的时间间隔将患者分为三组(图 5a )。我们发现,在活检前 100 天内接种过 COVID-19 mRNA 疫苗的患者,其 PD-L1 平均 TPS 值较活检前未接种过 COVID-19 mRNA 疫苗的患者升高了 24%(31% vs. 25%, P = 0.0450);而与活检前 100 天或更长时间接种过 mRNA 疫苗的患者相比,其平均 TPS 值升高了 41%(31% vs. 22%, P = 0.0099)(图 5b 和扩展数据图 10j )。由于 TPS 值 50%是判断非小细胞肺癌(NSCLC)患者是否适合接受单药免疫治疗而非化疗免疫治疗的重要临床阈值,因此我们接下来将这些数据作为二元结果围绕该阈值进行评估。值得注意的是,我们发现接种过 COVID-19 mRNA 疫苗的患者达到或超过 50% TPS 阈值的可能性比未接种疫苗的患者高 29%(36% 对 28%, P = 0.0295)(图 5c ),这表明 mRNA 疫苗对 TPS 的影响足以改变治疗决策。相比之下,活检前接种流感疫苗和肺炎疫苗与 TPS 的变化无关(图 5d )。
a ,记录 PD-L1 TPS 的非小细胞肺癌(NSCLC)患者活检示意图。b , 按 COVID-19 mRNA 疫苗接种时间分层的 TPS。c ,TPS≥50%的样本分布。d,按流感疫苗(左)或肺炎疫苗(右)接种时间分层的 TPS。e , 记录我院(2020 年 1 月至 2023 年 10 月)PD-L1 TPS 或联合阳性评分(CPS)的活检示意图 。f ,来自该多样化队列的原发肿瘤位置。g , 按 COVID-19 mRNA 免疫接种时间分层的组织学非特异性队列的 TPS。h , 按流感疫苗接种时间分层的 TPS。 P 值采用双尾非配对 t 检验( b 、 d 和 h )、经 Welch 校正以应对方差不齐的双尾非配对 t 检验( g )以及评估 TPS 大于 50% 可能性的双侧 Fisher 精确检验( c )计算得出。小提琴图显示了包含各个数据点的数据分布。i , 接受免疫检查点抑制剂 (ICI) 治疗的组织学无关队列中,在开始 ICI 治疗后 100 天内接种过 COVID-19 疫苗或未接种过 COVID-19 疫苗的患者的生存率 。j , i 组中,根据 ICI 治疗前是否接种过 COVID-19 疫苗进行分层的患者的生存率 。k , i 组中,在疫情期间(自 2020 年 9 月 2 日起,即 mRNA 疫苗获批前 100 天)开始接受 ICI 治疗的患者的生存率。在不考虑组织类型的队列中,生存分析并不局限于那些具有明确 TPS 值的患者。 l – o ,接受免疫检查点抑制剂(ICI)治疗的转移性 IV 期非小细胞肺癌(NSCLC)患者的总生存期(OS),这些患者在开始 ICI 治疗后 100 天内接种了 COVID-19 mRNA 疫苗,或未接种 COVID-19 疫苗,且基线活检时 PD-L1 表达水平(TPS <)为 1%( l )、1–49.9%( m )或≥50%( n )。为了评估疫苗接种在每种临床情况下的影响,如果患者在活检前接种了 COVID-19 mRNA 疫苗,则将其排除在外。o , 未接种疫苗的 IV 期 NSCLC 患者的 OS,按 ICI 开始治疗的时间段进行分层,这些患者在活检时基线 TPS < 为 1%。P 值和风险比 ( HR)采用对数秩检验(Mantel-Cox,双侧)计算( i – o )。
RNA 疫苗可广泛扩增肿瘤 PD-L1 表达
为了将我们的研究结果扩展到非小细胞肺癌(NSCLC)和黑色素瘤以外的领域,我们建立了一个独立的队列,纳入了我们四级转诊中心在四年期间(包括新冠疫情时期)所有病理报告中包含“PD-L1”一词的患者(图 5e )。我们共识别出 2020 年 1 月至 2023 年 10 月期间 5317 份包含“PD-L1”一词的独特病理报告,其中 2831 份报告了肿瘤进展评分(TPS),这些患者涵盖了多种原发部位和组织学类型(图 5f )。在该队列中,活检前 100 天内接种 COVID-19 mRNA 疫苗与 TPS 增加 37%相关(13.3% vs 9.7%, P = 0.0364)(图 5g 和扩展数据图 10k ),这与 NSCLC 患者中观察到的结果相似。与非小细胞肺癌队列类似,流感疫苗接种与 TPS 的类似升高无关(图 5h )。接下来,我们对这一广泛的患者队列重复了生存分析,该队列包括在我们机构接受免疫检查点抑制剂(ICI)治疗且在研究期间接受 PD-L1 活检的患者( n = 888)。在该队列中,在开始 ICI 治疗前 100 天内接种任何 COVID-19 疫苗的患者,其生存期较未接种疫苗的同龄患者显著延长( P = 0.0038,HR = 0.73,95% CI = 0.60–0.90)(图 5i )。当仅限于在 ICI 开始前 100 天内接种疫苗的患者( P = 0.0311,HR = 0.76,95% CI = 0.60–0.96)(图 5j )和在大流行时期开始 ICI 的患者( P = 0.0056,HR = 0.74,95% CI = 0.60–0.91)(图 5k )时,这种效应是一致的。
RNA 疫苗增强免疫检查点抑制剂对冷肿瘤的疗效
接下来,我们试图评估疫苗接种是否能够恢复免疫“冷”肿瘤患者的免疫敏感性。我们使用疫苗接种前的肿瘤比例评分(TPS)作为免疫敏感性的替代指标,因为与基线 TPS 为 3E1%的患者相比,TPS 为 3C1%的非小细胞肺癌(NSCLC)患者从免疫检查点抑制剂(ICI)治疗中获益较少。在基线 TPS 为 3C1%的 IV 期 NSCLC 患者中,在开始 ICI 治疗后 100 天内接种 COVID-19 mRNA 疫苗的患者的总生存期(OS)与基线 TPS 为 3E1%的患者相似,表明其对 ICI 的敏感性已恢复(图 5l )。此外,COVID-19 mRNA 疫苗接种与 OS 之间的关联在 TPS 为 3C1%的患者中与活检 TPS 为 1-49.9%或≥50%的患者中相似(图 5l-n )。疫情期间患者管理的变化并不能解释这种影响,因为活检时 TPS < 1% 的 IV 期 NSCLC 患者,在疫情前后未接种疫苗,其结果相似(图 5o )。
这些数据共同提示了一种模型:靶向非肿瘤相关抗原的 mRNA 疫苗能够刺激强烈的抗肿瘤免疫反应,从而使肿瘤对免疫检查点抑制剂(ICI)更加敏感(扩展数据图 11 )。mRNA 疫苗首先刺激抗病毒细胞因子(包括 IFNα)的激增,进而驱动全身性固有免疫激活。这种细胞因子激增激活的肿瘤驻留固有免疫细胞启动 T 细胞,T 细胞被激活后浸润肿瘤。尽管肿瘤细胞通过上调 PD-L1 表达来逃避免疫攻击,但与 ICI 联合使用可使 COVID-19 mRNA 疫苗克服这种代偿反应,从而诱导肿瘤消退并提高生存率。
讨论
免疫疗法有望提供具有长期免疫记忆的全身性抗癌治疗,从而预防癌症复发。然而,免疫检查点抑制剂(ICIs)疗法依赖于预先存在的抗癌免疫力,而大多数患者缺乏这种免疫力。近年来,mRNA 疫苗作为一种诱导抗癌免疫、增强 ICIs 疗效的有前景的策略而备受关注 24,25,26,27 。本研究利用靶向 COVID-19 刺突蛋白的 mRNA 疫苗,揭示了 mRNA 疫苗与 ICIs 联合治疗提高生存率的机制,即使该 mRNA 并不编码肿瘤抗原。刺突蛋白 RNA 脂质纳米颗粒(Spike RNA-LNPs)可激活全身抗原呈递细胞(APC),进而导致高度活化的肿瘤特异性 T 细胞扩增。当与 ICIs 联合使用时,这些 T 细胞可介导肿瘤消退。由于个性化新抗原疫苗需要相当长的生产时间,针对肿瘤相关抗原甚至传染病抗原的现成 RNA-LNP 可能代表着广泛可用、低成本的替代方案,适用于等待个性化新抗原疫苗的患者或在无法获得个性化新抗原疫苗的情况下。
尽管局部注射 RNA-LNP 用于传染病或个性化癌症疫苗的目的并非直接改变肿瘤免疫微环境,但我们在此证明,即使局部注射含有 N1- 甲基假尿苷以最大限度减少先天免疫激活的 RNA-LNP,也能产生足够的刺激来重编程肿瘤微环境(TME)并使肿瘤对免疫检查点抑制剂(ICI)敏感。此外,我们发现,用未修饰的 mRNA 替换 N1- 甲基假尿苷修饰的 mRNA 来增强先天免疫激活,可能进一步提高该方法的抗肿瘤效果。这种方法的惊人有效性或许可以解释 mRNA 疫苗与其他同样能产生针对靶向新表位的 T 细胞的方法相比所取得的相对成功 10,11,12,13,28,29 。
我们发现,COVID-19 mRNA 疫苗可增加肿瘤细胞上 PD-L1 的表达,使免疫冷肿瘤对免疫检查点抑制剂(ICIs)敏感。这些结果表明,常规免疫接种的时机可能影响治疗方案,并提供了一种克服固有 ICI 耐药性的非处方方法。更广泛地说,这些结果确立了系统性先天免疫调节作为提高肿瘤对 ICIs 敏感性的策略,并将靶向传染病抗原的现成 RNA 疗法定位为抗肿瘤免疫的通用调节剂。
这些发现揭示了广泛应用的疫苗在增强癌症免疫疗法疗效方面所发挥的作用。尽管我们由于某种疗法的广泛应用而将其作为研究重点,但这些数据可能为其他通用型 mRNA 疗法铺平道路,这些疗法旨在重置患者的免疫系统,从而增强其对免疫疗法的反应。
方法
回顾性研究
我们使用 MD 安德森癌症中心(MDACC)的电子健康记录系统完成了一项非干预性回顾性患者数据审查。该系统包含在 MDACC 主院区(位于德克萨斯州休斯顿的一家大型四级癌症专科医院)接受治疗的患者记录。本研究的病历审查涉及三组患者:(1)2017 年 1 月至 2022 年 9 月期间经肿瘤活检确诊为 III 期或 IV 期非小细胞肺癌(NSCLC)的患者;(2)2019 年 1 月至 2022 年 12 月期间接受单药或多药免疫检查点阻断治疗的任何分期黑色素瘤患者;(3)一个不区分组织类型的队列,包括 2020 年 1 月至 2023 年 10 月期间在我院接受 PD-L1 病理学检测的所有患者,涵盖多种组织学类型。本研究已获得 MD 安德森癌症中心伦理审查委员会的批准。由于数据的回顾性和去标识化性质,本研究免除了知情同意。数据收集截止日期为 2024 年 9 月 1 日;数据分析从 2024 年 9 月 1 日进行至 2025 年 7 月 29 日。
在 NSCLC 数据集中,收集了有关患者人口统计学信息(例如免疫治疗开始时的年龄、性别、种族)、原发肿瘤组织学、临床分期、已知的肿瘤突变(例如 EGFR、KRAS、HER2、ALK、MET、p53 和 RET 中的突变)、免疫治疗开始时的转移负荷(脑、肝)、免疫治疗开始时附近的东部肿瘤协作组 (ECOG) 体能状态 (PS;范围,0-5)、免疫治疗开始前后接受的放射治疗、化疗史、免疫缺陷、合并症(心脏病、肾病、肝病、呼吸系统疾病)、其他原发肿瘤史、免疫治疗开始前后使用类固醇的情况、最后一次随访日期、死亡日期、首次复发或进展日期、ICI 药物名称和开始日期、COVID-19、流感和肺炎球菌疫苗接种日期以及 TPS 的患者信息。纳入非小细胞肺癌生存分析的必要条件是记录 PD-L1 表达水平(如下所述)。对于接受多次活检的患者,采用距离免疫检查点抑制剂(ICI)治疗开始时间最近的一次活检所记录的 PD-L1 表达水平进行分析。
在黑色素瘤数据集中,收集了有关患者人口统计学信息(包括免疫治疗开始时的年龄、性别、种族)、原发肿瘤组织学、临床分期、已知的肿瘤突变(例如 EGFR、KRAS、HER2、ALK、MET、p53 和 RET 中的突变)、免疫治疗开始时的转移负荷(例如脑、肝)、免疫治疗开始时的 PS 评分(范围 0-5)、化疗史、免疫缺陷、合并症(例如心脏病、肾病、肝病、呼吸系统疾病)、其他原发肿瘤数据、COVID-19 疫苗接种和免疫治疗开始时类固醇的使用情况、最后一次随访日期、死亡日期、首次复发/进展日期、ICI 药物名称和开始日期以及 COVID-19 疫苗接种日期等患者信息。虽然我们的数据集没有包含每位患者接种的具体疫苗配方,但在研究期间接种的疫苗配方包括:Moderna 于 2020 年 12 月 18 日发布的原始单价 mRNA-1273 疫苗(100 µg mRNA 初免,50 µg mRNA 加强);Moderna 于 2022 年 9 月 1 日发布的针对原始毒株和 Omicron BA.4/BA.5 的二价疫苗(50 µg mRNA);辉瑞/BioNTech 于 2020 年 12 月 11 日发布的原始单价疫苗(30 µg mRNA 初免和加强);以及辉瑞/BioNTech 于 2022 年 8 月 31 日发布的二价制剂(30 µg mRNA)。
患者被分为两组:(1)在免疫检查点抑制剂(ICI)治疗开始后 100 天内接种了 COVID-19 mRNA 疫苗的患者;(2)未接种 COVID-19 疫苗的患者。基于这两组患者进行生存分析,并进行亚组分析,亚组分析涉及肿瘤分期、mRNA 疫苗品牌、COVID-19 疫苗接种剂量、转移部位和免疫治疗周期。
对于在非小细胞肺癌和黑色素瘤数据集均接受过 COVID-19 mRNA 疫苗接种的患者,总生存期 (OS) 的计算方法为:从最接近 mRNA 疫苗接种日期的免疫治疗开始日期到最后一次随访日期或死亡日期之间的时间。对于未接受 COVID-19 mRNA 疫苗接种的患者,OS 的计算方法为:从首次免疫检查点抑制剂 (ICI) 治疗开始日期到死亡日期或最后一次随访日期之间的时间。对于接受过 COVID-19 mRNA 疫苗接种的患者,无进展生存期 (PFS) 的计算方法为:从最接近 mRNA 疫苗接种日期的 ICI 治疗开始日期到首次出现病理学确诊的复发或影像学确诊的疾病进展(以较早者为准)之间的时间,且该疾病进展需由其主治肿瘤内科医生记录在案。对于未接受过 COVID-19 mRNA 疫苗接种的患者,PFS 的计算方法为:从首次 ICI 治疗开始日期到临床医生确诊的疾病进展日期之间的时间,如上所述。在接受 mRNA 疫苗接种前已出现疾病进展的患者被纳入本次分析的疫苗接种组。使用 GraphPad Prism 生成 Kaplan-Meier 曲线。
Cox 比例风险回归
对于 Cox 比例风险回归,时间依赖性变量的定义如图注所述。连续/数值变量(例如年龄、BMI、PD-L1 表达、ECOG 评分和治疗年份)保留为数值型。二元和分类变量(例如分期、性别、突变状态、合并症)转换为因子。对于每个变量,我们构建了单独的 Cox 比例风险模型。从模型汇总中提取 HR、95% CI(Wald)和 P 值。单变量分析中 P <0.05的变量被纳入多变量建模。多变量Cox比例风险回归模型也采用类似的方法构建,纳入单变量分析中具有显著性的变量。对于多变量Cox比例风险回归,缺失值的患者被排除在分析之外。
为保证完整性,报告了病例数少于 5 例的类别,但由于数据收敛且不足以进行可靠的推断,因此认为这些类别不具有统计学意义。与生存率显著相关的变量被纳入多变量分析(MVA),MVA 后显著的变量( P <0.05)被纳入倾向性评分匹配(PSM)。某些变量(例如,疫苗接种后1个月内使用类固醇)根据定义代表了治疗队列的亚组。这些亚组在描述性分析和单变量模型中进行了评估,但未作为协变量纳入MVA,因为它们不代表基线混杂因素,且在单变量分析中不显著。
我们通过评估 Schoenfeld 残差来评估多元模型中的比例风险假设,并且没有发现重大违背情况。
插补和倾向得分匹配
在非小细胞肺癌(NSCLC)数据集中,少数患者的 ECOG 评分缺失,而 ECOG 评分是 Cox 比例风险回归模型中重要的预后预测因子。在初始单变量分析中,BMI 存在缺失值,但由于倾向性评分匹配(PSM)不需要 BMI,因此未进行插补以解决缺失问题。采用多变量 logistic 回归和岭回归分析 ECOG 评分缺失与临床相关的治疗前协变量之间的关联。由于重要变量之间存在多重共线性,无法从模型中排除,因此选择岭回归。预测 ECOG 评分缺失的模型中未包含的变量包括:疫苗接种情况、疫苗接种或免疫检查点抑制剂(ICI)治疗期间的类固醇使用情况、PD-L1 表达、同期化疗、免疫治疗药物以及 BMI(如上所述)。后续的岭回归分析表明,本研究中 ECOG 评分的缺失很可能是随机发生的。
鉴于 III 期非小细胞肺癌(NSCLC)数据集治疗组的样本量较小,我们采用链式方程和 R 语言包 MICE 进行多重插补,以估计缺失的 ECOG 值。其中,我们使用预测均值匹配(PMM)(使用 set.seed(2025))创建了五个插补数据集。用于插补的变量选择基于较大的绝对岭回归系数(| β | ≤ 0.3)和临床相关性,以确保准确预测 ECOG 缺失值。在通过回归系数进行选择后,由于年龄和既往全身治疗周期数具有重要的临床意义,我们将其纳入插补变量。为了在保持 III 期 NSCLC 患者统计效力的同时进行倾向性评分匹配(PSM),我们使用五个插补 ECOG 值的众数作为每个患者的单一值( n = 5)。这种方法对于最大限度地减少方差膨胀和避免在极小的样本中稀释治疗效果是必要的。由于 PMM 是随机的,变量定义、因子水平和行顺序的微小偏差都可能导致插补值略有不同。然而,在出现并列值时采用略微不同的模式选择、不同的随机种子以及增加数据集数量( n = 20 或 n = 10 而非 n = 5)进行的敏感性分析显示,后续匹配后结果相似( P < 0.05)。使用密度图评估了插补值的合理性,结果表明观察值和插补值之间存在适当的范围和重叠。
插补后,使用 R 语言的 MatchIt 包进行倾向性评分匹配 (PSM)。采用逻辑回归模型估计倾向性评分,预测“100 天内接种疫苗”或“不接种疫苗”的治疗分配,协变量基于多变量分析 (MVA) 中与生存相关的显著因素,包括原始或插补的 ECOG 评分。在所有倾向性评分分析中,均对先前估计的倾向性评分进行最近邻匹配,以确定平衡的队列。对于 III 期不可切除的非小细胞肺癌 (NSCLC) 的 PSM,采用卡尺值为 0.1 的最近邻 PSM,并将 III 期 UR NSCLC 中对照组患者与治疗组患者的比例设为 2:1,以改善协变量平衡并最大化统计功效。从 PSM 模型中移除 ECOG 评分的敏感性分析显示出相似的趋势。
在 IV 期非小细胞肺癌(NSCLC)中,由于剩余样本量充足,ECOG 评分缺失的患者被排除在外。倾向性评分匹配(PSM)再次采用最近邻匹配法,卡尺值为 0.1,对照组与治疗组的比例为 1:1。敏感性分析中,我们分别采用与 III 期 NSCLC 相同的方法(卡尺值同样为 0.1,但治疗组与对照组的比例为 1:1 而非 2:1),从 PSM 中移除 ECOG 评分而非进行插补,结果均显示出统计学意义上的显著性差异。
由于变量完整,黑色素瘤队列未进行插补。黑色素瘤倾向性评分匹配(PSM)分析采用最近邻匹配法,卡尺值为 0.1,对照组患者与治疗组患者的比例为 1:1。
在所有匹配队列中,匹配后倾向评分的绝对标准化均值差(|SMD|)始终小于 0.05,表明各组之间平衡性极佳。使用抖动图和倾向评分直方图对平衡性诊断结果进行了可视化验证。
生存分析
采用 Kaplan-Meier 法估计匹配组的生存分布。进行对数秩检验以评估治疗组之间的差异。使用 GraphPad Prism 可视化 Kaplan-Meier 曲线、95% 置信区间以及 0、10、20、30 和 40 个月时的风险人数,包括从 R 中提取倾向评分匹配数据后的结果。主要数据集(图 1 )中组间的比较结果以 Cox 比例风险回归计算的调整后风险比 (HR) 表示。亚组分析中组间的比较结果以对数秩检验计算的未调整 HR 表示,以保持结果的稳健性。主要生存分析的 P 值已报告。
在 Kaplan-Meier 曲线交叉的情况下,使用曲线下面积分析 12 个月和 24 个月时各组之间的绝对差异来计算限制平均生存时间。
所有统计分析均在 R v.4.4.2 (2024-10-31) 和 GraphPad Prism 中进行。
活检样本中 PD-L1 表达的定量分析
对于组织学非特异性队列和非小细胞肺癌(NSCLC)数据集中的患者,我们收集了在 MD 安德森癌症中心接受过 PD-L1 病理评估活检的患者的活检日期、病理报告、组织学信息和诊断代码(组织学非特异性队列为 2020 年 1 月至 2023 年 10 月,NSCLC 队列为 2016 年 8 月至 2022 年 8 月)。肿瘤细胞上的 PD-L1 表达(TPS)以及肿瘤细胞和免疫细胞上的 PD-L1 总表达(CPS)均来自病理报告。数据整理遵循以下原则:(1)简单的定量值被精确复制;(2)TPS 值“<1%”被报告为 0%。 (3) 对于 CPS 为 0% 或 CPS 为 3%C1% 且无 TPS 值的患者,TPS 值报告为 0%,因为 CPS 为 0% 或 3%C1% 表示肿瘤细胞和髓系细胞均不表达 PD-L1;(4) 由于无法解释,报告为“3%C x %”或“3%E x %”的 TPS 值介于 1.1 和 49.9 之间的数据被排除;(5) TPS 值为 3%E50% 记录为 50%,TPS 值为 3%E60% 记录为 60%,依此类推,因为这些值表示 PD-L1 高表达。对于 PD-L1 表达范围(例如 0-5%),取该范围内数值的中位数作为肿瘤上 PD-L1 表达的近似估计值。排除重复患者活检(在先前活检后 2 个月内对同一患者进行的重复活检),只纳入最早的活检。
此外,我们还分析了在肿瘤类型无关数据集中,接受免疫检查点抑制剂(ICI)治疗后 100 天内接种过任何 COVID-19 mRNA 疫苗的患者与未接种过 COVID-19 疫苗的患者相比的生存情况。生存分析方法与非小细胞肺癌(NSCLC)数据集中的方法相同,适用于该队列中所有接受 ICI 治疗的患者。纳入研究无需 TPS 值。
为了进行分组分析,这些队列中的患者被分为三组:(1)在组织活检前 100 天内接种最近一次 COVID-19 mRNA 疫苗的患者;(2)在组织活检前 100 天或以上接种最近一次 COVID-19 mRNA 疫苗的患者;以及(3)在活检前未接种 COVID-19 mRNA 疫苗的患者。在活检前 100 天内接种过非 mRNA COVID-19 疫苗的患者被纳入未接种疫苗组。
健康人类参与者
所有健康志愿者研究均已获得 MD 安德森癌症中心伦理审查委员会的批准。在采集血浆和外周血单核细胞之前,所有健康受试者均签署了知情同意书。采集时间点为基线、接种 COVID-19 mRNA 疫苗后 6 小时、24 小时和 48 小时,或基线、接种后 6 小时、24 小时、7 天和 14 天,具体时间点取决于所用疫苗配方。第一时间点使用 BNT162b2(COVID-19 mRNA 疫苗,2024-2025 配方,含 30 μg mRNA),第二时间点使用 mRNA-1273(Spikevax Monovalent XBB.1.5,COVID-19 mRNA 疫苗,2023-2024 配方,含 50 μg mRNA)。冷冻血浆解冻后,使用 Alamar Biosciences 公司的 NULISAseq Inflammation Panel 250 进行分析。使用 NULISAseq 炎症检测试剂盒 AQ 对 IFNα 浓度进行绝对定量。统计分析使用 R 语言进行,我们采用基于疫苗接种时间并控制患者 ID(配对)的固定效应线性模型评估显著性,并使用 limma 包的 duplicateCorrelation 函数处理基线间的生物学差异。P 值采用修正 t 检验计算,并使用 FDR 校正进行多重检验。为了比较辉瑞疫苗和 Moderna 疫苗,我们使用线性模型方法(limma)评估每位患者从基线到接种后 6 小时和 24 小时的细胞因子浓度对数转换倍数变化。应用经验贝叶斯收缩修正 t 检验,并使用 Benjamini-Hochberg FDR 方法校正 P 值。构建对比以直接比较每个时间点的 Moderna 疫苗和辉瑞疫苗。 如果细胞因子在 Moderna 和 Pfizer 组之间从基线到 6 小时或 24 小时表现出显著差异( log2 转换后的倍数变化绝对值大于 0.5 且 FDR 校正后的 P 值 < 0.05),则对其进行可视化。每种条件下的平均表达值均以基线值为基准进行标准化并进行可视化。火山图使用 R 语言生成。 血浆中相对表达发生显著变化的细胞因子的热图和图表24 小时后,使用 GraphPad Prism 生成结果。
人流式细胞术
将外周血单核细胞在 37℃水浴中解冻,立即以 1:9 的细胞:培养基比例转移至含有 9 ml 完全 RPMI 培养基(RPMI + 10% FBS)的 50 ml 离心管中。细胞以 400 g 离心 10 分钟,弃去上清液。将细胞沉淀重悬于 1 ml PBS 中,并加入活/死细胞标记物(每 1000 µl 细胞悬液加入 1 µl,细胞浓度为 100 万至 1000 万个/ml),于 4℃孵育 30 分钟。孵育后,加入 3 ml PBS + 2% FBS,再次以 400 g 离心 8 分钟,弃去上清液。将细胞悬液与 5 µl Human TruStain FcX(BioLegend,422302)/100 µl 细胞悬液在室温下预孵育 5 分钟。然后用 PBS 洗涤细胞,并在 400 g 下离心 6 分钟。弃去上清液后,向每个离心管中加入 10 µl Brilliant 缓冲液,混合后静置 5 分钟。之后加入靶向细胞外标记物的抗体,并在室温下避光孵育 20 分钟。孵育后,洗涤细胞,并用 500 µl 固定液(BD)在 4 °C 下避光固定 45 分钟。然后用 2 ml 透化缓冲液透化细胞。将细胞内染料溶于透化缓冲液中,并在室温下孵育约 40 分钟。孵育后,用透化缓冲液洗涤细胞,并重悬于 200 µl PBS + 2% FBS 中。然后使用 Cytek Aurora 光谱流式细胞仪进行分析。
临床前实验
所有小鼠实验和操作均已获得佛罗里达大学或德克萨斯大学 MD 安德森癌症中心机构动物护理和使用委员会(IACUC)的批准。小鼠(4-10 周龄)饲养于温度为 21 ± 1 °C、湿度为 35%的环境中,光照周期为 14 小时光照/10 小时黑暗。小鼠在治疗前进行随机分组。肿瘤测量在不知晓分组的情况下进行。根据已批准的方案,采用吸入二氧化碳后进行颈椎脱臼的方式实施安乐死。人道终点包括肿瘤溃疡。
C57BL/6 小鼠和 Rigi 基因敲除小鼠 ( C57BL/6NJ-Rigiem1(IMPC)J/Mmjax ) 购自杰克逊实验室 (046070-JAX),并在本实验室自行繁殖。将荷瘤小鼠右侧腹部皮下植入 50,000 个 B16F0 黑色素瘤细胞、100 万个 B16F10-OVA 黑色素瘤细胞或 200,000 个 LLC 细胞。通过将 100,000 个 LLC 细胞直接注射到 C57BL/6 小鼠左肺第 9 肋骨下方,建立原位 LLC 模型。B16F0 实验使用雌雄混合小鼠,LLC 实验使用雄性小鼠。所有小鼠均肌内注射 25 μg/剂的 RNA-LNP 或 RNA-LPA(mRNA 组分) 12 。我们腹腔注射抗小鼠 IFNα 受体(aIFNAR1,Bio X Cell,BE0241)和抗小鼠 IL-1R(Bio X Cell,BE0256)抗体,首次给药剂量为每只小鼠 500 μg,之后每周两次,每次 250 μg,直至治疗结束。抗 PD-L1(Bio X Cell,BE0101)检查点抑制剂的首次给药剂量为每只小鼠 400 μg,之后每周两次,每次 200 μg,直至治疗结束。抗 PD-1(Bio X Cell,BE0146)检查点抑制剂的首次给药剂量为每只小鼠 400 μg,之后每周两次,每次 200 μg,直至治疗结束。将低分子量聚肌苷酸胞苷酸(LMW poly(I:C),InvivoGen,tlrl-picw)以每只小鼠 25 μg 的剂量进行肌肉注射,共注射两次。从第 8 天开始,每周测量三次肿瘤,直至超过 20%的小鼠达到终点。达到人道终点后,对小鼠实施安乐死。
mRNA
将带有 K986P 和 V987P 突变的 SARS-CoV-2 刺突蛋白编码序列插入到 pGEM-4Z 骨架中,位于 T7 启动子下游,该启动子具有先前发表的非翻译区(UTR)和与 BNT162b2 mRNA 类似的 poly(A)信号 30,31 。从序列中去除 5′ SpeI 限制性内切酶位点,以便对 poly(A)尾进行酶切。根据 NEB 公司推荐的方案,通过定点诱变(NEB,E0554)将 T7 启动子替换为 AGG 起始序列。质粒在 NEB5a 感受态大肠杆菌中培养,并使用 RNeasy Maxi 试剂盒(Qiagen,75162)纯化,然后由 Genewiz 公司进行全质粒测序。质粒用 2 U μg⁻¹ SpeI HF 酶(NEB,R3133L)在 37 °C 下酶切 2 小时,随后进行 DNA 沉淀。mRNA 使用 mMESSAGE mMACHINE T7 mRNA 试剂盒和 CleanCap Reagent AG 试剂(Thermo Fisher Scientific,A57620)合成。Spike mRNA 使用 CleanCap reagent AG (3′ OMe) 试剂(Trilink,N-7413-5)和 N⁵ -methylpseudouridine-5′- 三磷酸(Trilink,N-1081-10)合成。PP65 mRNA 使用 ARCA 加帽(NEB,S1411L)加帽,随后用 mRNA 加帽 2′- O- 甲基转移酶(NEB,M0366L)处理。体外转录反应在 20 °C 下进行 10 小时。根据试剂盒说明书去除 DNA,并使用 RNeasy Maxi 试剂盒(Qiagen,75162)纯化 RNA。将 RNA 洗脱于纯化的无 RNase 水中,并储存于−80°C 直至使用。使用 Agilent TapeStation 4150 检测 mRNA 的质量。解冻后,将 RNA 用无 RNase 水稀释至 100 µg ml⁻¹, 然后在室温或 72°C 下孵育 3 分钟。 然后,将 100 ng RNA 或 1 µl DNA 分子量标准加入 5 µl RNA ScreenTape 样品缓冲液(Agilent,5067-5577)中,并在 2000 rpm 下混匀 1 分钟。使用 RNA ScreenTape(Agilent,5067-5576)进行样品分析。双链 RNA 的去除方法参照文献 20。 简而言之,将 mRNA 沉淀后重悬于色谱缓冲液中。将悬浮于色谱缓冲液中的纤维素纤维(Sigma-Aldrich,C6288-100G)加入 Nucleospin 过滤装置(Macherey-Nagel,740606)中,然后进行洗涤。每个过滤装置加入最多 500 μg RNA 至纤维素中,并快速混匀孵育 30 分钟。通过离心回收 RNA,并使用含有纤维素纤维的第二个柱重复孵育步骤。然后,将 RNA 通过 0.45 µm 针筒过滤器(Pall,4604)过滤,以去除任何纤维素颗粒,然后在无 RNase 的水中沉淀和重构 20 。
脂质纳米颗粒的制备
在形成复合物之前,向 RNA 中加入 0.5 M 无 RNase 柠檬酸缓冲液(pH 3.75)(Teknova,定制订单),使其最终浓度为 0.1 M。ALC-0159(Avanti,880155 P)、ALC-0315(Avanti,890900 O)、胆固醇(Sigma-Aldrich,C8667)和 DSPC(Avanti,850365P)按 1.7:47.5:40.8:10 的比例用 100% 乙醇重悬。在 Nanonsemblr Ignite(Precision NanoSystems,现为 Cytiva 旗下公司)上,将脂质和 RNA 以 3:1 的比例混合,使 N/P 比为 6。使用 3.5 kDa 透析盒(Thermo Fisher Scientific,A52967),在 4℃下透析过夜,并在 3 小时和 6 小时时间点进行两次缓冲液交换。透析后,将 LNP 通过 0.2 µM Supor EX ECV 滤膜(Pall,KS2ECV2S)过滤。使用 30 kDa Amicon 超滤膜(Millipore,UFC903024)在 2000 g 下离心浓缩 LNP。最终的 LNP 制剂中添加了溶于 PBS 的蔗糖,使其最终浓度为 12%。阴离子 RNA-LPA 的制备方法如前所述 12 。简而言之,将 2.5 mg ml −1 的 DOTAP 脂质体与 mRNA 以 1:1 的质量比混合,并在室温下复合 15 分钟后进行给药。
使用 RiboGreen 试剂盒(Invitrogen,R11490)和 BioTek Cytation 3 酶标仪测定 LNP 中的 RNA 浓度。通过比较 TE 缓冲液中 LNP 与 1% Triton X-100 溶液中 LNP 的读数来确定包封率。注射前,将 LNP 用 PBS 稀释至 500 μg ml⁻¹ 。使用与 RNA-LNP 剂量一致的空 LNP,RNA-LNP 的制备步骤和脂质用量均相同。荧光值绘制在标准曲线上,外推因子设置为 1.1。将 Triton X-100 溶液(总 mRNA)和 TE 缓冲液(游离 mRNA)孔中的数值代入以下公式:EE% = [1 – (游离 RNA/总 RNA)] × 100%。将总 mRNA RNA-LNP 上样至用 1×TAE 缓冲液(Quality Biological,351-008-131)制备的 1%琼脂糖凝胶中,并加入 GelRed(Biotium,41003-T)。然后将 500 ng RNA 上样至 LNP 中,并将游离 RNA 与 6×无 SDS 上样缓冲液(NEB,B7025S)混合,在 90 V 电压下电泳 45 分钟。使用 Malvern Zetasizer Ultra 和 NanoSight NS300 测定粒径。在进行粒径、PDI、浓度和表面ζ电位分析之前,将 LNP 用 HyClone HyPure 超纯水(Cytiva,SH30538.02)稀释 100 倍。所有样品均在 25 °C 下用 Zetasizer 进行三次重复电泳。使用马尔文公司的 NanoSight NS300 纳米颗粒跟踪分析仪(NTA)进行正交粒径分布和浓度测量。将每个 LNP 样品用 PBS 缓冲液稀释 500 倍,并以恒定速度泵入仪器,在优化的相机设置下进行五次采集。设置优化的检测阈值用于分析。将 750 μg ml⁻¹ 的 LNP 样品用 5 倍体积的乙醇或 2 倍体积的异丙醇溶解,然后用冷的 70% 乙醇洗涤两次,以此提取 mRNA。将 RNA 沉淀物溶解于无 RNase 的水中,然后使用 TapeStation 进行分析。
血浆采集
使用肝素化毛细管(Thermo Fisher Scientific,22-362566)经眼眶后静脉丛采血,最多采集 200 µl 血液至 EDTA 抗凝管(Thermo Fisher Scientific,NC9414041)中。全血以 1200 g 离心 15 分钟。收集血浆并储存于−80 °C 直至使用。
肿瘤样本的流式细胞术分析处理
从安乐死的实验小鼠中解剖出肿瘤,保留其外部纤维囊。用手术刀将肿瘤切成两半,将每份样本的一半放入含有 10 mg/ ml 胶原酶(Sigma-Aldrich,C5138-1G)、1 mg/ ml 透明质酸酶(StemCell Technologies,07461)和 200 mg/ ml DNase(Sigma-Aldrich,D5025-150KU)的酶混合物中,或使用肿瘤解离试剂盒(Miltenyi,130-096-730),随后去除碎片(Miltenyi,130-109-398)。样本在 m_TDK_1 循环下进行反应,反应完成后以 300 g 离心 5 分钟。将沉淀物重悬于冰冷的 PBS 缓冲液中,并通过 70 µm 细胞筛过滤。用冰冷的 PBS 缓冲液洗涤样品两次,然后用血细胞计数器进行人工计数。
脾细胞的分离
从安乐死的小鼠中取出完整的脾脏,置于冰冷的 RPMI 培养基中。然后将脾脏组织通过 70 µm 滤网过滤,并在 37 °C 下用 1× BD Pharmalyse 裂解缓冲液(BD,555899)裂解 5 分钟。用培养基终止裂解,并在 500 g 下离心 5 分钟。将脾细胞重悬于冰冷的 PBS 中,并通过 70 µm 细胞筛过滤,用 PBS 洗涤一次,然后使用 Beckman Coulter Vi-cell XR 或血细胞计数板进行计数。
小鼠流式细胞术分析
将 1 × 10⁶个来自肿瘤或脾脏的细胞接种于 96 孔 V 型底板中。除非另有说明,洗涤步骤均在 4℃下以 500 g 离心 5 分钟进行,然后用 200 µl 缓冲液重悬细胞,并用移液器混匀。用冰冷的 PBS 洗涤细胞,并用 100 µl 活/死细胞染色剂(Thermo Fisher Scientific,L10119)在 4℃下染色 30 分钟。用 100 µl 冰冷的 PBS 淬灭活/死细胞染色剂,并用冰冷的 FACS 缓冲液(含 2% FBS 的 PBS)洗涤细胞一次。离心细胞,并用 10 µl True Stain FCX 缓冲液(BioLegend,422302)重悬,该缓冲液用 FACS 缓冲液稀释至 100 µg/ ml ,孵育 10 分钟。然后加入 90 µl 抗体(补充表 12 和 13 )和 Brilliant Stain 缓冲液(BD,563794),于 4℃孵育 30 分钟。接下来,向每个孔中加入 100 µl FACS 缓冲液,并用冷的 FACS 缓冲液洗涤细胞两次。用 100 µl Cytofix 缓冲液(BD,554655)于 4℃固定细胞 15 分钟。之后,向每个样品中加入 100 µl PBS,洗涤细胞两次,并将细胞保存在 FACS 缓冲液中,于 4℃避光保存直至分析。使用 Ultracomp eBeads(Thermo Fisher Scientific,01-2222-42)和 ArC 胺反应补偿微珠(Thermo Fisher Scientific,A10346)进行初始补偿。使用 BD Symphony A3 获取结果,并使用 FlowJo v.10.8.1 和 v.10.10.0 进行分析。
四聚体生产
从金斯瑞生物技术有限公司(GenScript)购买了与 Survivin (ATFKNWPFL)、GP100A (EGSRNQDWL)、GP100B (KVPRNQDWL)、WT1 (RMFPNAPYL)、CLDN6 或 claudin 6 (KVYDSLLAL) 以及 TRP2 (SVYDFFVWL) 具有高亲和力结合的肽段。H2-Db 和 H2-Kb 单体购自 ImmunAware 公司(货号分别为 5001-01 和 5004-01),并以 easYmer 的形式提供。四聚体的制备按照制造商的说明进行。简而言之,将肽段用去离子水溶解至 1 mg/ml,进一步稀释至 75 μM,并与 easYmer(Eagle Biosciences,货号分别为 5004-01 和 5001-01)在 18 °C 下孵育 48 小时。将所得复合物与链霉亲和素-APC(BD Biosciences,554067)逐渐混合,形成四聚体。孵育后,每种四聚体的最终储备浓度达到 500 nM。
四聚体染色
根据制造商的建议,将 1–2 × 10⁶ 个细胞用稀释至 20 nM 的四聚体在 FACS 缓冲液中进行染色。细胞在室温下避光染色 1 小时,用 FACS 缓冲液洗涤一次,在室温下与表面抗体(CD3、CD4)共染色 20 分钟,用 FACS 缓冲液洗涤两次,并在 Cytek Aurora 流式细胞仪上进行分析。
AIM 检测
AIM 检测按先前描述的方法进行 12 。本次实验采用全脾细胞而非分离的 T 细胞。简而言之,在最后一次 RNA-LNP 疫苗接种 24 小时后,收集脾细胞用于抗原回忆检测。脾脏的收集和处理方法如上所述。将 100 万个脾细胞培养于 96 孔圆底板中,培养基为 T 细胞培养基,其中包含 RPMI 1640(Gibco,11-875-119)、10%胎牛血清(FBS,Thermo Fisher Scientific,35-011-CV)、1%青霉素-链霉素(Gibco,30-002-CI)、1% MEM 非必需氨基酸(NEAA,Gibco,11140050)、1%丙酮酸钠(Gibco,11360070)、0.1% β-巯基乙醇(BME,Gibco,21985-023)和 0.2 µg 肿瘤相关肽(不含细胞因子)。这些肽的选择基于其在黑色素瘤肿瘤中可能上调的报道 12 。所选肽段购自 JPT Peptide Technologies 公司,并按照制造商的说明进行复溶。共培养在 37℃、5% CO₂ 的培养箱中维持 48 小时。随后收集细胞,并进行 AIM 染色以评估抗原特异性 T 细胞的活化。将细胞离心后重悬于含有抗体混合物的 FACS 缓冲液中(补充表 14 )。细胞洗涤三次后,使用固定液(Thermo Fisher Scientific,GAS001S100)在室温下固定 15 分钟。细胞用 PBS 洗涤一次,并保存在 FACS 缓冲液中,于 4℃避光保存直至分析。使用 BD Fortessa III 流式细胞仪采集结果。通过从每种处理条件下减去仅含 DMSO 的对照组中 AIM 阳性细胞的百分比,对数值进行标准化。采用 Brown-Forsythe 和 Welch 方差分析进行统计分析。然后进行 Dunnett’s T3 多重比较检验。
ELISA 和多重分析
采用酶联免疫吸附试验 (ELISA) 和多重细胞因子芯片分析血浆中的细胞因子浓度。部分血浆样本通过 ELISA(Invitrogen,BMS6027)检测 IFNα。另取部分血浆样本送至 Eve Technologies 公司进行多重细胞因子芯片分析(MD44)。为定量检测刺突蛋白 IgG,在肿瘤研究中,对接受过三次疫苗/载体注射的小鼠,在达到人道终点后采集其血液样本。采用抗小鼠 SARS-CoV-2 IgG 滴度检测(AcroBiosystems,RAS-T023)测定刺突蛋白特异性 IgG。将血浆稀释 100,000 倍,并按照该公司推荐的半定量分析参数进行操作。
免疫荧光
将一半的肿瘤组织用 4%多聚甲醛于 4℃固定过夜。样本用 PBS 缓冲液洗涤三次,然后依次浸入 10%、20%和 30%的蔗糖溶液中进行冷冻保存。之后,将组织包埋于 OCT 包埋剂(Tissue-Tek,4583)中,并储存于-80℃。将组织块转移至-20℃保存 24 小时,然后使用 Leica 冷冻切片机切成 30 µm 厚的切片,并将切片置于载玻片上。染色前,将载玻片在室温下放置 15 分钟,并用 PBS 缓冲液洗涤三次。组织在室温下用含 2%山羊或驴血清、1%牛血清白蛋白(BSA)和 0.1% Triton X-100 的 PBS 封闭液封闭 1 小时。将切片置于封闭缓冲液中,加入一抗(补充表 15 ),4℃孵育过夜。孵育后,用 PBS 洗涤切片三次,再用封闭缓冲液稀释的二抗(补充表 15 )室温孵育 1 小时。PBS 洗涤三次(每次 5 分钟)后,将切片与 DAPI(PBS 稀释 1:1000)室温孵育 10 分钟。PBS 洗涤三次后,用 Prolong Glass 抗褪色封片剂(Thermo Fisher Scientific,P36984)封片,并盖上盖玻片。使用 Leica Stellaris 8 WLL 光谱共聚焦显微镜采集图像。图像处理使用 Fiji ImageJ 软件(NIH)和 Imaris 软件(Oxford Instruments)。
报告摘要
有关研究设计的更多信息,请参阅本文链接的《 自然投资组合报告摘要》 。
更改历史记录
2025 年 11 月 5 日
在最初发表的文章版本中,“BRS 是 CPRIT 癌症研究学者,RR250092”这句话在致谢部分缺失,现在已添加到文章的 HTML 和 PDF 版本中。
Hits: 28