Contents
Dengue: the green book, chapter 15a
第15a章:登革热
疾病
登革热是一种由登革热病毒引起的急性发热性疾病,通过受感染的伊蚊叮咬传播。大多数病例是轻微的或无症状的,但可能会出现严重的、危及生命的疾病。它在非洲、美洲、东地中海、东南亚和西太平洋地区的 100 多个国家/地区流行,在一些欧洲国家也有散发病例。在过去的几十年里,登革热病例的数量显著增加,并报告了大规模疫情。
登革热病毒 (DENV) 是黄病毒科的成员,有四种血清型:DEN-1、2、3 和 4。它分布在热带和亚热带气候中,主要分布在城市和半城市地区。它主要由埃及伊蚊和白纹伊蚊传播,它们在白天活跃,并在含水的人造物体中繁殖。
有罕见的病例通过输血、器官移植和针刺伤传播。感染一种血清型可提供针对该特定血清型的长期免疫力,但只能对其他血清型提供短期保护。
平均潜伏期为 4-7 天(范围 3-14 天)。高达 80% 的登革热感染是无症状的。常见症状包括突然发高烧、头痛和眼后疼痛、肌痛、关节痛、恶心/呕吐和皮疹。大多数疾病是轻微的,但只有不到 5% 的疾病可能是严重的,其中一小部分是致命的。
重度登革热是由于血管通透性增加,可导致危及生命的低血容量性休克。它在儿童、青少年和孕妇中更常见。在老年人和患有哮喘、糖尿病、肥胖、高血压、肾病、出血性疾病以及服用抗凝剂的人中,风险也有所增加。在第二次感染登革热期间,感染不同血清型登革热病毒的人患重症登革热的风险更大。然而,它也可能发生在第一次、第三次或第四次感染期间。严重的登革热在旅行者中很少见(Wilder-Smith,2013 年)。
登革热没有特定的治疗方法。应避免使用非甾体抗炎药,例如阿司匹林和布洛芬,因为它们会增加出血的风险。重度登革热需要及时识别并经常住院治疗,在这种情况下,通过明智的液体复苏进行治疗。
预防措施包括防止蚊虫叮咬、免疫接种和病媒控制计划。在英国没有通过输入病例传播的风险,因为蚊媒在英国没有发生。
疾病的病史和流行病学
登革热病毒于 1943 年由 Hotta 和 Kimura 首次分离出来 (Hotta, 1952),但由于疾病的性质,它在人类中的首次出现尚不确定——通常无症状,并且表现与其他病毒性发热性疾病相似。然而,人们普遍认为,到 18 世纪末,一种可能与登革热一致的疾病在亚洲和美洲引起了发作性流行,而到 19 世纪末和 20 世纪初,该病毒可能在热带和亚热带气候中广泛传播(Holmes 和 Twiddy,2003 年)。
世界上一半的人口现在面临感染登革热的风险,估计每年有 1-4 亿人感染,亚洲约占全球疾病负担的 70%(WHO,2023 年)。许多温带地区面临登革热流行的风险越来越大,因为全球气温升高有助于伊蚊更广泛的地理分布。登革热正在蔓延到包括欧洲在内的新地区,尽管欧洲不是地方性的,但自 2010 年以来,克罗地亚、法国、意大利和西班牙都报告了本地传播(ECDC,2024 年)。当病毒血症旅行相关病例从流行地区返回具有适当环境条件和感染媒介的地区时,就会报告病例。2012 年在葡萄牙马德拉岛报告了一次重大疫情。2023 年,法国报告了 43 例本地感染病例,意大利报告了 82 例本地感染病例。
登革热疫苗接种
Qdenga® 是一种四价减毒活疫苗。它通过重组 DNA 技术在 Vero 细胞中产生,包含四种登革热血清型的血清型特异性表面蛋白基因,被改造成 2 型登革热骨架。
注意:另一种登革热疫苗 Dengvaxia 在一些国家/地区可用。它在英国不可用。没有可用的可互换性数据,旅行者不应在海外用 Dengvaxia 完成的 Qdenga® 疫苗疗程,反之亦然。
存储
疫苗应存放在 +2℃ 至 +8℃ 的原包装中,并避光保存。所有疫苗在一定程度上对热和冷敏感。高温会加速大多数疫苗效力的下降,从而缩短其保质期。除非疫苗在正确的温度下储存,否则无法保证疫苗的有效性。冷冻可能会导致某些疫苗的反应原性增加和效力丧失。它还会导致容器出现细微裂纹,从而导致内容物污染。
剂型
Qdenga® 可作为粉末与注射液溶剂复溶。
在复溶之前,疫苗是白色至灰白色的冻干粉末(紧凑的蛋糕)。溶剂为透明、无色溶液。
剂量和时间表
Qdenga® 应以 0.5 mL 剂量以两剂(0 和 3 个月)的时间表接种。
加强剂量的必要性尚未确定。
接种
用溶剂完全复溶冻干疫苗后,Qdenga® 应通过皮下注射接种,最好在三角肌区域的上臂注射。不得通过血管内、皮内或肌肉注射 Qdenga®。
现有证据支持 Qdenga® 与黄热病和甲型肝炎疫苗共同接种(WHO SAGE,2023 年;Tricou等人,2023 年)。Qdenga® 可以与灭活疫苗、亚单位疫苗或 mRNA 疫苗共同接种。疫苗应在不同的部位接种,最好在不同的肢体中接种。如果在同一肢体中接种,则应至少相距 2.5 厘米(美国儿科学会,2003 年)。应在患者记录中注明每种疫苗的接种部位。目前没有关于与其他活疫苗(如 MMR)共同接种的数据。
处理
用于疫苗接种的设备,包括用过的小瓶、安瓿或部分排出的疫苗,应在疗程结束时根据地方当局的规定和指南在健康技术备忘录 07-01:医疗废物的安全管理(英格兰 NHS,2023 年)中密封在适当的、防刺穿的“锐器”盒中进行处理。
疫苗使用建议
英国免疫接种计划的目标主要是为那些有登革热风险且过去已经感染过登革热的人提供保护,使其免受继发性(可能更严重)感染。第二次感染的人患重症登革热的风险更大(WHO,2023 年)。
在试验环境中,对既往有登革热感染证据的个体(接种疫苗前获得的血液样本检测登革热中和抗体)间隔三个月接种两剂 Qdenga® 疫苗,被证明对住院登革热的疫苗效力为 86%,对病毒学证实的登革热的效力为 65%(Rivera等人。, 2021)。该疫苗未在 4 岁以下儿童中进行测试,4岁和5 岁儿童的疾病保护作用低于年龄较大的儿童和成人。
不建议血清反应阴性的个体接种 Qdenga® 疫苗(即既往没有登革热感染证据的个体,参见确定既往登革热感染部分)。试验数据目前不足以为这些个体提出建议。JCVI 对其针对英国旅行者的建议采取了预防措施,因为如果血清反应阴性的个体接种疫苗并随后暴露于登革热病毒 DENV3 或 DENV4,理论上存在患重登革热的风险。
登革热感染后,对所有血清型都有短暂的交叉保护,因此,应考虑在实验室确诊感染后将 Qdenga® 疫苗接种延迟一年(见预防措施)。
初次免疫接种
可以考虑接种疫苗:
4 岁及以上且既往可能有登革热感染史(见以下部分)的个体,并且:
● 计划前往有登革热感染风险的地区或登革热持续爆发的地区,或
● 通过工作接触登革热病毒,例如与病毒打交道的实验室工作人员
加强免疫接种
目前没有关于加强(即 第三次)剂量的需求或时间的数据。当有更多数据可用时,将更新本指南。
旅行风险评估
登革热是一种由蚊子传播的病毒感染,蚊子主要在白天进食。所有前往风险地区的旅行者都应采取措施避免蚊虫叮咬。
以前感染过登革热会增加个体患上严重登革热的风险。
在国际旅行期间感染登革热的机会由几个因素决定,包括目的地、暴露时间、传播强度和旅行季节(Wilder-Smith,2012)。长期在疫区逗留的旅行者(如外籍人士或援助工作者)面临的风险更高。然而,即使是短期访客也可能被暴露(Massad等人,2013 年)。
在英国,目前仅建议既往感染过登革热的人接种 Qdenga® 疫苗。
确定既往感染
任何接种疫苗的决定都应取决于获得可靠的登革热感染史。临床医生需要获得尽可能多的详细信息,包括既往旅行、疾病和疫苗接种史,并考虑任何实验室检测信息来做出评估(图 1 和 表 1)。
在没有可靠的确诊登革热感染史的情况下,也可考虑流行病学因素(例如在流行地区饲养)来支持检测和/或提供疫苗的决定(图 1,表 1)。
如果对既往病史有任何不确定性,则应清楚地解释接种疫苗的潜在风险。
急性感染的实验室诊断
只有在旅行者生病时接受了检测(通常通过 PCR 或抗原检测)才能可靠地确认既往登革热感染。旅行者可能有 PCR 或抗原检测的结果,或者能够提供可靠的确诊感染史。
在疾病的早期阶段,可以通过 PCR 在症状出现后的血液(通常在前 7 天)或尿液(长达 21 天)中检测到登革热病毒 RNA。登革热病毒 PCR 检测具有高度特异性,因此在任何时间点在任何样本中检测到登革热病毒 RNA 的病史都可以诊断既往登革热病毒感染。
相比之下,鉴于其他黄病毒感染和疫苗接种(寨卡病毒、蜱传脑炎、黄热病等)的交叉反应性,登革热病毒血清学的解释更加复杂。对原发性登革热病毒感染的免疫反应的典型模式是患病约 3-5 天后出现 IgM,并持续 2-3 个月。IgG 在大约 2 周后出现并持续数年。在继发性登革热中,无论血清群与既往感染是否不一致,登革热 IgG 通常都会增加,而 IgM 反应通常无法检测到。
既往感染的血清学诊断
对于发病时未进行检测的患者,可以进行既往感染的血液检测,并且可能显示既往登革热感染的证据,但结果可能不是决定性的,并且可能受到其他类似病毒感染或其他疾病(如黄热病、日本脑炎或蜱传脑炎)疫苗接种的影响。
对于仅 IgG 阳性的个体,接种疫苗的决定必须包括对 IgG 阳性结果的所有潜在原因的评估。如上所述,这些包括:
● 之前接触过登革热病毒的可能性,包括旅行和临床细节
● 接种其他黄病毒(黄热病、日本脑炎和蜱传脑炎)疫苗,这些病毒可能导致 IgG 假阳性结果
● 暴露于其他黄病毒,如西尼罗河病毒和寨卡病毒,可导致 IgG 假阳性结果
只有当登革热 IgG 最可能的解释是既往感染登革热时,才应建议接种疫苗。这可能受到既往暴露于登革热病毒的可能性的影响,例如,在登革热高度流行地区有长期居住史的患者,他们既往无症状感染的可能性很高。
图 1:调查既往登革热感染
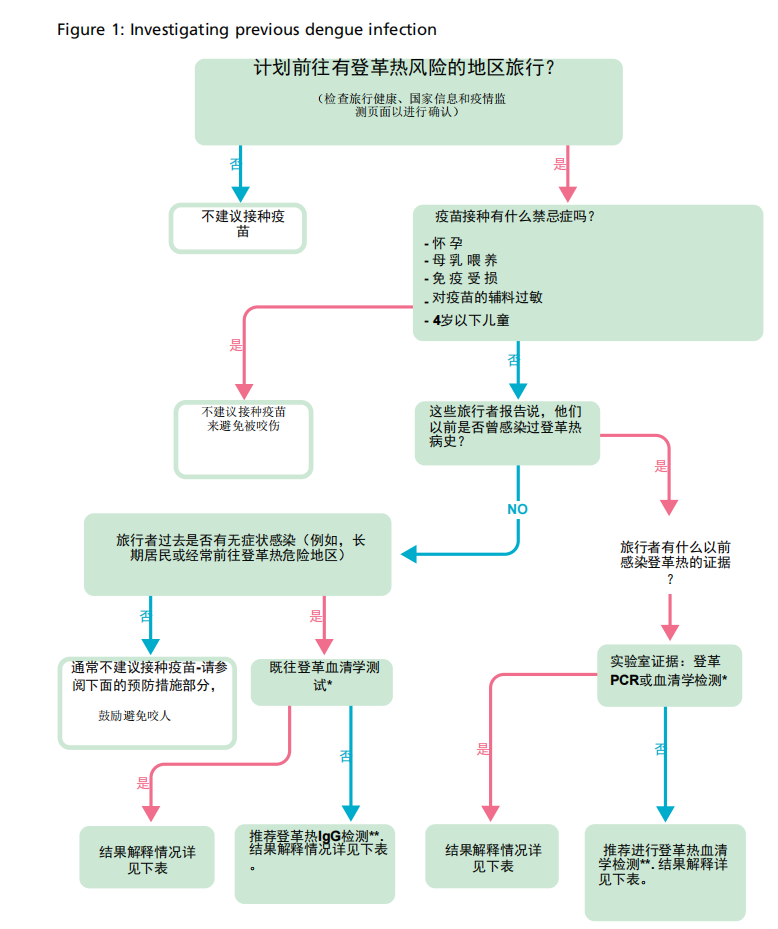
* 登革热血清学检查可能受到其他类似病毒或疫苗接种的影响,因此可能不是既往登革热感染的明确证据。
**如果尚未进行,可将登革热血清学(IgM 和 IgG)送至稀有和进口病原体实验室 (RIPL)或其他进行 ISO15189 认可检测的实验室
登革热病毒感染;然后,对结果的解释可以帮助指导免疫决策 – 另见上面的 *。
NS1 抗原检测阳性应在 4 周后通过血清学确认。
表 1:考虑接种疫苗的资格
| 无相符旅行、无相符疾病 | 无相符旅行、相符疾病 | 相符旅行、无相符疾病 | 相符旅行、相符疾病 | |
| IgM 阴性、IgG 阴性 在最后一次相容疾病后 ≥4 周采集的任何血样 | 不推荐接种疫苗 | 不推荐接种疫苗 | 不推荐接种疫苗 | 不推荐接种疫苗 |
| IgM 阳性、 旅行后<4周采集的血液样本IgG和PCR均为阴性 | 不推荐接种疫苗 | 不推荐接种疫苗 | 离开流行地区>4周后检测IgG | 相符疾病>4周后检测IgG |
| IgM 阴性, 旅行或疾病后>4周采集的血液样本IgG阳性 | 不推荐接种疫苗 | 不推荐接种疫苗 | 根据产生IgG†的其他原因,考虑接种疫苗* | 根据产生IgG†的其他原因,考虑接种疫苗* |
| IgM 和 IgG 任何血液样本均呈阳性 旅行后 >4 周和 <6 个采血 | 不推荐接种疫苗 | 不推荐接种疫苗 | 考虑接种疫苗 | 考虑接种疫苗 |
| 任何样品的 PCR 阳性 | 这应该和 RIPL讨论 | 这应该和 RIPL讨论 | 考虑接种疫苗 | 考虑接种疫苗 |
相符性疾病的定义:一种急性疾病,包括持续 2-7 天的发烧
伴有以下 2 项或更多项:头痛、眼眶后疼痛、肌痛、关节痛、皮疹、血小板减少症、白细胞减少症
相符旅行的定义:在一年中的任何时间前往全年地方性感染流行的地区,或在登革热季节前往季节性检测到登革热的国家或地区。请参阅https://travelhealthpro.org.uk/
* 推荐强度可能受既往接触登革热病毒的可能性的影响,因此受既往无症状疾病风险的影响。例如,登革热 IgG 阳性
代表在登革热高度流行环境中长期居住史的患者,既往登革热感染率高于暴露时间较短的患者。
既往感染检测
禁忌
Qdenga® 疫苗不应用于:
● 四岁以下的儿童
● 孕妇
● 哺乳期妇女
● 因先天性疾病或疾病过程(包括有症状的 HIV 感染)而患有原发性或获得性免疫缺陷的人,以及伴有免疫功能受损证据的无症状 HIV 感染者
● 因治疗而免疫抑制的人,包括大剂量全身性类固醇、免疫抑制生物疗法、放疗或细胞毒性药物(见第 6章)
● 已确认对前一剂疫苗有过敏反应的人
● 那些确认对疫苗的任何成分有过敏反应的人
预防 措施
对于患有急性严重发热性疾病的受试者,应推迟接种 Qdenga®。没有发热或全身不适的轻微疾病不是推迟免疫接种的有效理由。
有生育能力的妇女在接种疫苗后至少一个月内应避免怀孕。
登革热感染后,针对所有血清型存在短暂的交叉保护,因此,应考虑在实验室确诊感染后将 Qdenga® 疫苗接种推迟一年。
在特殊情况下,对于过去没有患过登革热的人,可以考虑接种 Qdenga® 疫苗。在这些情况下,应考虑专家建议。
不良反应
在临床研究中,最常报告的反应是注射部位疼痛、头痛、肌痛、注射部位红斑、不适、虚弱和发热。
这些不良反应通常发生在注射后 2 天内,严重程度为轻度至中度,持续时间短(1 至 3 天),并且第二次注射 Qdenga® 后的频率低于第一次注射后。
新许可的疫苗商品需要接受加强监测,并被授予“黑色三角形”状态(由商品信息上的倒三角形表示)。对于此类产品,成人和儿童均应报告所有严重和非严重的疑似药物不良反应 (ADR)。
Qdenga® 将受到药品和保健产品监管局 (MHRA) 的密切监测。电子邮件AE.GBR-IRL@takeda.com,所有疑似对 Qdenga® 的不良反应都应在黄卡计划中报告,并报告给制造商Takeda UK Ltd。
病例管理
疑似重症登革热病例的急性样本应送往英国卫生安全局 (UKHSA) 罕见和输入病原体实验室进行检查。
对于所有重症登革热病例,都应获取既往登革热疫苗接种史。
接种疫苗后发现疑似重症登革热病例的医护人员应尽快与其所在地区的传染病团队联系,寻求临床建议,并根据严重不良事件指导方针报告病例。
没有针对登革热的特异性疗法。应避免使用非甾体抗炎药,例如阿司匹林和布洛芬,因为它们会增加出血的风险。严重的登革热需要及时识别和经常住院,治疗支持适当的液体复苏。诊断检测可通过英国卫生安全局(UKHSA)的罕见和输入病原体实验室获得。
供应
Qdenga® 可从 Takeda UK Ltd,www.takeda.com/en-gb/, 0333 3000 181 购买。
引用
European Centre for Disease Prevention and Control (2024). Autochthonous vectorial transmission of dengue virus in mainland EU/EEA, 2010-present. Updated January 2024. Available at: https://www.ecdc.europa.eu/
en/all-topics-z/dengue/surveillance-and-disease-data/autochthonous-transmission-dengue-virus-eueea
(Accessed 20 February 2024).
Holmes EC. And. Twiddy SS. (2003) The origin, emergence and evolutionary genetics of dengue virus. Infect Genet Evol. May;3(1):19-28.
Hotta S. (1952) Experimental Studies on Dengue: I. Isolation, Identification and Modification of the Virus. The Journal of Infectious Diseases. January; 90(1): 1–9.
Massad E, Rocklov J. and Wilder-Smith A. (2013) Dengue infections in non-immune travellers to Thailand. Epidemiology and Infection. 141(2):412-417.
NHS England (2023) Health Technical Memorandum 07-01: Safe and sustainable management of healthcare waste. Available at: https://www.england.nhs.uk/publication/management-and-disposal-of-healthcare-waste- htm-07-01/ (Accessed: February 2024).
Rivera L. et al. (2022), Three-year Efficacy and Safety of Takeda’s Dengue Vaccine Candidate (TAK-003). Clin Infect Dis. 24;75(1):107-117. Available at: https://pubmed.ncbi.nlm.nih.gov/34606595/.
Tricou V, Essink B, Ervin JE, Turner M, Escudero I, Rauscher M, et al. (2023) Immunogenicity and safety of concomitant and sequential administration of yellow fever YF-17D vaccine and tetravalent dengue vaccine candidate TAK-003: A phase 3 randomized, controlled study. PLoS Negl Trop Dis 17(3): e0011124. https:// doi. org/10.1371/journal.pntd.0011124
Wilder-Smith A. (2012) Dengue infections in travellers. Paediatr Int Child Health. May; 32 Suppl 1(s1):28-32. Available at: https://www.tandfonline.com/doi/full/10.1179/2046904712Z.00000000050.
World Health Organization (2023) Dengue and Severe Dengue. Factsheet, Updated 17 March 2023, Available at: https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue (Accessed February 2024). World Health Organization (2023) Strategic Advisory Group of Experts on Immunization (SAGE) – September 2023. Available at https://www.who.int/news-room/events/detail/2023/09/25/default-calendar/sage_meeting_ september_2023 (Accessed March 2024).
Hits: 212
