World Health Organization Guidelines for Containment of Poliovirus Following Type-Specific Polio Eradication — Worldwide, 2015
,博士1;,医学博士1;1;,医学博士1
1988 年,世界卫生组织 (WHO) 世界卫生大会决定在世界范围内根除脊髓灰质炎。在三种野生脊髓灰质炎病毒 (WPV) 类型(1 型、2 型和 3 型)中,2 型 WPV (WPV2) 自 1999 年以来已在野外消除,而 3 型 WPV (WPV3) 自 2012 年以来就没有报道过。2015 年,只有阿富汗和巴基斯坦报告了 WPV 传播 (1)。2015 年 5 月 25 日,世卫组织所有会员国批准了世界卫生大会关于全面实施《2013-2018 年根脊髓灰质炎和终局战略计划》(2,3)(《终局计划》)的第 68.3 号决议,以及随之而来的第三项全球行动计划,以尽量减少脊髓灰质炎病毒设施相关风险 (4) (GAPIII)。世卫组织所有会员国都承诺到2015年底在必要的实验室和疫苗生产设施*中适当遏制2型口服脊髓灰质炎病毒疫苗,并在计划于2016年4月全球停用2型口服脊髓灰质炎病毒疫苗后3个月内对2型口服脊髓灰质炎病毒疫苗进行适当遏制(5)。本报告总结了打算保留已确认含有或可能含有特定类型野生脊灰病毒、疫苗衍生脊髓灰质炎病毒 (VDPV) 或 OPV/Sabin 病毒的材料的基本实验室和疫苗生产设施的关键步骤,以及处理含有或可能含有脊髓灰质炎病毒的标本的非必要设施†步骤。国家当局需要证明其托管的基本设施符合 GAPSIII 中描述的遏制要求。在获得根除 WPV 的认证后,将停止使用所有 OPV;在根除脊髓灰质炎和停止口服脊髓灰质炎疫苗后,对所有脊髓灰质炎病毒的最终遏制将最大限度地降低脊髓灰质炎病毒再次进入无脊髓灰质炎世界的风险。
背景
终局计划 (3) 设定了根除 WPV 和 VDPV 的目标。实现这一目标需要 1) 检测传播的脊髓灰质炎病毒并阻断传播;2) 依次停止使用类型特异性 OPV,以消除疫苗相关麻痹性脊髓灰质炎、免疫缺陷人群慢性 VDPV 感染和循环 VDPV (cVDPV) 暴发的风险 (6,7);3) 实施安全处理和遏制脊髓灰质炎病毒的措施,以最大限度地降低与设施相关的病毒再次进入无脊髓灰质炎社区的风险。停止口服脊髓灰质炎疫苗的第一步是在全球范围内同步停用口服脊髓灰质炎疫苗,自 1999 年最后一次报告 WPV2 以来,约 90% 的 cVDPV 病例已导致 OPV2 病例。OPV2 的退出将通过用二价 OPV (bOPV) 代替三价 OPV (tOPV) 来实现,在所有使用 OPV 进行常规免疫的国家中预防 1 型和 3 型,然后引入至少 1 剂灭活脊髓灰质炎病毒疫苗 (IPV),可预防所有三种病毒类型 (5)。预计 2016 年 4 月批准确认全球从 tOPV 转换为 bOPV,之后将在 2015 年 10 月审查是否满足一些准备标准,包括完成脊髓灰质炎病毒控制活动初始阶段的进展情况,以及建立适当处理残留 2 型材料的准备情况,如下所述。
方法
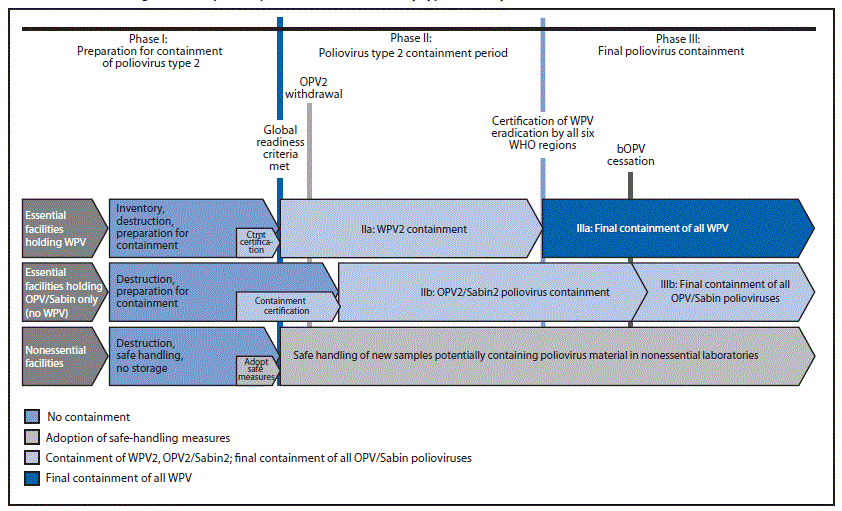
终局计划包括分阶段停用 OPV 菌株。GAPIII 与终局计划保持一致,包括三个阶段(图):第一阶段,遏制 2 型脊髓灰质炎病毒的准备工作,持续到满足转换的全球准备标准(当前目标是 2015 年底);第二阶段,2 型脊髓灰质炎病毒控制,持续到 WHO 所有区域都认证消除 WPV;和 III 期,最终遏制脊髓灰质炎病毒。目前,所有国家的国家当局都负责完成第一阶段并为第二阶段做准备(表 1)。
GAPIII 中描述的控制措施反映了遏制最佳实践,主要源自欧洲标准化委员会研讨会协议 15793 (2011) — 实验室生物风险管理 (8),并提供了脊髓灰质炎病毒传播和生物风险管理领域领导者的意见。
理由
在特定类型根除脊髓灰质炎病毒后,从脊髓灰质炎病毒设施重新引入 WPV 可能会带来重新建立 WPV 传播的潜在灾难性后果。当 OPV 使用停止时,许多国家将保持 IPV 的高人口覆盖率,其他国家的 IPV 覆盖率将不理想,还有一些国家可能会停止使用 IPV 和所有国家脊髓灰质炎免疫活动。从设施中重新引入 OPV/Sabin 毒株会带来未被识别的病毒传播、恢复到 cVDPV 和重新建立脊髓灰质炎病毒传播的风险。
大多数国家在根除 WPV 和停止使用 OPV 后无需保留脊髓灰质炎病毒。通过在全国范围内彻底搜索和销毁所有传染性和潜在传染性材料,包括 WPV、VDPV 和 OPV/Sabin 病毒,可以消除这些国家/地区的设施相关风险。一些国家将拥有数量有限的基本实验室和疫苗生产设施,用于关键的计划和研究功能,包括 IPV 和 Sabin-IPV(使用 Sabin 口服疫苗的减毒菌株作为种子生产的 IPV)的生产、每种类型单价 OPV 库存的生产和储存、疫苗质量保证、诊断试剂生产和关键研究。每个重要的脊髓灰质炎病毒设施都应适当管理生物风险,以最大限度地降低病毒再次进入社区的风险,并通过有效的国家认证和 WHO 验证计划来确保符合 GAGAPIII。通过确保基本设施位于人口免疫力高、急性弛缓性麻痹和环境监测的地区,并辅以高效的公共卫生和应对能力,可以进一步降低脊髓灰质炎病毒再次引入的风险(表 2)。最大限度地减少全球必要设施的数量将进一步降低风险的大小,促进国家和国际监督,并增强满足和成功维持全球遏制标准的可能性。
策略和实施
第一阶段:准备遏制所有 2 型脊髓灰质炎病毒。第一阶段目前正在进行中。第二种野生脊灰病毒第一阶段将持续进行,直到满足全球戒断口服脊灰疫苗的条件(表1),其中包括消除持续性cVDPV2和认证根除第二野生脊灰病毒,目前计划于2015年10月进行审查。OPV2/Sabin2 的 I 期将持续到从 tOPV 转换为 bOPV 后 3 个月。接受调查的国家实验室应包括:1)所有处理WPV2/VDPV2的公共或私人设施,以及所有处理OPV2/Sabin2或处理可能含有WPV2、VDPV2或OPV2/Sabin2的粪便或呼吸材料的设施(在使用OPV的时间和地点收集),以及2)所有可能收集传染性或潜在传染性WPV2的公共或私人设施; 出于任何原因维护的任何来源的 VDPV2 或 OPV2/Sabin2 材料。
保留可能含有 WPV2/VDPV2 病毒样本的设施必须在 IIa 阶段开始之前销毁或包含此类材料。希望保留可能含有 OPV2/Sabin2 病毒的标本(即在使用口服脊髓灰质疫苗的地方收集的粪便或呼吸道样本)的设施必须在 IIb 阶段开始之前销毁或包含此类材料。希望保留可能包含脊髓灰质炎病毒的临床材料的历史收藏,但不打算实施 GAPSI 中描述的脊髓灰质炎病毒遏制措施的实验室,必须探索使用指定的经认证的基本脊髓灰质炎病毒设施进行处理和储存安排的转移选项。
第二阶段:2 型脊髓灰质炎病毒遏制期。一旦满足 OPV2 戒断的全球准备标准,第二阶段就开始 (5),目前计划于 2016 年 1 月进行(表 1)。这一阶段包括两部分:第一阶段(第二阶段a)解决遏制第二野生脊灰病毒的问题,第二阶段(第二阶段b)在经认证的基本设施中遏制OPV2/Sabin2脊髓灰质炎病毒。IIa 阶段在消除持续性 cVDPV2 和获得根除 WPV2 认证后,在全球准备停用 OPV2 时开始,并在 WHO 所有六个区域均已认证根除 WPV 后结束。IIb 期在停用 tOPV 并转为 bOPV 后 3 个月内开始,并在全面停用 bOPV 后 3 个月内结束。在第二阶段处理和储存 WPV2 或 OPV2/Sabin2 材料的基本脊髓灰质炎病毒设施必须获得实施遏制措施的认证,并根据 GAPiii 中描述的 WPV2 遏制规定定期重新评估,包括主要和次要保障措施(表 2)。一旦第二阶段开始,未获得 WPV2 遏制国家认证的设施将不再被允许处理和储存 WPV2 材料。国家或有关设施可通过其国家当局向世卫组织申请,以核实基本脊髓灰质炎病毒设施中的遏制情况,该设施必须经卫生部或其他指定的国家当局认证,并声明符合符合全球行动计划的所有生物风险管理标准iii。
第三阶段:最终遏制脊髓灰质炎病毒。第三阶段也有两个部分(第三阶段和第三阶段)。IIIa 阶段(消灭脊髓灰质炎后最终遏制所有 WPV)开始于 WHO 所有六个区域都完成根除 WPV 的认证后,即最后一次分离 WPV 至少 3 年后(表 1)。处理和储存任何野生脊灰病毒或疫苗衍生脊灰病毒材料的经认证的基本实验室和 IPV 生产设施必须对所有野生脊灰病毒规定实施最终遏制,包括一级、二级和三级防护措施(表 2)。一旦第三阶段开始,未获得所有野生脊灰病毒最终遏制国家认证的设施将不再被允许处理和储存任何野生脊灰病毒材料。在全球停止 bOPV 时(目前计划在全球宣布根除 WPV 后 1 年),所有国家必须召回并销毁 bOPV 库存。世卫组织将提供从指定收集点、卫生机构或私人医生以及国家和国家以下各级储存设施收集和销毁双价口服脊髓灰质炎疫苗的具体实施指南(9)。
IIIb 期(bOPV 停止后所有 OPV 脊髓灰质炎病毒的最终遏制)将在全球 bOPV 停止后 3 个月开始(图)(表 1)。经认证的脊髓灰质炎病毒基本实验室和处理和储存 OPV/Sabin 材料(但没有 WPV)的 Sabin-IPV 疫苗生产设施必须实施遏制所有 OPV/Sabin 脊髓灰质炎病毒的最终规定,包括主要和次要保障措施(表 2)。一旦 IIIb 期开始,尚未获得所有 OPV/Sabin 脊髓灰质炎病毒最终遏制国家认证的设施将不再被允许处理和储存 OPV/Sabin 材料。在停止 bOPV 后 6 个月内,所有国家必须提交文件,证明已满足最终遏制所有 OPV/Sabin 脊髓灰质炎病毒的要求。
讨论
据估计,全世界目前有 500 家机构持有 2 型脊髓灰质炎病毒。脊髓灰质炎病毒遏制的目标之一是大幅减少这一数量 (10),劝阻不符合基本设施 GAPIII 遏制标准的候选设施不要持有任何脊髓灰质炎病毒。
需要注意的是,脊髓灰质炎病毒诊断实验室将继续对监测至关重要,并将在未来几年内保持这种状态。脊髓灰质炎病毒诊断实验室只要不保留活脊髓灰质炎病毒,就不需要成为经过认证的必要脊髓灰质炎病毒设施才能继续开展工作。然而,执行参考(和诊断)功能的实验室需要保留活的脊髓灰质炎病毒,从而获得符合基本脊髓灰质炎病毒设施标准的认证。只有经认证符合 GAPIII 遏制要求的指定基本脊髓灰质炎病毒设施才能处理和储存脊髓灰质炎病毒。
GAPIII 中提出的针对特定类型脊髓灰质炎病毒遏制的时间表很短,既要评估和认证候选基本脊髓灰质炎病毒设施以满足 GAPIII 要求,也要让负责遏制的国家当局提供遏制证书。然而,继续脊髓灰质炎疫苗的生产、监测和研究至关重要,必须继续进行。为了帮助管理与基本实验室和疫苗生产设施实施密闭相关的实际挑战,已经提出了临时密闭认证。临时认证将允许遏制认证在根除的最后阶段以受控和结构化的方式进行,因为与满足完全遏制证书要求相关的问题在紧迫的时间表内得到解决。拟议的机制将提供一定程度的灵活性,因为设施会做出必要的改变,国家当局和其他管理机构会发展实施认证要求所需的能力。
所有野生脊灰病毒/疫苗衍生脊灰病毒(包括 1 型和 3 型)的最终遏制工作即将到来。在阻止 WPV 传播后,一旦逐步淘汰所有 OPV 使用,对所有脊髓灰质炎病毒的最终控制将最大限度地降低脊髓灰质炎病毒再次进入无脊髓灰质炎世界的风险。与天花病毒的情况一样,必须定期评估和维护遏制要求,直到做出全球决定销毁所有剩余的脊髓灰质炎病毒材料并禁止任何从头合成。
1世界卫生组织根除脊髓灰质炎司。
通讯作者:Nicoletta Previsani 博士,previsanin@who.int,41-22-791-2866。
引用
- Hagan JE、Wassilak SGF、Craig AS 等人。根除脊髓灰质炎的进展 – 全球,2014-2015 年。MMWR Morb Mortal Wkly 代表 2015;64:527–31.
- 世界卫生组织。脊髓灰质炎。瑞士日内瓦:世界卫生大会第六十八号决议WHA68.3,2015年5月26日。可在http://apps.who.int/gb/ebwha/pdf_files/WHA68/A68_R3-en.pdf

 .
. - 全球根除脊髓灰质炎倡议。2013-2018 年根除脊髓灰质炎和终局战略计划。瑞士日内瓦:全球根除脊髓灰质炎倡议;2013. 可在http://www.polioeradication.org/portals/0/document/resources/strategywork/endgamestratplan_20130414_eng.pdf

 .
. - 世界卫生组织。GAPIII:世卫组织全球行动计划,以尽量减少脊髓灰质炎病毒设施相关风险。瑞士日内瓦:世界卫生组织;2014. 可在http://www.polioeradication.org/Portals/0/Document/Resources/PostEradication/GAPIII_2014.pdf

 .
. - 全球根除脊髓灰质炎倡议的免疫系统管理小组。2013-2016 年全球引入灭活脊髓灰质炎病毒疫苗并从三价口服脊髓灰质炎病毒疫苗转变为二价口服脊髓灰质炎病毒疫苗。MMWR Morb Mortal Wkly 代表 2015;64:699–702.
- Platt LR, Estívariz CF, Sutter RW.疫苗相关麻痹性脊髓灰质炎:流行病学回顾和全球负担估计。J Infect Dis 2014;210(增刊 1):S380-9。
- Diop OM、Burns CC、Sutter RW、Wassilak SG、Kew OM. 疫苗衍生脊髓灰质炎病毒的最新情况——全球,2014 年 1 月至 2015 年 3 月。MMWR Morb Mortal Wkly 代表 2015;64:640–6.
- 欧洲标准化委员会。实验室生物风险管理。CEN 研讨会协议 15793:2011,2011 年 9 月。可在http://www.uab.cat/doc/CWA15793_2011
 .
. - 世界卫生组织。从 tOPV 到 bOPV 的转换实施指南。瑞士日内瓦:世界卫生组织;2014. 可在http://www.who.int/immunization/diseases/poliomyelitis/endgame_objective2/oral_polio_vaccine/switch_guidelines-april2015.pdf?ua=1
 .
. - Dowdle W、van der Avoort H、de Gourville E 等人。根除和停止 OPV 后脊髓灰质炎病毒的遏制:描述风险以改善管理。风险分析 2006;26:1449–69.
* 由卫生部或其他指定的国家机构或当局指定的设施,履行关键的国家或国际职能,涉及在 GAPIII 规定的条件下处理和储存所需的脊髓灰质炎病毒传染性材料或潜在传染性材料。
† 任何可能调查新的野生脊灰病毒、2型减毒疫苗衍生脊髓灰质炎病毒(aVDPV2)、2型循环疫苗衍生脊髓灰质炎病毒(cVDPV2)或灭活的2型疫苗衍生脊髓灰质炎病毒(VDPV2)分离株,或来自近期使用口服脊髓灰质炎疫苗的国家的新粪便或呼吸道样本,并采用和实施1)基于风险评估的安全工作做法,并实施良好农业行动计划III中所述的适当生物风险管理系统。 2) 自 2 型脊髓灰质炎病毒遏制期 IIa 阶段开始时对 WPV2 材料采取不留存政策,以及 3) 自 2 型脊髓灰质炎病毒遏制期 IIb 阶段开始时对 OPV2/Sabin2 材料不留存政策。
表 1.在第三个全球行动计划 (GAPIII)* 中分阶段实施脊髓灰质炎病毒遏制活动,以最大限度地降低全球脊髓灰质炎病毒设施相关风险 | |||
|---|---|---|---|
先决条件 | 开始 | 完成目标 | 主要活动 |
第一阶段:2 型 PV 遏制准备 | |||
没有 | 持续 | 对于 WPV2:OPV2 戒断的全球准备情况(全球准备情况审查的目标是 2015 年 10 月) 对于 OPV2/Sabin2:停用 tOPV 后 3 个月 | • 政府、机构以及实验室和疫苗生产机构了解即将需要的特异性脊髓灰质炎病毒遏制需求 • 处理或储存传染性或潜在传染性脊髓灰质炎病毒材料的实验室设施和疫苗生产设施的清点和调查 基本设施†: • WPV2 保存实验室和 IPV 生产设施的国家认证 非必要设施§: • 销毁不需要的光伏材料 • 将所需的 PV 2 型材料转移到必要的实验室设施 • 如果标本调查继续进行,将在 IIa 阶段对新的 WPV2 分离株采用不保留政策 |
IIa 期:WPV2 遏制 | |||
消除流行的 WPV2 消除持续性 cVDPV2 | 一旦满足全球 OPV2 戒断准备标准(目标是 2016 年 1 月) | 在所有 WHO 六个区域都已批准根除 WPV 之后 | 基本设施†: • 在 GAPIII 概述的“遏制 WPV2”条件下处理和储存 WPV2 材料 非必要设施§: • 销毁剩余的不需要的 OPV2 材料 • 将所需的 OPV2 材料转移到经认证的基本实验室设施 继续进行样本调查的非必要设施¶: • 实施不保留政策 • 销毁不需要的最近隔离的光伏材料 • 将需要的最近隔离的光伏材料转移到经过认证的必要设施 |
IIb 阶段:OPV/Sabin PV 2 型 (OPV2/Sabin2) 遏制 | |||
获得许可的 bOPV(1 型和 3 型) 全球 IPV 介绍 全局 tOPV-bOPV 切换 | 全球 tOPV 转换为 bOPV 后的 3 个月内(全球转换的目标是 2016 年 4 月) | 全球停止 bOPV 后 3 个月内(计划在全球根除 WPV 认证 1 年后) | 基本设施†: • 在 GAPIII 中概述的“遏制 OPV2/Sabin2 脊髓灰质炎病毒”条件下处理和储存 OPV 材料 |
IIIa 阶段:根除脊髓灰质炎后最终遏制所有 WPV | |||
3 年未分离 WPV | 一旦 WHO 所有六个区域都批准了 WPV 根除 | 长期根除(全球 bOPV 停用后) | 基本设施†: • 按照 GAPIII 中所述,在“最终遏制所有 WPV”条件下处理和储存所有 WPV 材料 |
IIIb 期:bOPV 停止后所有 OPV/Sabin PV 的最终生物防护 | |||
全球 bOPV 戒断 | 全球停止 bOPV 后 3 个月内(计划在全球根除 WPV 认证 1 年后) | 长期根除(全球 bOPV 停用后) | 基本设施†: • 按照 GAPIII 中所述,在“最终遏制所有 OPV/Sabin 脊髓灰质炎病毒”条件下处理和储存 OPV 材料 |
缩写:bOPV = 二价口服脊髓灰质炎疫苗(1 型和 3 型);cVDPV2 = 2 型循环疫苗衍生脊髓灰质炎病毒;GAPIII = 将脊髓灰质炎病毒设施相关风险降至最低的第三个全球行动计划;IPV = 灭活脊髓灰质炎病毒疫苗;OPV = 口服脊髓灰质炎病毒疫苗;OPV2 = 2 型 OPV;PV = 脊髓灰质炎病毒;tOPV = 三价 OPV(1、2 和 3 型);WHO = 世界卫生组织;WPV = 野生脊髓灰质炎病毒;WPV2 = 2 型 WPV。 * 可在http://www.polioeradication.org/Portals/0/Document/Resources/PostEradication/GAPIII_2014.pdf † 由卫生部或其他指定的国家机构或当局指定的设施,履行关键的国家或国际职能,涉及在 GAPIII 规定的条件下处理和储存所需的脊髓灰质炎病毒传染性材料或潜在传染性材料。 § 任何可能调查新的野生脊灰病毒2、aVDPV2、cVDPV2或iVDPV2分离株,或来自近期使用口服脊灰疫苗的国家的新粪便或呼吸道样本,并采用和实施a)基于风险评估和实施良好农业行动计划III中所述的适当生物风险管理系统的安全和可靠的工作做法,b)截至2型脊髓灰质炎病毒遏制期IIa阶段开始时对野生脊灰病毒材料采取不保留政策; c) 截至 2 型脊髓灰质炎病毒遏制期 IIb 阶段开始时对 OPV2/Sabin2 材料的不保留政策。 ¶ 所有研究新型 WPV2 的非必要实验室;aVDPV2、cVDPV2 或 iVDPV2 分离株,或来自最近使用 OPV 的国家/地区的新粪便和呼吸道样本。 | |||
表 2.在世界范围内根除野生脊髓灰质炎病毒并逐步停止使用口服脊髓灰质炎疫苗后,将脊髓灰质炎病毒设施相关风险降至最低的遏制保障措施 | |||
|---|---|---|---|
保障 | 脊髓灰质炎病毒 2 型生物防护(IIa 期和 IIb 期) | 最终脊髓灰质炎病毒生物防护 | |
所有 2 型脊髓灰质炎病毒 | 所有 OPV/Sabin 脊髓灰质炎病毒 | 所有野生脊髓灰质炎病毒 | |
主要防护措施:预防感染和释放受污染物质 | |||
作员保护* | 是的 | 是的 | 是的 |
材料/设备的去污 | 是的 | 是的 | 是的 |
专用污水处理厂 | 否† | 否† | 是§ |
空气/排气处理 | 不 | 不 | 是¶ |
次要保障措施:国家托管设施中的人口免疫力 | |||
IPV 剂量 | ≥1 | ≥1 | ≥3 |
IPV 覆盖率 | = DTP3 覆盖率** | = DTP3 覆盖率** | >90% |
第三保障措施:环境和位置 | |||
将设施设在野生脊髓灰质炎病毒传播可能性低的地区 | 不 | 不 | 是的 |
* 由于作者被认为是脊髓灰质炎病毒从设施中释放的来源之一,因此需要采取特定的保护措施,包括使用个人防护设备、使用初级防护装置和接种疫苗。 † 未经处理的排放到封闭的污水系统中,并在设施所在地进行二次污水处理(注意:来自设施的所有废物,可能含有活脊髓灰质炎病毒,应在排放前通过适当和经过验证的灭活程序进行灭活。对于没有专用污水处理厂的设施,这通常是通过加热或化学品作为经过验证的处理过程的一部分来完成的。在任何情况下,都不应将含有脊髓灰质炎病毒的未经处理的污水排放到下水道,除非污水处理厂的设计和验证可以处理此类污水,并有效地作为主密封系统的一部分。 § 在排放到封闭的污水系统之前进行设施污水处理,并在设施所在地进行二级或更大的污水处理。 ¶ 废气上的 HEPA(高效颗粒物捕集)过滤。 ** 白喉-破伤风-百日咳 (DTP3) 疫苗第三剂覆盖率;可在http://www.who.int/gho/immunization/dtp3/en/ | |||
使用商品名称和商业来源仅用于识别身份,并不意味着美国国务院认可 卫生与公众服务部。
互联网上对非 CDC 站点的引用包括 作为一项服务提供给 MMWR 读者,不构成或暗示 CDC 或美国对这些组织或其计划的认可 卫生与公众服务部。CDC 不对内容负责 在这些网站上找到的页面。MMWR 中列出的 URL 地址是截至 发布日期。
- 页面最后审阅日期:2015 年 8 月 28 日
- 本页面最近更新时间:2015 年 8 月 28 日
- 内容来源:美国疾病控制与预防中心
Hits: 56
- 生物类似药药学相似性研究的问题与解答(征求意见稿)
- 麻疹疫苗:世卫组织的立场文件
- 已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(预防用生物制品)
- 生物技术/生物制品在生产工艺变更前后的可比性
- 疫苗生产场地变更质量可比性研究技术指导原则
- 已上市疫苗药学变更研究技术指导原则(征求意见稿)
- 已上市生物制品药学变更研究技术指导原则(试行)
- 青少年免疫接种讨论指南
- 推荐的儿童和青少年免疫计划:美国,2025年:政策声明
- 儿童免疫接种讨论指南
- 建议用于出生至 6 岁儿童疫苗接种计划
- 脑膜炎(细菌性)和脑膜炎球菌病:识别、诊断和管理NICE指南更新摘要
- 轮状病毒疫苗:世卫组织立场文件-2021年7月
- 关于新冠肺炎疫苗抗原成分的声明 2024年12月
- 多糖结合疫苗药学研究及评价技术指导原则(试行)
- 疫苗临床试验统计学指导原则(试行)
- ACIP建议
- 药物临床试验样本量估计指导原则(试行)
- 预防用猴痘疫苗临床试验技术指导原则(试行)
- 美国胃肠病学会免疫抑制药物治疗期间乙型肝炎病毒再激活的预防和治疗指南
- 免疫抑制情况下的乙型肝炎再激活
- 使用自体配子降低生育治疗期间病毒传播风险的建议:委员会意见
- HBV筛查、检测和诊断
- 选择初始 HBV 治疗方案
- 何时开始HBV治疗
- 监测开始接受丙肝治疗、正在接受治疗或已经完成治疗的患者
- 慢性乙型肝炎患者的初步评估
- 疫苗说明书临床相关信息撰写指导原则(试行)
- 预防用猴痘疫苗药学研究技术指导原则(试行)
- 了解疫苗接种率的行为和社会驱动因素 世卫组织立场文件 – 2022年5月
- 2025年至2026年夏季新冠肺炎疫苗使用指南
- COVID-19 体征、症状和疾病严重程度:临床医生指南
- 预防和控制儿童流感的建议,2024–2025:政策声明
- 预防和控制儿童流感的建议,2024–2025:技术报告
- 卡介苗疫苗:世卫组织立场文件——2018年2月
- 减轻疫苗接种疼痛:世界卫生组织(WHO)立场文件—2015年9月
- 霍乱疫苗:世卫组织立场文件 – 2017 年 8 月
- 维生素A用于美国麻疹管理
- 生物制品注册受理审查指南(试行)
- 登革热疫苗:世卫组织立场文件 – 2024 年 5 月
- 白喉疫苗:世卫组织立场文件——2017年8月
- 世卫组织关于甲型肝炎疫苗的立场文件 – 2022年10月
- 世界卫生组织《根除特定类型脊髓灰质炎后遏制脊髓灰质炎病毒指南》 — 全球,2015 年
- 老年人 RSV 疫苗指南
- 英国2025年常规免疫计划
- 麻疹、腮腺炎、风疹疫苗 (PRIORIX):免疫实践咨询委员会的建议 — 美国,2022 年
- 2025 年推荐的7至18岁儿童和青少年免疫接种计划
- 乙型肝炎疫苗:世界卫生组织立场文件(2017 年 7 月)
- 全科医生带状疱疹疫苗接种计划技术指南
- AGA 关于预防和治疗高危人群乙型肝炎病毒再激活的临床实践指南
- 世界卫生组织关于戊型肝炎疫苗的立场文件(2015 年5 月)
- 世界卫生组织立场文件:b 型流感嗜血杆菌疫苗的接种(2013 年 7 月)
- 人乳头状瘤病毒疫苗:世卫组织立场文件(2022年更新)
- 2022年美国动物医院协会(AAHA)推荐的犬类疫苗指南
- 流感疫苗:世卫组织立场文件—— 2022年5月
- 日本脑炎疫苗:WHO 立场文件
- 猴痘临床指南
- 疟疾疫苗:世卫组织的立场文件
- 麻疹疫苗:世卫组织立场文件—2017年4月
- 脑膜炎球菌疫苗:世卫组织关于非洲脑膜炎地带国家使用多价脑膜炎球菌结合疫苗的立场文件,2024 年 1 月
- A 群脑膜炎球菌结合疫苗:更新后的指导意见(2015 年 2 月)
- 百日咳疫苗:世卫组织立场文件 – 2015 年 8 月
- 猴痘的临床管理与感染预防与控制 临时快速响应指南
- 老年人肺炎球菌疫苗接种考虑因素
- 肺炎球菌疫苗:世卫组织关于其在社区爆发环境中使用的立场文件
- 婴幼儿使用的肺炎球菌结合疫苗:世卫组织立场文件——2019年2月
- 脊灰疫苗:世卫组织立场文件 – 2022年6月
- 风疹疫苗:世卫组织立场文件——2020年7月
- 世界卫生组织关于破伤风疫苗的立场文件——2017 年 2 月
- 蜱传脑炎疫苗: 世卫组织立场文件 – 2011 年
- 伤寒疫苗:世卫组织立场文件 – 2018 年 3 月
- 水痘疫苗和带状疱疹疫苗: 世界卫生组织立场文件(2014年6月)
- LC16m8(冻干牛痘减毒活疫苗)天花和 mpox 疫苗:临时指南,2025 年 4 月 22 日
- 世卫组织关于黄热病疫苗的立场文件(2013 年 6 月)
- 黄热病疫苗:世卫组织对分次剂量使用的立场 – 2017 年 6 月
- 世卫组织关于免疫接种以保护婴儿感染呼吸道合胞病毒病的立场文件 2025 年 5 月
- 世卫组织接触者追踪指南
- 世卫组织关于带状疱疹疫苗的立场文件 – 2025 年 7 月
- 世卫组织立场文件:5岁以下婴幼儿肺炎球菌结合疫苗——2025年9月
- 世界卫生组织关于水痘疫苗的立场文件 ——2025 年 11 月
- 减轻疫苗接种时的疼痛:世界卫生组织立场文件 ——2015 年 9 月