Contents
世卫组织细菌优先病原体清单,2024年
细菌病原体对公共卫生的重要性,以指导研究,发展和战略,以预防和控制抗生素耐药性
内容
新药
新诊断
附件4的参考文献
表格和方框列表
表1.多标准决策分析(MCDA)优先排序流程中的步骤(步骤重叠 并且是非顺序的)
表A2.12 .根据未来潜在治疗可用性的可能性对耐药病原体进行评级
表A3.1 .使用多标准决策进行细菌病原体评估的总结结果分析(MCDA)
表A4.1.2022年9月,为治疗结核病的新抗结核药物和药物方案的全球临床开发管线
表A4.2 .耐药结核病优先排序标准、定义(用于独立评估的标准耐多药结核病)
图表列表
图2.与2017年BPPL相比,2024年BPPL更新中优先考虑的病原体
图a 1.1. 2017年和2024年世卫组织BPPL评估标准
图A1.2.全球PAPRIKA调查问题示例
图A1.3 .病原体-抗生素组合:根据细菌的家族和顺序排列后的流线
图a 4.1:2020年因耐多药结核病事件导致的残疾和死亡率上升而导致的全球残疾调整寿命年总数,按结核病疾病和结核病后时期分类(千)
致谢
本报告由世界卫生组织(WHO)编写。该报告由世卫组织抗微生物部门与世卫组织全球结核病规划合作领导编写。世卫组织要感谢为本文件的编制做出贡献的许多个人:
本文件由(技术概念、证据审查或综合、多标准决策分析(MCDA)研究方案设计、数据收集或分析和结果展示)编制:
Hatim Sati(项目负责人),Valeria Gigante和Alexandra Megan Cameron在Haileyesus Getahun(世卫组织AMR部门全球协调部)的总体指导下对各方面做出了贡献。
以下来自世卫组织全球结核病规划的同事汇编了关于耐利福平结核病的部分内容:马特奥·齐尼奥、福阿德·米尔扎耶夫、林一阮和塞缪尔·舒马赫。他们的贡献包括技术概念化、证据的审查和综合、数据收集或分析以及最终编制经常性结核病独立评估部分(附件4)以及报告中介绍的其他经常性结核病部分、分析和产出。
以下人员参与了本研究项目和报告的开发。他们的不懈努力有助于确保这项世卫组织工作的技术方面,世卫组织感谢他们的宝贵贡献:
•为2024年世卫组织细菌优先病原体清单多标准决策分析(MCDA)研究提供技术支持,以对细菌病原体进行排名(对所有方面做出主要贡献,包括技术概念、证据审查或综合、MCDA研究方案开发和设计、数据收集或分析以及最终报告审查):Evelina Tacconelli、Elena Carrara、Alessia Savoldi(意大利维罗纳大学)。数据提取和分析团队包括西蒙·波奇亚、恩里卡·坎帕纳罗、胡安·安东尼奥·波罗·德尔·卡斯蒂略、雅格布·加拉斯科和尤金妮亚·马里尼(意大利维罗纳大学)。Paul Hansen(新西兰奥塔哥大学)为全球调查设计和包括统计分析在内的其他方法方面提供了支持。
•对耐药结核独立分析的技术支持(对与耐多药结核病评估有关的各方面做出贡献,包括技术概念开发、证据审查或综合、数据收集或分析以及附件4的编写或审查):Emily LH MacLean、H. Manisha、Greg J. Fox(澳大利亚悉尼大学医学和健康学院);尼古拉斯·门泽斯(美利坚合众国波士顿哈佛大学陈振华公共卫生学院);Peter J. Dodd(联合王国谢菲尔德谢菲尔德大学谢菲尔德卫生和相关研究中心);Anna Dean、Fuad Mirzayev、Linh N. Nguyen、Matteo Zignol和Samuel G. Schumacher(世界卫生组织世卫组织全球结核病规划)。
•世卫组织BPPL-2024咨询小组为该项目和报告提供了宝贵的建议和贡献。按字母顺序排列的成员是:Aaron Aboderin(尼日利亚奥巴费米·阿沃洛沃大学)、马耶德·阿尔戈里比(沙特阿拉伯阿卜杜拉国王国际医学研究中心)、Jameela Alsalman(巴林阿拉伯海湾大学)、Afreenish Amir(巴基斯坦国家卫生研究所)、Anucha Apisarnthanarak(泰国法政大学医院)、Martin Blaser(美国罗格斯大学、Amany El-Sharif(埃及阿兹哈尔大学药学院)、Sabiha Essack(南非夸祖鲁-纳塔尔大学抗菌研究单位)、Stephan Harbarth Gwenan Knight(联合王国伦敦热带医学和卫生学院)、Dominique蒙奈(瑞典欧洲疾病预防和控制中心AMR和保健相关感染科)、Jeremiah Chakaya Muhwa(肯尼亚利物浦热带医学院)、Timothée Ouassa(科特迪瓦费利克斯乌弗埃-博瓦尼大学)、Benjamin Park(国际感染预防和控制、疾病控制和预防中心以及美国全球抗击艾滋病、结核病和疟疾基金)、Rosa Sacsaquispe(利马国家卫生研究所) julitte sever in(荷兰伊拉斯谟大学医学中心医学微生物学和传染病系)、Motoyuki Sugai(日本国家传染病研究所AMR研究中心)、Neelam Taneja(印度昌迪加尔医学教育和研究所)和Alaine Umubyeyi Nyaruhirira(国家实验室,卢旺达)。世卫组织BPPL-2024咨询小组发挥了关键作用,在咨询小组的技术会议和电话会议期间提供了技术审查和指导。此外,该小组参与了调查,以选择优先考虑的病原体初步清单,并审查技术概念、结果和最终报告。
•世卫组织还感谢许多合作伙伴、外部专家和观察员:Alessandro Cassini(瑞士沃州公共卫生部和洛桑大学医院)、Alejandro Dorado García(联合国粮食及农业组织)、Erin Duffy(美国CARB-X)、Elisabeth Erlacher-Vindel(世界动物卫生组织)、Christian Lienhardt(法国蒙彼利埃大学)、Pilar Garcia-Vello(黎巴嫩贝鲁特无国界医生组织)。特别感谢Mohsen Naghavi和Eve Wool(美国华盛顿大学全球健康系健康指标和评估研究所)提供了有关全球抗生素耐药性负担的宝贵数据。
•参加的世卫组织工作人员有:阿里·艾哈迈德·雅哈亚(世卫组织非洲区域办事处)、伊莉莎白·泰勒(世卫组织东地中海区域办事处)、皮拉尔·拉蒙·帕尔多(世卫组织美洲区域办事处)、萨斯基亚·安德烈·纳赫尔冈(世卫组织欧洲区域办事处)、斯蒂芬·乔斯特(世卫组织东南亚区域办事处)和西岛武(世卫组织西太平洋区域办事处)。总部的世卫组织工作人员有Benedikt Huttner、Daniel Marcano Zamora、Sergey Eremin和Sarah Paulin-Deschenaux(世卫组织总部,AMR部门)和Joao Toledo(世卫组织总部,卫生系统发展部)。
财政支持:奥地利政府、德国政府、沙特阿拉伯政府和欧洲委员会卫生应急准备和反应局为编写本报告慷慨提供了资金。
潜在利益冲突的评估和管理
利益冲突
根据本组织对世卫组织咨询小组的指导方针,潜在利益冲突的评估和管理是BPPL咨询小组整个审议过程中的优先事项。在BPPL咨询小组任职之前,要求所有成员和其他相关专家完成利益申报和保密协议,并提交简历供审查。PubMed和Google搜索结果被用于识别成员未声明的潜在利益冲突。世卫组织审查了所有发言,并就是否有任何发言可被视为参与利益冲突达成了共识。在分析了每份声明后,世卫组织得出结论认为,没有一个成员与BPPL有金融、商业或知识利益关系,也没有一个成员有重大的金融、商业或知识利益冲突,因而不能充分参与该集团。6个月的定期评估显示,大多数成员没有冲突。一名成员提交了一份不完整的申报,在再次尝试获取完整信息后,被排除在项目的进一步沟通和工作之外。
缩写
| ABR | antibiotic resistance, antibiotic-resistant | 抗生素抗性 |
| AMR | antimicrobial resistance | 抗生素耐药性 |
| BPPL | Bacterial Priority Pathogens List | 细菌优先病原体清单 |
| CRAB | carbapenem-resistant Acinetobacter baumannii | 耐碳青霉烯鲍曼不动杆菌 |
| CRE | carbapenem-resistant Enterobacterales | 耐碳青霉烯类肠杆菌 |
| CRPA | carbapenem-resistant Pseudomonas aeruginosa | 耐碳青霉烯铜绿假单胞菌 |
| DALY | disability-adjusted life year | 残疾调整生命年 |
| DR | drug-resistant | 耐药 |
| DS | drug-susceptible | 药物敏感 |
| 3GCRE | third-generation cephalosporin-resistant Enterobacterales | 第三代耐头孢菌素肠杆菌类 |
| GLASS | Global Antimicrobial Resistance and Use Surveillance System | 全球抗生素耐药性和使用监测系统 |
| IPC | infection prevention and control | 感染预防和控制 |
| LMIC | low- and middle-income countries | 低收入和中等收入国家 |
| MCDA | multi-criteria decision analysis | 多准则决策分析 |
| MDR | multidrug-resistant | 多重耐药 |
| MG | Mycoplasma genitalium | 生殖支原体 |
| MRSA | methicillin-resistant Staphylococcus aureus | 耐甲氧西林金黄色葡萄球菌 |
| NGS | next-generation sequencing | 下一代测序 |
| OC | outbreak capability score | 爆发能力得分 |
| PAPRIKA | potentially all-pairwise rankings of all possible alternatives | 所有可能的备选方案的潜在全部成对排序 |
| R&D | research and development | 研究与开发 |
| RR-TB | rifampicin-resistant tuberculosis | 耐利福平结核病 |
| TB | tuberculosis | 肺结核 |
| TP | transmission pathways score | 传播途径得分 |
| UI | uncertainty interval | 不确定区间 |
| YLD | years lived with disability | 劳力丧失的寿命年 |
行动纲要
抗生素耐药性是一个重大的全球公共卫生挑战,2019年估计有495万人死亡,在低收入和中等收入国家(LMIC)尤为严重。
解决人类卫生部门的抗微生物药物耐药性(AMR)问题需要全球在几个关键领域做出努力:强有力的感染预防和控制(IPC)措施,确保公平获得诊断和治疗,警惕性监测以发现AMR的新趋势,以及在研发(R&D)方面进行大量投资以创造新的药物、诊断和预防工具。
自2017年发布以来,世卫组织细菌优先病原体清单(BPPL)一直指导着R&D的投资,并为监测和控制抗菌耐药性的相关活动奠定了基础。尽管目前的工作,全球抗生素管线的特点是创新有限,全球获得新的和现有的治疗方法的机会有限。2024年BPPL建立在2017年清单的基础上,以应对当前的挑战,并为决策者、国家卫生当局和其他参与R&D和投资决策的人提供必要的指导。
2024年BPPL包括15个抗生素抗性(ABR)病原体家族,分为R&D和公共卫生措施的关键、高和中等优先级类别。
在这次更新中,对最后手段抗生素具有耐药性的革兰氏阴性菌(如鲍曼不动杆菌和肠杆菌目中的各种病原体)以及耐利福平(RR)结核分枝杆菌被列为关键优先细菌,因为它们具有转移耐药基因的能力、它们引起的感染和疾病的严重性和/或它们对全球造成的重大负担,特别是在LMIC。沙门氏菌和志贺氏菌被列为高度优先,反映出它们对现有治疗方法的耐药性日益增加,以及与这些病原体相关的高感染负担,特别是在LMIC。
2024年BPPL中其他高度优先的病原体是耐抗生素的铜绿假单胞菌和金黄色葡萄球菌,因为它们对全球构成威胁,特别是在医疗保健领域。高优先类别还包括对公共卫生构成独特挑战的病原体,如淋病奈瑟菌,其中出现了多药耐药菌株,限制了治疗选择。另一种对公共卫生具有重要意义的病原体是耐抗生素的屎肠球菌,这种细菌因其能够在整个同一健康范围内传播耐药元素而尤为重要。
2024年BPPL将A组和B组链球菌、肺炎链球菌和流感嗜血杆菌列入中等优先类别,表明迫切需要解决它们对公共卫生的影响,特别是在资源有限的情况下对弱势群体的影响。
BPPL是R&D年度部长级会议优先事项和投资以及公共卫生行动的指南针。虽然这一更新的BPPL是一个全球性工具,但其应用需要进行调整和语境化,以考虑到细菌病原体分布和生态的区域差异,以及弱势群体和AMR负担的变化。在不同的地理环境下,有必要采取适合不同地区的策略和干预措施来有效控制AMR(图1)。
图1.世卫组织细菌优先病原体清单2024年更新
| 关键组 | 高等组 | 中等组 |
| 耐碳青霉烯
| 伤寒沙门氏菌 对氟喹诺酮类药物耐药
| A组链球菌 抗大环内酯
|
| 肠杆菌属 第三代头孢菌素耐药
| 志贺氏菌属 氟喹诺酮类药物耐药
| 肺炎链球菌 抗大环内酯
|
| 类肠杆菌属 耐碳青霉烯
| 屎肠球菌 对万古霉素有耐药
| 流感嗜血杆菌 耐氨苄青霉素
|
 结核分枝杆菌,利福平耐药性患者a aRR-TB在采用平行标准的独立分析和随后应用自适应的MCDA矩阵后被纳入。 | 铜绿假单胞菌 耐碳青霉烯类药物
| B组链球菌 耐青霉素
|
| 非伤寒沙门氏菌 氟喹诺酮耐药
| ||
| 淋病奈瑟氏菌 第三代头孢菌素和/或氟喹诺酮耐药
| ||
| 金黄色酿脓葡萄球菌 耐甲氧西林
|
介绍
背景
AMR是对公共卫生和现代医学以及实现可持续发展目标的威胁。由ABR病原体引起的感染导致显著的全球疾病负担。2019年,估计有127万人死亡(95%置信区间= 0.911;1.71)归因于耐抗生素细菌,估计另有500万例相关死亡(95%置信区间= 3.62;6.57)(1)。ABR还对结束全球结核病流行构成了持续的挑战(2)。2017年,世卫组织开发了第一个BPPL,以引导对R&D新抗菌药物的投资(3)。最初优先考虑了25种ABR表型,但最终列表被精简为包括13种细菌病原体(表型)。根据优先级进一步分为三级:关键、高和中。耐多药结核病是世卫组织公共卫生的一个优先事项,也包括在报告中(3)。
自推出以来,BPPL已被用于分析管线中的抗菌药物,结果已在世卫组织年度报告中发表(4)。分析结果表明,世卫组织BPPL在引导抗菌药物和抗结核药物在R&D的投资方面发挥了重要作用(5)。在过去的7年里,抗生素开发管线向市场推出了9种针对2017年BPPL“关键”优先病原体的体外或体内活性新抗生素,尽管此后几乎所有抗生素都出现了耐药菌株(5,6)。此外,一种新的抗结核化合物pretomanid上市,并被世卫组织推荐在2022年作为治疗耐多药结核病和耐药结核病的新型6个月全口服方案的一部分进行给药(4,7)。
该清单已被证明是指导耐药监测、预防和控制的一个宝贵的公共卫生工具(如世卫组织全球抗生素耐药性和使用监测系统(GLASS))(8)。此外,它在制定特定领域的IPC指南方面发挥了关键作用,如《世卫组织卫生保健机构预防和控制耐碳青霉烯类革兰氏阴性菌指南》(9)。
尽管如此,世界仍在努力应对R&D抗菌药物管线的危机,主要原因是开发新抗生素的资金不足,以及全球获得新的和现有抗生素的机会有限(10)。
更新的理由
AMR是一种不断发展的威胁,对现有治疗的有效性提出了挑战。新抗菌药物的R&D没有跟上耐药性的快速发展,在适当解决患者未满足需求的能力方面存在巨大差距(5,11)。由于高质量数据的有限可用性,量化ABR的全球负担是复杂的,随着知识和证据的发展,持续评估是必要的(1)。2017年世卫组织BPPL报告承认全球数据缺口是一种限制,强调需要进一步研究和收集数据,以更好地了解ABR在特定背景下的程度(3)。
2017年的优先排序工作部分解决了R&D管线中抗菌药物的特定耐药模式、联合耐药和创新水平等方面的问题。(12)。本次更新的目的是解决其中一些限制因素,并吸取第一次BPPL演习的经验教训。此次更新利用了监测平台的最新进展,这些进展带来了更好的监测数据,包括来自资源有限环境的数据(8,13)。2022年,第一份经同行评审的全球ABR感染负担估计值公布,其中包括2019年多个国家和地区因多种病原体和病原体-药物组合导致的死亡和残疾调整寿命年(DALYs)(1)。这项研究以及其他新的数据来源,使人们对ABR的发展前景有了更全面的了解。本次更新还使用了世卫组织过去几十年收集的耐多药结核病水平数据(14)。
通过纳入这些新证据,《BPPL更新》阐述了急性呼吸道感染的演变以及近期全球事件(如2019冠状病毒病(COVID-19))对急性呼吸道感染的影响。它包括纠正最初工作中的局限性,找出差距并提出行动建议,以加快对耐药细菌的全球应对。
目标和范围
BPPL 2024的目的是指导资源分配,指导和促进新型抗菌剂的R&D,并支持制定预防、控制和治疗优先病原体引起的感染的有效策略。这一更新仅针对ABR细菌表型,这些表型存在最大的未满足需求,并导致最高、最显著的公共卫生负担。
更新的目的是通过增加新的证据和经验来保持世卫组织BPPL的相关性,确保它继续:
- 指导R&D开发新的有效抗生素疗法,根据临床和公共卫生需求调整投资;
- 促进国际协调,推动R&D开发创新、有效的抗菌剂和其他预防和控制工具,根据临床和公共卫生需求调整投资;
- 推动开发针对主要ABR病原体的替代性非药物和公共卫生干预措施;和
- 告知AMR监督和其他干预措施,如管理和IPC计划。
这一更新版本侧重于导致急性感染的细菌病原体,这些病原体对抗生素具有耐药性,并具有高死亡率和发病率风险,以及耐抗性结核病。
目标读者群
本文件的预期读者包括:
- 抗菌药物开发商,包括制药公司、中小型生物技术公司以及学术和公共研究机构;
- 研究资助者和公私合作伙伴在R&D投资新的抗微生物药物、疫苗、诊断和其他AMR预防和控制干预措施;
- 负责制定、调整、实施和监测人类卫生部门的AMR和IPC行动计划、政策和标准的国家和区域决策者,包括监督国家结核病控制规划的决策者;
- 传染病、AMR和细菌学领域的研究人员;和
- 全球决策者、医疗服务提供者、患者权益倡导者和公众。
方法
2017年世卫组织BPPL采用多标准决策分析(MCDA)方法开发(15)。MCDA是一种决策科学方法,它基于多种标准收集和评估备选方案,有助于在复杂选项中做出系统而透明的决策(16,17)。考虑到不同的目标和利益相关者的偏好,它被广泛应用于各个领域,以对备选方案进行优先排序。MCDA的一个好处是它能够通过结构化和定义的协议来确定备选方案和评估标准。此外,该方法将文献中的经验证据与专家见解相结合,通过为每个备选方案提供简洁而详细的沟通,包括排名、分类和偏好选择,确保全面的评估流程(16,17,18)。当数据有限、不一致或不明确时,这一点至关重要。专家带来了宝贵的见解,MCDA提供了一种将细微的主观判断系统地整合到决策中的方法(16,17)。
这种方法的另一个优势是它能够提供稳定的病原体排名,当发现新的证据或耐药性威胁时,可以定期更新(3)。表1列出了MCDA过程中的步骤。对于2024年BPPL更新,采用了与2017年类似的MCDA研究协议。该方案根据文献证据,根据八项标准评估了优先选择的病原体(3)。表2列出了MCDA的优先级标准及其定义和级别。附件1和附件2提供了所用方法的更多细节。
根据2024年BPPL研究方案,耐多药结核病最初是通过一种专门设计的方法和标准进行独立评估的,以适应结核病疾病的独特特征,包括其慢性病程、传播动态以及使用四种或四种以上药物治疗至少6个月的典型要求。表A4.2概述了用于RR-TB独立评估的标准及其定义。附件部分提供了评估方法和结果的更多详细信息。
在这项研究的后期,BPPL咨询小组要求应用用于评估其他病原体的MCDA方法和标准来进一步评估和优先考虑耐多药结核病。尽管全球PAPRIKA调查中未包括耐抗性结核病,但仍进行了这种事后分析,并认识到将急性细菌感染标准应用于耐抗性结核病评估的潜在挑战。咨询小组讨论了耐多药结核病MCDA评估的结果和局限性,虽然普遍认为评估结果可用于支持将耐多药结核病纳入BPPL的工作,但并未一致支持评估方法或某些评估标准的等级分配。因此,RR-TB的分组反映了所获得的集体证据,包括研究方案中定义的初始独立评估和MCDA。
……
1 PAPRIKA(potential All所有可能备选方案的所有成对排序)是一种稳健的决策方法,用于对所有可能的成对备选方案进行系统评估和排序,以确保进行全面的决策分析。该方法是在做出复杂决策时对不同方案进行比较和优先排序的一种结构化、全面的手段。
……
表1.多标准决策分析(MCDA)优先排序流程中的步骤(步骤重叠且无顺序)
 | 研究的概念化:制定研究方案,并组建世卫组织细菌优先病原体清单咨询小组(BPPL公司)a . |
 | 抗生素抗性细菌病原体的选择:确定优先考虑的细菌病原体。 |
 | 评估标准(属性)的细化和定义:定义和完善评估标准。 |
 | 证据审查:根据现有证据,建立标准水平并根据每个标准描述每种病原体。 |
 | 专家的身份:确定参与PAPRIKA制作的专家b 全球调查。 |
 | 进行PAPRIKA全球调查以确定标准重量:根据PAPRIKA法设计并开展一项全球调查,以确定每项标准的权重。 |
 | 根据标准评估病原体:根据MCDA矩阵中的每项标准评估每种病原体的性能。 |
 | 最终评分、排名和评估:进行最终评分和排名,并进行敏感性分析。 |
 | 最终名单:编制最终名单。 |
a BPPL咨询小组是在公开征集申请后成立的,共收到并审查了120份申请。然后挑选专家以确保所有6个世卫组织区域的地域、学科和性别平衡,最终选出23名专家。
b PAPRIKA(所有可能的备选方案的所有成对排序)是一种稳健的决策方法,用于对所有可能的成对备选方案进行系统评估和排序,以确保全面的决策分析。该方法是在做出复杂决策时对不同方案进行比较和优先排序的一种结构化、全面的手段。
表2.优先标准、定义和级别
| 标准 | 定义 | 记分系统。 | 调查得分* |
| 死亡率 | 病死率(由抗生素耐耐药病原体引起的感染患者的全因死亡率综合流行率(%)) | >30% | 高 |
| 21–30% | 中高 | ||
| 11–20% | 中 | ||
| 5–10% | 中低 | ||
| < 5% | 低 | ||
| 发生率 | 全球每100万人口的病例发病率(所有年龄、所有性别,都与耐药性有关) | 每100万人口中有>10000例 | 高 |
| 每100万人口中有5001–10000病例 | 中高 | ||
| 每100万人口中有1001-5000例 | 中 | ||
| 每100万人口中有100-1000例 | 中低 | ||
| 每100万人口中有<100例 | 低 | ||
| 非致命健康负担 | 每百万居民,包括所有年龄和所有性别的残疾生活年限(YLDs),可归因于每种耐药病原体的感染 | 每100万人口中有>1.5个收益 | 高 |
| 每100万人口有1.1-1.5 YLD | 中高 | ||
| 每100万人口中有0.51-1个收益 | 中 | ||
| 每100万人口有0.11-0.5 YLD | 中低 | ||
| 每100万人口中有<0.1个收益 | 低 | ||
| 耐药趋势 | 耐药率数据的10年趋势,其中耐药率定义为耐药菌株占被检测菌株总数的百分比 | 在≥3个世卫组织区域(或在大多数有数据的区域)增加趋势 | 5级 |
| 在世卫组织的2个区域增长趋势 | 四级 | ||
| 在世卫组织的一个区域增长趋势 | 3级 | ||
| 在世界卫生组织所有地区保持稳定 | 2级 | ||
| 至少在一个世卫组织区域有显著下降的趋势,而在其他任何区域都没有增加 | 一级 | ||
| 传播性 | 抗菌素耐药性病原体在不同途径之间传播的证据。考虑了两个不同的领域:人与人之间的传播:卫生保健/社区环境中的爆发能力:人与动物、食物和环境室之间的传播 | 记录良好的(原币)和高(TP) | 高 |
| 记录良好的(原币)和中度(TP) | 中高 | ||
| 中等记录(原币)和高(TP) | |||
| 记录不足(原币)和高(TP) | 中 | ||
| 记录良好的(原币)和低的(TP) | |||
| 中度记录(原币)和中度(TP) | |||
| 中度记录(原币)和低记录(TP) | 中低 | ||
| 记录不足(原币)和中度(TP) | |||
| 记录不足(原币)和低(TP) | 低 | ||
| 在卫生保健环境和社区中的优势 | 在遏制目标抗菌素耐药性病原体的传播和减少疾病负担方面所采取的预防措施的存在和有效性。该标准包括可预防性的两个不同方面:
2.以社区为基础的感染预防控制措施,包括接种疫苗、水卫生、获得保健服务和食品安全。 | 工业程序控制( industrial process control的缩写)措施:
| >5分:高 |
非殖民化/化学预防:
| 5分:中高 | ||
| 四分:中等 | |||
社区中的公共卫生干预措施:
| 3分:中低 | ||
| <3分:低 | |||
| 能治疗性 | 循证指南推荐的第一行选项的数量:
| > 12分:高 | |
一线方案报告的伴随耐药性:
| 10-11分:中高 | ||
最典型的感染综合征的替代选择:
| 8-9分:中等 | ||
配方:
| 6-7分:中低 | ||
可获得性(成本)
| <5分:低 | ||
| 产品线 | 该标准评估了目前和未来5-7年的抗菌管线在多大程度上能够有效地满足治疗每种耐药细菌病原体的临床需求。该标准考虑了过去5-7年内新批准的抗生素的数量,以及临床开发管线中符合世卫组织创新标准的候选抗生素的数量,如新的化学类别、新的靶点和没有交叉耐药性。此外,它还评估了新的候选药物和正在开发的药物的口服配方的可用性 | 不太可能: 根据世卫组织2017-2021年的临床管线分析,该病原体没有或在X期的潜在活性候选药物数量非常有限。病原体没有或数量非常有限的候选药物正在进行市场授权申请MAA和/或新药申请NDA。从2017年七月到2022年,新批准的抗生素没有或数量非常有限。 | < 34分:不太可能 |
| 可能的: 根据世卫组织2017-2021年的临床管线分析,该病原体有一个或多个潜在的活性候选阶段。病原体有一个或多个候选药物,且正在进行市场授权申请MAA和/或新药申请NDA。2017年七月至2022年,一种或多种新批准的抗生素。 | 47-34分:可能 | ||
| 可能的: 根据世卫组织2017-2021年的临床管线分析,该病原体有一个强大的管线,在X期有多个潜在的活性候选者。病原体有多个候选药物,且正在进行市场授权申请MAA和/或新药申请NDA。2017年七月至2022年,几种新批准的抗生素。 注:为该标准创建了一个评分矩阵,详见附件以供参考。 | 47分:可能 |
IPC:感染预防和控制;OC:爆发能力;OPAT:门诊胃肠外抗生素;TP:传播潜力(人与动物、食物和环境之间);YLDs:残疾生活年数。
a高成本抗生素被定义为以报告的稀缺或短缺为特征的抗生素制剂,以及自2017年以来进入市场的新推出的制剂。
b低成本抗生素是指不符合上述标准的非专利抗菌药物。
注意:对于2017-2021年世卫组织临床管线分析中未包括的病原体,使用了文献中可用的数据。如果在公共领域或世卫组织分析报告中没有可用的数据,该病原体被评分为在阶段中没有产品。
确定优先考虑的病原体的初步清单
在此次更新中,基于证据和专家共识,2017年版本中包含的五种病原体-抗生素组合被删除:耐克拉霉素的幽门螺杆菌,耐氟喹诺酮的弯曲杆菌属、青霉素不敏感的肺炎链球菌、第三代头孢菌素耐药的普罗维登斯菌属和耐万古霉素的金黄色葡萄球菌。
增加了四种新组合:耐大环内酯A组链球菌、耐青霉素B组链球菌、耐大环内酯肺炎链球菌和RR-TB。最后,23种抗生素-细菌表型组合被纳入BPPL-2024。图2比较了2017年和2024年BPPLs中优先病原体的排名。排名确定后,按家族和顺序排列组合,最终名单中出现了15种“drug–bug”组合(见附件2)。
标准权重的确定:2023年全球PAPRIKA调查
根据目前的证据,根据八个定义的标准(属性)描述和评估病原体-抗生素组合(优先标准、定义和水平见表2)。评价标准的权重根据PAPRIKA法确定,采用参与式盲法调查1000分钟软件(19)。共有来自所有六个世卫组织地区的79名专家参加了调查,代表了从最初邀请100名专家到80%的回应率。挑选参与者是为了确保不同的地域、性别和专业知识。参与者根据他们的专业知识对一系列简单的问题做出主观回答。他们一次专注于两种病原体的两个标准或属性,在保持其他标准不变的同时进行权衡。盲法技术被用于减少偏差和提高可靠性。(注:由于耐多药结核病是独立评估的,因此不包括在全球调查中)。全球PAPRIKA调查的结果是分配标准权重的基础。参与者之间有很强的一致性,Spearman等级相关系数2为0.9,Kendall和谐系数(W)3为0.9(见图3)。
ABR感染的可治疗性和致命负担的标准,被专家们赋予了最高的权重,表明了有效治疗在解决这些感染中的重要性。鉴于抗生素治疗高负荷DR病原体(如MDR革兰氏阴性菌)的有效选择很少,这一点尤其重要。
权重还强调了在针对高负荷、耐药病原体的新药开发和目标投资方面采取重点方法的必要性。AMR趋势标准也很重要,反映了专家们认识到监测在监测AMR传播模式和负担方面的关键作用。健全的AMR监测系统对于监测重点DR病原体和了解影响AMR发展的因素至关重要。
专家们对发病率、非致命疾病负担、传染性和可预防性标准给予了同等重视,强调了它们在新抗生素R&D决策中的关键作用。理解这些属性的相互联系至关重要,因为某些病原体可能需要投资新的抗生素和公共卫生干预措施。这些标准的可比权重强调了它们在指导R&D决策过程中的集体重要性。
尽管管线标准的权重低于其他标准,但与2017年相比,MCDA更加重视管线标准。专家们强调了投资新抗生素开发作为全面战略一部分的重要性,承认在应对重点病原体方面进展有限,创新势在必行。世卫组织最近的管线评估称抗菌管线不足,强调迫切需要增加在R&D的投资(4)。附件2和3显示了根据八项标准对每种病原体-抗生素组合的评估。
……
2 Spearman等级相关系数:这种统计方法用于评估两个等级变量之间的关联强度和方向。范围从–1到1,其中1表示完全正关联,–1表示完全负关联,0表示无关联。
3肯德尔一致系数(W):该指标用于评估几个评分者或评委在对几个项目进行排序时的一致程度。范围从0到1,其中1表示所有评分者完全一致,0表示没有超出预期的一致。
……
图2.与2017年BPPL相比,2024年BPPL更新中优先考虑的病原体
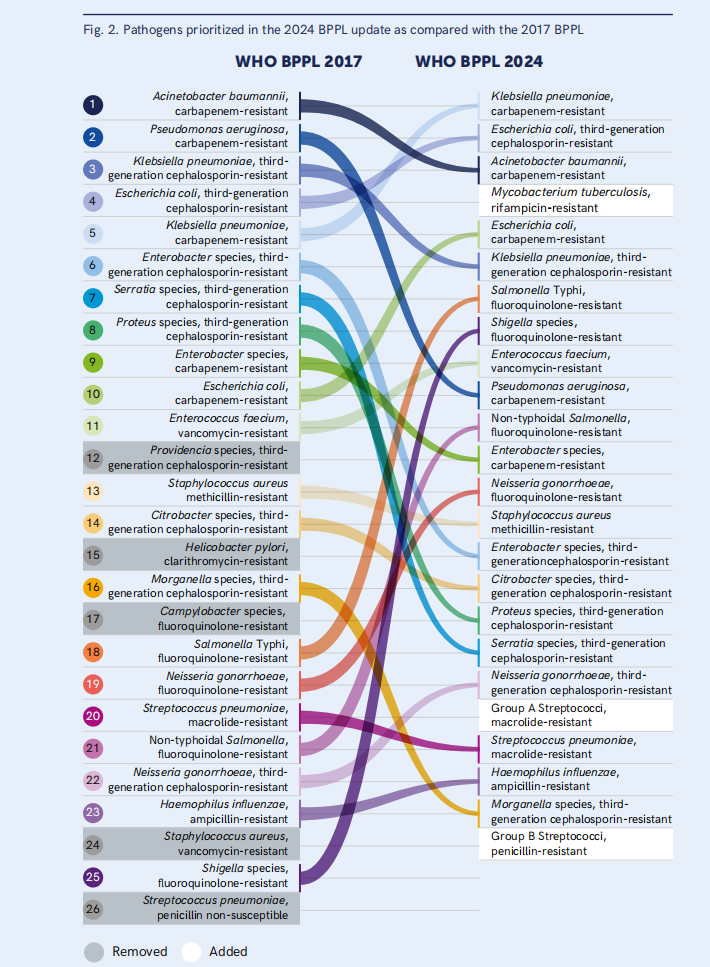
图3.综合标准权重(来自全球PAPRIKA调查的结果)
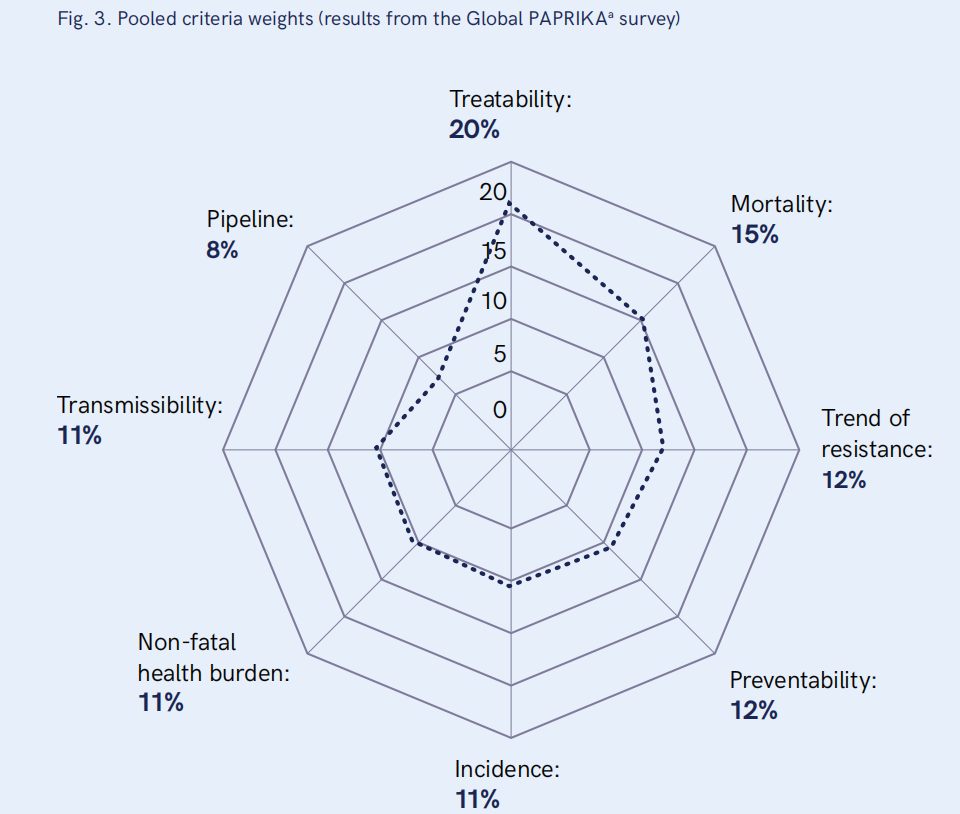
斯皮尔曼等级相关= 0.9肯德尔的W = 0.871
PAPRIKA(所有可能的备选方案的所有成对排序)是一种稳健的决策方法,用于对所有可能的成对备选方案进行系统评估和排序,以确保全面的决策分析。该方法是在做出复杂决策时对不同方案进行比较和优先排序的一种结构化、全面的手段。
此外,尽管与其他标准相比,抗生素管线标准的权重相对较低,但其权重高于2017年。这突出表明专家们认识到投资开发新抗生素作为综合方法的一部分的重要性。这一转变可能表明,专家们越来越认识到,在开发对抗重点病原体的新药方面进展有限。2023年,世卫组织合著的一份报告将管线的状态描述为停滞和缺乏创新(10)。这突出表明,迫切需要在R&D投资以解决这一关键缺口,并确保获得新的有效疗法。
附件2、3中概述了结果摘要以及根据标准评估病原体的方法。
对耐药结核病的独立评估
采用量身定制的方法对耐多药结核病进行独立评估。使用的所有标准都是针对耐RR- TB定制的,以确认获得空气传播、获得诊断、可治疗性和非致命健康负担的影响。DRM.结核病传染性很强,可以通过呼出的空气传播。飞沫可能会在空气中停留几个小时,并在被他人吸入时传播感染。这种传播方式可导致他人因吸入而受到感染,从而导致约四分之一的世界人口感染或携带潜伏性结核病。非致命性结核病的负担是另一个关键标准。RR-TB负责693万(95%不确定区间[UI]:5.52;8.53)2020年残疾调整生命年(DALYs),其中大部分(596万DALYs,95% UI:4.63;7.42)发生在耐多药和耐多药结核病负担最重的30个国家。虽然大多数残疾调整寿命年可归因于治疗期间的发病率和死亡率,但结核病通常导致幸存者的长期发病率。评估中包括了一项诊断标准,因为在全球范围内对耐多药结核病的诊断存在重大差距。2021年,只有63%的确诊肺结核患者得到了细菌学确认,其中只有70%的患者接受了利福平耐药性检测。
附件4提供了对耐多药结核病独立评估的详细描述和结果。
MCDA在耐药结核病中的应用
在这项研究的后期,BPPL咨询小组要求应用用于评估其他病原体的MCDA标准来评估和优先考虑耐多药结核病,并承认其局限性。虽然MCDA的大部分属性可以直接应用于评估抗耐药结核,但需要进行一些调整,以说明抗耐药结核的慢性性质、其在社区中通过空气的传播以及该疾病需要用四种或更多种药物联合治疗至少6个月的事实。关于耐多药结核病疾病负担和趋势的大部分数据由世卫组织从其监测项目中提供,并且使用了报告而不是系统的文献综述(14,20)。
RR-TB的管线评分也进行了调整,以包括一些因素,如使用包含至少三种或四种药物的组合疗法,以及口服组合已经是RR-TB管理中标准护理的一部分。
在方案规定的时间内,根据世卫组织批准的已公布的世卫组织治疗指南和建议,评估了耐多药结核病的可治疗性标准(21)。虽然世卫组织建议将单一多药方案作为耐RR-TB的一线治疗,但人们认识到,在特定情况下也可使用替代组合并建议使用。
总体而言,由于结核病的独特特征以及该标准是为评估急性细菌感染而设计的这一事实,MCDA很难适应抗耐药结核病。
附件2和附件3概述了根据MCDA标准评估病原体的方法和结果。
结果:世卫组织细菌优先致病菌名单,2024
使用上述方法,鉴定、评估了24种细菌病原体-药物组合,并根据评估结果进行了排序。然后将细菌病原体分为三个优先组(见表A4.2,其中包括病原体的得分)。框1提供了2024年BPPL优先类别的操作定义。
方框1.2024年世卫组织BPPL中优先类别的操作定义
| 关键组 | 由于治疗选择有限、高疾病负担高(死亡率和发病率)和可用比特率(ABR: available bit-rate的缩写)的上升趋势,ABR细菌性病原体对公共卫生构成最高威胁,很少或没有有希望的候选药物。关键类别的病原体感染也可能是唯一难以预防的,而且具有高度传染性;这些病原体可能在某些人群或地理区域具有全球耐药性和/或minimum daily requirement 日最低需要量菌株机制。 |
| 高等组 | 可用比特率(ABR: available bit-rate的缩写)细菌性病原体非常难以治疗,造成重大疾病负担(死亡率和发病率),显示出耐药性的上升趋势,特别难以预防,传染性高,正在开发中的潜在治疗方法很少。虽然它们在全球范围内可能不是至关重要的,但这类病原体对某些种群和特定地理区域可能是至关重要。 |
| 中等组 | 可用比特率(ABR: available bit-rate的缩写)细菌病原体与中等疾病负担(死亡率和发病率)和中等耐药性趋势的相关性,在预防性或传播性方面存在独特的问题,相对更多的治疗候选者正在进行中。同样,虽然它们在全球范围内可能并不重要,但这类病原体对某些种群和特定地理区域可能至关重要。 |
图4.2024年世卫组织细菌优先病原体清单
| 关键组 | 高等组 | 中间群 |
| 肠杆菌 耐碳青霉烯 | 伤寒沙门氏杆菌 氟喹诺酮耐药 | A组链球菌 抗大环内酯 |
| 肠杆菌 第三代头孢菌素耐药性 | 志贺氏菌属 氟喹诺酮耐药 | 肺炎链球菌 |
| 鲍氏不动杆菌 耐碳青霉烯 | 屎肠球菌 万古霉素耐药 | 流感嗜血杆菌 |
| 结核分枝杆菌,利福平耐药性患者a 耐多药结核病在采用平行标准的独立分析和随后应用自适应的MCDA矩阵后被纳入。 | 铜绿假单胞菌 耐碳青霉烯 | B组链球菌 耐青霉素 |
| 非伤寒沙门氏菌 氟喹诺酮耐药 | ||
| 淋病奈瑟氏菌 第三代头孢菌素和/或氟喹诺酮耐药 | ||
| 金黄色酿脓葡萄球菌 耐甲氧西林 |
结果
革兰氏阴性细菌病原体:持续的关键优先事项
在这次更新的BPPL中,革兰氏阴性细菌病原体保持其危急状态。耐碳青霉烯类鲍曼不动杆菌(CRAB)、耐碳青霉烯类肠杆菌属(CRE)和耐第三代头孢菌素类肠杆菌属(3GCRE)得分最高,证实它们被列入2024年BPPL的关键优先类别。
由于其毒性、耐药性和有限的治疗选择,耐碳青霉烯类鲍曼不动杆菌的出现和持续存在对全球构成了严峻的挑战,导致严重的医院感染(尤其是在重症监护患者中)和惊人的高死亡率(1,22)。就由抗生素抗性感染引起的归因死亡率而言,耐碳青霉烯类鲍曼不动杆菌是全球五大病原体之一,并且估计是东南亚、东亚和大洋洲由ABR引起的死亡率的主要病原体(1,23,24)。尽管形势紧迫,但抗生素开发在应对这一挑战方面一直滞后。自2017年BPPL将耐碳青霉烯类鲍曼不动杆菌列为关键病原体以来,尚未推出有效对抗产金属β-内酰胺酶耐碳青霉烯类鲍曼不动杆菌菌株的新药,这凸显了R&D持续面临的挑战和持续投资的迫切需要(4,5)。
就新抗生素的R&D需求而言,CRE和3GCRE继续在BPPL排名中名列前茅。由于其广泛的流行性和耐药性,这些病原体在所有耐多药革兰氏阴性菌中造成的负担估计最高(1,23,24)。
CRE细菌引起各种感染综合征,包括血流、呼吸道、腹内和尿路感染。这些感染在全球范围内造成了巨大的负担,治疗选择有限,主要是由于ABR的高发生率(1,25)。CRE的爆发很复杂,造成了巨大的经济负担,进一步突出了预防和控制的迫切需要,包括创新的治疗方案,以应对这些病原体造成的感染负担(26,27,28)。
本次更新引入了一个不同的3GCRE分类,以强调需要有针对性的政策和干预来应对这一新出现的威胁。产超广谱β-内酰胺酶肠杆菌的高估计负担,特别是在LMIC和弱势人群中,导致高治疗失败率和医疗费用增加(1,26,27)。将与3GCRE(大肠杆菌)相关的血流感染列为第一个联合国可持续发展目标(AMR指标3.d.2)的一部分,突显了其重大负担(29)。这种情况对儿科人群尤其令人担忧,在这些人群中,产生超广谱β-内酰胺酶的肺炎克雷伯菌等肠杆菌科细菌感染使一线抗生素治疗复杂化。在新生儿败血症病例中,第三代头孢菌素耐药菌的流行率上升与发病率和死亡率增加有关,特别是在LMIC(30)。获得负担得起的抗生素的机会有限、资源限制、感染控制不足和抗菌药物使用率高导致全球3GCRE和CRE负担加重,导致发病率、死亡率和成本增加(1)。
在2024年更新中,耐碳青霉烯类铜绿假单胞菌(CRPA)已从“关键”优先级移至“高”优先级。这种变化部分是由于我们的研究结果表明,至少在一个世卫组织地区发现了全球抗药性的潜在下降。一个世卫组织地区的耐药趋势明显下降,与其他耐碳青霉烯菌株相比,传播能力相对较低,这些都是导致排名调整的因素。这一发现与AMR全球疾病负担研究的估计一致(1)。尽管发生了这种转变,鉴于在高收入国家和某些地区(如中东欧和中亚)的重大负担,对CRPA而言,在R&D的投资仍然至关重要(1,23,24)。重要的是,免疫功能低下的个人和卫生保健机构中CRPA的高致命性负担表明,仍然需要创新的R&D方法来应对CRPA对卫生保健的影响。
耐药结核病:一种重要的耐多药耐药病原体
在这次更新中,耐多药结核病被列为关键优先事项。在诊断、治疗、临床管理和整体公共卫生应对方面,耐多药结核病给那些对药物敏感的结核病带来了巨大的额外挑战。在世界范围内,检测利福平和大多数抗结核药物耐药性的能力仍然非常有限(14)。耐药结核病的治疗方案比耐药结核病的治疗方案贵几个数量级,毒性也更大,导致治疗完成前患者失访率高,治愈率低。虽然新的和最近推荐的治疗方案可能会改善这种情况,但对新型核心药物(如贝达奎林)的耐药性已经出现,对贝达奎林耐药结核病的治疗选择也受到严重限制。此外,耐多药结核病患者的经济影响巨大,82%的受影响家庭面临灾难性的总成本4(14)。
耐甲氧西林的金黄色葡萄球菌(MRSA)仍然是重中之重
MRSA保持其在BPPL高优先级病原体类别中的地位,与其高估计负担一致(1)。这可归因于各种因素,包括耐甲氧西林金黄色葡萄球菌负担的地区差异以及对R&D规划和有针对性的感染预防和控制(IPC)措施的投资,包括在高收入国家,在那里它是最流行的DR病原体之一。耐甲氧西林金黄色葡萄球菌继续对全球造成重大负担。它已被确定为全球卫生保健相关和社区获得性感染的主要原因之一(24,25)。全球疾病负担研究报告称,在高收入国家,大约50%的AMR致死负担与两种病原体有关:金黄色葡萄球菌和大肠杆菌(1)。由耐甲氧西林金黄色葡萄球菌引起的发病率、死亡率和医疗保健成本不容低估,由于其持续流行和潜在的严重感染,它仍然是一个主要问题。为了应对MRSA带来的挑战,有必要采取综合方法,将对R&D的持续投资、加强感染预防和控制、管理规划和全球监测结合起来(31)。
其他高度优先的社区病原体
更新后的世卫组织·BPPL排名反映出对“社区”病原体的认知度显著提高,表明它们对治疗的抵抗力越来越强,并造成了巨大负担,特别是在LMIC。社区病原体优先级的提高对公共卫生和R&D具有重要意义,并反映出人们对这些病原体及其抗生素耐药性的日益担忧。
例如,在社区病原体中,对氟喹诺酮耐药的伤寒沙门氏菌被列为高度优先病原体,在本次更新中,它被列为高度优先病原体。伤寒沙门氏菌是伤寒的主要原因,伤寒是一个重大的全球公共卫生问题。每年估计有1000万病例和大约116,800人死于伤寒(32)。AMR的出现对其治疗提出了严峻的挑战。由于耐药性和严重的副作用,氨苄西林、氯霉素和甲氧苄啶-磺胺甲恶唑等旧的治疗选择已基本被氟喹诺酮类药物(和第三代头孢菌素)取代(33)。然而,人们对氟喹诺酮类药物的有效性产生了担忧,因为最近的报告显示,在许多地区,氟喹诺酮类药物的耐药性不断增加,而敏感性却有所降低(34)。gyrA、gyrB、parC和parE等基因的遗传突变以及质粒介导的喹诺酮耐药基因导致伤寒沙门菌对氟喹诺酮耐药(35,36)。不同地区伤寒沙门氏菌菌株的遗传多样性影响耐药模式,并可能使经验治疗进一步复杂化(37)。此外,多药耐药和广泛耐药的伤寒沙门氏菌株在世界范围内日益流行(37)。对阿奇霉素等新型抗生素耐药性的上升,以及亚洲等伤寒沙门氏菌疫情在高流行地区的广泛爆发,以及潜在的区域传播,是令人担忧的其他原因(38)。伤寒主要影响难以获得充足水、环境卫生和个人卫生基础设施的贫困社区(38)。高人口密度、次优的医疗基础设施和广泛的抗菌药物使用,加上滥用和管理不力,导致了耐药性的出现(38)。
耐氟喹诺酮的非伤寒沙门氏菌在整体排名中也有所上升,并被列入高优先级类别。非伤寒沙门氏菌引起胃肠炎,是全球食源性细菌性腹泻的主要原因之一,与伤寒不同,伤寒仍然是地方病,大多在资源匮乏的环境中流行(39)。尽管在临床表现和疾病负担方面与伤寒沙门氏菌不同,但耐氟喹诺酮的非伤寒沙门氏菌因其耐药性而成为全球关注的主要问题(40)。氟喹诺酮类耐药非伤寒沙门氏菌通过促进耐药基因的流行直接增加伤寒沙门氏菌的耐药性。共享基因增加了耐药性转移的风险,损害了氟喹诺酮治疗伤寒的有效性。非伤寒沙门氏菌中的ABR主要是由畜牧业中抗生素的使用引起的。感染的监测、预防和控制对于限制这些相关病原体的耐药性传播至关重要(41)。
……
4定义为直接医疗支出、非医疗支出和收入损失合计超过家庭收入的20%。
……
耐氟喹诺酮志贺菌属是在BPPL 2024更新中整体排名较高的其他值得注意的社区病原体,优先级从“中”升至“高”。志贺氏菌病是所有年龄组腹泻死亡的第二大常见原因,并与所有年龄组腹泻的高负担有关(42)。福氏志贺氏菌和桑内氏菌是两种最常见的细菌,导致肠胃感染的细菌。两者都主要通过粪-口途径传播,并且两者的ABR都在增加,包括对氟喹诺酮类药物的耐药性(43,44)福氏链球菌在卫生条件不足的发展中国家流行,主要在儿童中引起严重疾病,而宋内链球菌在发达国家更常见,影响老年人且症状较轻(43)。这些菌包括记录在案的多药耐药菌株,包括一些对氟喹诺酮类药物耐药的菌株(42,43)。大量研究和报告证明,在男男性行为者中,主要是在城市地区和特定社区环境中,多药耐药志贺氏菌菌株引起的疫情显著上升(45,46)。这些令人担忧的报告表明了AMR趋势的转变。
多重耐药(MDR)淋病(包括耐氟喹诺酮和第三代头孢菌素的菌株)也仍然属于高度优先类别。淋病的病原体淋病奈瑟菌构成了特别的威胁,因为其负担重、传播性强、无症状疾病以及相关的污名化和其他结构性护理障碍(47,48)。虽然淋病奈瑟氏球菌感染通常不致命,但它对发病率的影响是巨大的,会导致后遗症,如盆腔炎、不孕症、慢性骨盆疼痛和女性宫外孕以及男性附睾炎(46)。此外,淋病奈瑟菌感染率的增加与获得和传播包括艾滋病毒在内的其他性传播感染的风险增加有关(47,49)。由于以前推荐的抗生素的有效性正在下降,MDR菌株在世界范围内的出现对目前推荐的联合治疗提出了严峻的挑战(50,51)。
高风险类别中还包括屎肠球菌,这是一种常见于人类和动物胃肠道的细菌。尽管共生菌通常是良性的,但它表现出一系列严重的机会性感染,如心内膜炎、菌血症和尿路感染,特别是在免疫功能低下或医学上脆弱的个体中。值得注意的是,粪肠球菌对抗生素(尤其是万古霉素)产生耐药性的倾向令人担忧,这给医疗机构带来了重大挑战。质粒介导的VanA和VanB基因复合物是产生高水平万古霉素耐药性的原因。由于克隆群17(CC17)基因群的出现,万古霉素耐药屎肠杆菌的激增,强调了其作为一种在医疗保健环境中与耐药感染相关的有问题的医院病原体的新兴地位。对其流行病学、毒力因子、耐药机制和跨物种传播动力学的全面了解对于设计针对该病原体的有效管理和感染控制策略是必不可少的(52)。
其他优先病原体
抗生素-病原体组合的更新列表还包括其他三种值得注意的新增成分:耐大环内酯A组链球菌、耐青霉素B组链球菌和耐大环内酯肺炎链球菌。这些病原体特别令人关切,因为它们与高疾病负担相关,特别是在弱势群体和LMIC。这些微生物和名单上其他微生物的耐药性的出现对有效治疗和控制感染构成了重大挑战,因此有必要进行持续的监测、研究和有针对性的干预。例如,肺炎是一个重大的全球性挑战,每年导致超过300万人死亡,其中肺炎链球菌是主要原因(53)。包括儿童和老人在内的弱势群体首当其冲。据估计,每年有超过300,000名5岁以下儿童死于肺炎球菌肺炎感染,其中大多数死亡发生在发展中国家(54)。肺炎链球菌抗生素耐药性的出现使治疗策略变得复杂,进一步加大了抗击肺炎影响的挑战(55,56)。尽管几十年前就有针对肺炎链球菌的有效疫苗,但覆盖范围在不同地区仍有差异,并且存在显著的地区差异(例如,世卫组织欧洲地区83%的儿童得到了覆盖,相比之下,世卫组织西太平洋地区只有23%)。世卫组织估计,全球40%的5岁以下儿童没有被覆盖(57)。
限制
这项优先研究有一些局限性,部分原因是抗菌药物耐药性的复杂性和所考虑的病原体的多样性。数据缺口,尤其是在缺乏强有力的监测系统的地区,影响了针对死亡率、发病率、非致命负担和耐药性趋势标准对病原体的评估。例如,对于几乎所有病原体,致命负荷评估都依赖于系统综述的汇总数据,固有地受制于出版物、“地理”和语言偏见(仅考虑英文出版物)。此外,没有更新的系统审查来为大多数社区获得性病原体的评估提供信息,如伤寒沙门氏菌、非伤寒沙门氏菌、志贺氏菌、A组链球菌、肺炎链球菌和淋病奈瑟菌,因此必须依赖来自2017年BPPL数据和2019年GBD AMR研究等来源的死亡率估计。由于依赖于公开可用的监测数据,类似的限制可能已经影响了AMR趋势分析的评估,这些数据大多仅包括侵入性分离株,并且可能忽略了数据可用性的最近发展或区域变化。
对可治疗性、可预防性、可传播性和管线的标准分析是基于对现有证据的定性评估。尽管MCDA方法能够说明定性和定量数据,并且通过专家讨论和咨询努力减轻这些固有的弱点,但一些确认偏差可能仍然影响了根据这些定性标准对一些病原体的评估。对于所有病原体,可治疗性标准主要依赖于世卫组织和其他公布的指南。对于耐药结核,可治疗性的评估完全依赖于世卫组织指南,没有考虑到国家治疗指南中反映的耐药结核替代疗法。这种狭隘的关注点可能会因为忽略了抗耐药结核病的替代疗法而导致评估结果出现偏差。传播性评估忽略了传播途径中的重要细微差别,特别是对于空气传播的病原体,如脑膜炎双球菌。结核病和社区传播的病原体,如志贺氏菌和沙门氏菌。根据可预防标准对病原体进行的评估不包括采取预防措施的可行性,特别是在国家/地方一级加强IPC。相反,它只关注基于文献数据的这些措施的存在和有效性。最后,在评估管线的充分性时,没有考虑联合治疗,特别是与治疗耐药结核相关的联合治疗。尽管在MCDA评估中对RR-TB应用了一个校正因子来解决这一问题,但对需要多种药物治疗的其他病原体缺乏类似的调整可能影响了这些病原体的管线评分。
实施和政策考虑
世卫组织BPPL是一个全球工具,用于识别由于AMR而引起国际关注的优先细菌病原体。然而,重要的是要认识到,在细菌病原体的分布、生态和AMR方面存在着实质性的区域和地方差异。区域和地方环境决定了细菌性传染病的负担和AMR的动态。针对耐药细菌病原体的疾病负担只能通过对单个地区进行分层和定制来有效解决。这种方法也有助于防止误解清单的全球意义。
重要的是,这个更新的BPPL并不详尽,虽然更新包括几种新出现的ABR病原体,但并没有涵盖所有病原体。未列入这些病原体并不降低它们的重要性,有些可能需要优先考虑,这取决于它们的区域或国家背景和流行病学。例如,生殖支原体(MG),一种对常规治疗具有越来越多耐药性的性传播病原体,不包括在2024年BPPL中。特别值得关注的是其对大环内酯类抗生素的耐药性日益增加,因此有必要采用联合治疗来有效控制感染并减少进一步耐药的出现。有限的诊断途径和能力加剧了这一挑战,导致在许多情况下需要对综合征(经验)患者进行管理(58,59)。
此外,虽然我们在分析中考虑了耐药机制的变化,但它们并没有直接反映在最终列表中,尽管它们对R&D和公共卫生的优先顺序有重要影响。例如,CRE中各种耐药机制的流行病学和治疗效果存在显著差异。产金属β-内酰胺酶的肠杆菌特别难以治疗,因为治疗选择有限,患者管理难度和成本更大,而对其他细菌,如超广谱β-内酰胺酶,则有相对更有效和更经济的治疗选择(60,61)。尽管有这些区别,所有的耐药机制都包括在CRE的保护伞下。这些问题值得在未来的清单中予以关注。
通过新药的创新和R&D解决细菌优先病原体
为了对抗因ABR而难以治疗的感染,在R&D进行足够的投资是至关重要的,通过有针对性的方法来解决最紧迫的临床需求,同时保持广谱和窄谱新疗法之间的平衡,因为这两种方法在解决ABR方面都有价值。对于清单上的一些病原体,R&D可能会针对专门解决最具挑战性的耐药机制的新药。例如,在耐碳青霉烯类鲍曼不动杆菌的例子中,由于产生氧杂型β-内酰胺酶,耐碳青霉烯类鲍曼不动杆菌通常具有耐药性,R&D应该专注于开发针对这种酶的新的小分子,让碳青霉烯类重新发挥作用。同样,对于CRPA和CRE,它们经常分别通过金属β-内酰胺酶和奥沙林酶型β-内酰胺酶获得耐药性,应探索针对这些耐药机制的新药。耐多药结核病也是如此。虽然新的6个月治疗方案代表了相对于以前的RR-TB治疗方案的实质性进步,但对某些成分药物的耐药性已经出现,不符合新的6个月治疗方案的患者的选择非常有限(7)。因此,开发作用机制不同于现有药物的新化合物是至关重要的。然而,由于结核病的独特特性,开发有效抗耐药结核病的新药非常困难。由于有效的结核病管理需要用几种药物进行长期治疗,通常至少要用四种药物,因此新药的开发并不会自动带来新的治疗方法。此外,在一些患者中,长期治疗更有可能出现副作用和失去随访或不完善的依从性,这可能导致在治疗期间产生新的耐药性。完成治疗后,必须对患者进行12-18个月的随访,以确保任何新的治疗方案都不会导致复发。所有这些因素的结合给设计新的结核病治疗方法和长期、昂贵的随机对照试验带来了特殊的挑战。2023年,世卫组织发布了结核病治疗的目标方案概况,以指导优先事项并描述设计新的结核病治疗方案时的权衡(62)。
针对R&D的以疾病为重点的方法(也称为综合征方法)可能对一些高负荷社区病原体如沙门氏菌、志贺氏菌和淋病奈瑟氏菌很有效。这种方法不是一次针对一种耐药菌株,而是专注于它们引起的临床疾病(如腹泻、尿道炎等)。)。通过采用这种方法,可以同时针对导致特定综合征的各种菌株(包括耐药菌株和野生型菌株),而不是只关注单个细菌菌株。这一战略促进了创新性广谱治疗和预防措施的发展,以应对这些病原体带来的更广泛挑战,并在不同环境下提供功效和适应性方面的潜在益处。这些方法并不相互排斥,可能在很大程度上重叠,因为综合征方法也可以解决特定的耐药机制。
抗菌药物开发的财务和技术挑战需要公共和私营部门共同参与的全面应对。例如,R&D每年仅花费9亿美元用于新的结核病诊断、药物和结核病疫苗,不到既定全球目标的一半(14)。对其他病原体来说,情况甚至更具挑战性,因为目前全球公共资金明显不足以在R&D投资新的治疗方法和疫苗。尽管一些私人基金和公私伙伴关系做出了贡献,但它们的投资有限,不足以应对清单上重点细菌病原体带来的新的抗菌威胁。
创新的解决方案和强有力的政治承诺是确保持续增加资金的必要条件,包括“推拉”激励措施、资金充足的公私伙伴关系以及用于开展临床试验和批准后监测的合作平台。
通过公共卫生行动应对细菌优先病原体
确保全球公平获得创新和现有的质量有保证的抗生素对于抗击细菌感染至关重要,包括由耐药细菌病原体引起的感染。这需要对供应方和需求方的准入障碍采取综合办法。优化抗生素生产,加强全球供应链,确保严格高效的监管路径,实施稳健有效的采购计划,以及建立高效和有弹性的分销渠道是关键考虑因素。确保患者教育和意识、优化药物组合并将其转化为政策和实践也很重要。应解决LMIC面临的具体挑战,包括作为全民医保的一部分获得抗生素和改善保健系统。不合格和伪造的抗生素在许多环境中普遍存在,也是获得高质量药物的一个障碍。
除了确保公平获取之外,新抗生素的开发和供应必须伴随着强有力的管理,这对于确保其适当使用至关重要。投资开发快速、准确的诊断工具至关重要。建设诊断能力,包括护理点检测和抗生素敏感性检测,对于靶向治疗和遏制不必要的抗生素处方至关重要。此外,决策者的认识、承诺和同一健康各部门之间的协调对于旨在防治ABR的干预措施的成功管理和长期可持续性至关重要。例如,非伤寒沙门氏菌中的ABR主要源于畜牧业中抗生素的使用,因此,控制氟喹诺酮类药物在人类和动物中的不当使用是直接减轻非伤寒沙门氏菌ABR的关键。
新抗生素的开发和可用性不足以控制ABR。IPC措施和强有力的管理规划是必要的,以确保新抗生素的长期有效性并最大限度地减少ABR的出现和传播。加强卫生保健机构和社区的IPC能力、基础设施和治理至关重要。这将需要充足的资源、全面的教育和培训方案以及强有力的监管框架来支持和执行IPC做法。
对于一些优先的细菌病原体,疫苗在减轻ABR感染负担方面可能很重要,从而减轻抗生素的压力并有助于缓解AMR。针对结核分枝杆菌、伤寒沙门氏菌(例如伤寒结合疫苗)、肺炎链球菌(例如肺炎球菌结合疫苗)和志贺氏菌(例如正在开发的志贺氏菌候选疫苗)的疫苗将非常重要(63)。现有疫苗的覆盖和推广需要得到全球政策和干预措施的支持,以改善可及性和可负担性,特别是在传染病负担最重的低资源环境中。研究目标包括降低疫苗制造成本、促进当地生产、根据当地流行病学提高血清型覆盖率以及开发蛋白质结合和疫苗制造的新方法。
对于像CRE、CRAB和CRPA这样的医院内病原体来说,目前的形势给疫苗开发带来了巨大障碍,使其成为不切实际的投资。相反,将资源用于研究和开发具有新作用机制的抗生素、优化其使用以及实施基于医院的感染预防和控制(IPC)策略似乎是更可行和更重要的方法(9).
监测对于处理ABR至关重要,例如,通过全面、及时的系统确定研究重点、指导抗菌管理和指导政策决策。尽管最近取得了进展,但在全球病原体趋势、疾病负担、临床监测和抗生素消费方面的数据仍存在巨大差距。为了弥补这些差距,应投资加强监测基础设施,改善数据收集和分析,并促进国家和国际机构之间的合作。世卫组织BPPL通过将工作重点放在最关键的威胁上,在指导全球监控方面发挥了重要作用。通过利用监测系统(包括世卫组织玻璃杯中的系统),可以确定新出现的耐药模式,并评估干预措施的有效性(8)。共享监测数据和使用协调一致的协议将加强全球抗击ABR的工作。世卫组织玻璃、世卫组织全球淋球菌抗菌药物监测规划和世卫组织结核病耐药性监测全球项目等倡议之间的合作应导致知识共享,为R&D提供信息并制定有效战略。
应开展研究,以了解气候变化与优先细菌病原体AMR之间的关系。不断演变的气候变化生态动态会显著影响这些病原体的流行和耐药机制(64)。对这一交叉领域研究的投资不仅会增加对细菌感染和AMR环境驱动因素的理解,还有助于制定有针对性的策略来减轻后果。
在定义病原体的属性时,2024年世卫组织BPPL优先化进程考虑了同一健康原则,该原则承认人类、动物和环境健康之间的相互联系。在整个同一健康范围内的传播性是用于评估这些部门之间可能爆发或传播耐药性的病原体的标准之一(见附件3中的“传播性标准”)。将BPPL纳入同一健康AMR政策框架可以通过促进同一健康整体方法来减轻ABR的威胁,从而为监测、研究和干预提供指导。有必要进行更多的基础研究,以加强对同一健康频谱传输动力学的了解(65),特别是考虑到资金有限以及定性标准(如可预防性和跨同一健康各区间的传播性)的证据缺口。
参考
1. Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Aguilar GR, Gray A, Han C, Bisignano C, Rao P, Wool E, Johnson SC. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The lancet. 2022 Feb 12;399(10325):629-55. DOI:https://doi.org/10.1016/S0140-6736(21)02724-0.
2. The End TB Strategy. Geneva: World Health Organization, Global Tuberculosis Programme; 2015. Available from:https://www.who.int/teams/global-tuberculosis-programme/the-end-tb-strategy[Accessed April 8, 2024].
3. Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. Geneva: World Health Organization; 2017. Available from:https://www.who.int/publications/i/item/WHO-EMP-IAU-2017.12(Last accessed 09/04/2024)。
4. Antibacterial agents in clinical and preclinical development: an overview and analysis. Geneva: World Health Organization; 2021. Available from:https://www.who.int/publications/i/item/9789240021303[Accessed April8, 2024].
5. Butler MS, Gigante V, Sati H, Paulin S, Al-Sulaiman L, Rex JH, Fernandes P, Arias CA, Paul M, Thwaites GE, Czaplewski L, Alm RA, Lienhardt C, Spigelman M, Silver LL, Ohmagari N, Kozlov R, Harbarth S, Beyer P. Analysis of the Clinical Pipeline of Treatments for Drug-Resistant Bacterial Infections: Despite Progress, More Action Is Needed. Antimicrob Agents Chemother. 2022 Mar 15;66(3):e0199121. Doi:10.1128/AAC.01991-21. Epub 2022 Jan 10. PMID: 35007139; PMCID: PMC8923189.
6. Di Bella S, Giacobbe DR, Maraolo AE, Viaggi V, Luzzati R, Bassetti M et al. Resistance to ceftazidime/avibactam in infections and colonisations by KPC-producing Enterobacterales: a systematic review of observational clinicalstudies. J Glob Antimicrob Resist. 2021;25:268–81.https://doi.org/10.1016/j.jgar.2021.04.001.
7. WHO consolidated guidelines on tuberculosis. Module 4: treatment – drug-resistant tuberculosis treatment, 2022 update. Geneva: World Health Organization; 2022. Available from:https://www.who.int/publications/i/item/9789240063129[Accessed April 8, 2024].
8. Global antimicrobial resistance and use surveillance system (GLASS) report: 2022. Geneva: World Health Organization; 2022. Available from:https://www.who.int/publications/i/item/9789240062702[AccessedApril 8, 2024] .
9. Guidelines for the prevention and control of carbapenem-resistant Enterobacteriaceae,Acinetobacter baumanniiandPseudomonas aeruginosain health care facilities. Geneva: World Health Organization; 2017. Available from:https://www.who.int/publications/i/item/9789241550178[Accessed April 8, 2024].
10. Incentivising the development of new antibacterial treatments 2023. Progress report by the Global AMR R&D Hub & WHO. Geneva: World Health Organization; 2023. Available from:https://cdn.who.int/media/docs/default-source/antimicrobial-resistance/amr-gcp-irc/incentivising-development-of-new-antibacterial-treatments-2023—progress-report.pdf?sfvrsn=72e4f738_3[Accessed April 8, 2024].
11. MacLean RC, San Millan A. The evolution of antibiotic resistance. Science. 2019;365(6458):1082–3. Doi:10.1126/science.aax3879.
12. Tacconelli E, Carrara E, Savoldi A, Harbarth S, Mendelson M, Monnet DL, Pulcini C, Kahlmeter G, Kluytmans J, Carmeli Y, Ouellette M. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. The Lancet infectious diseases. 2018 Mar 1;18(3):318-27. TheLancet infectious diseases. 2018 Mar 1;18(3):318-27. DOI:10.1016/S1473-3099(17)30753-3.
13. Pezzani MD, Mazzaferri F, Compri M, Galia L, Mutters NT, Kahlmeter G, Zaoutis TE, Schwaber MJ, Rodríguez- Baño J, Harbarth S, Tacconelli E. Linking antimicrobial resistance surveillance to antibiotic policy in healthcare settings: the COMBACTE-Magnet EPI-Net COACH project. Journal of Antimicrobial Chemotherapy. 2020Dec;75(Supplement_2):ii2-19. DOI:10.1093/jac/dkaa425
14. Global tuberculosis report 2022. Geneva: World Health Organization; 2022. Available from:https://www.who.int/teams/global-tuberculosis-programme/tb-reports/global-tuberculosis-report-2022[Accessed April 8,2024].
15. Keeney RL, Raiffa H. Decisions with multiple objectives: preferences and value trade-offs. Cambridge: Cambridge University Press; 1993. Available from:https://www.cambridge.org/core/books/decisions-with-multiple-objectives/DEF338459C327778C3F8C4C4A682032F[Accessed April 8, 2024].
16. Cinelli M. The art of supporting decision-making. Exchanges: The Interdisciplinary Research Journal. 2017 Apr 30;4(2):298-308. DOI:https://doi.org/10.31273/eirj.v4i2.166.
17. TsoukiàsA. On the concept of decision aiding process: an operational perspective. Annals of Operations Research.
2007 Oct;154(1):3-27.
18. Cinelli M, Kadziński M, Miebs G, Gonzalez M, Słowiński R. Recommending multiple criteria decision analysis methods with a new taxonomy-based decision support system. European Journal of Operational Research. 2022Oct 16;302(2):633-51. Doi:https://doi.org/10.1016/j.ejor.2022.01.011.
19. Hansen P, Ombler F. A new method for scoring additive multi-attribute value models using pairwise rankings of alternatives. Journal of Multi-Criteria Decision Analysis. 2008 May;15(3-4):87-107.https://doi.org/10.1002/mcda.428.
20. Dean AS, Auguet OT, Glaziou P, Zignol M, Ismail N, Kasaeva T et al. 25 years of surveillance of drug-resistant tuberculosis: achievements, challenges, and way forward. Lancet Infect Dis. 2022;22(7):e191–6. Doi:10.1016/s1473-3099(21)00808-2.
21. WHO consolidated guidelines on tuberculosis. Module 4: treatment – drug-resistant tuberculosis treatment, 2022 update. Geneva: World Health Organization; 2022 Available from:https://www.who.int/publications/i/item/9789240063129[Accessed April 8, 2024].
22. Jiang Y, Ding Y, Wei Y, Jian C, Liu J, Zeng Z. Carbapenem-resistantAcinetobacter baumannii: A challenge in the intensive care unit. Frontiers in microbiology. 2022 Nov 10;13:1045206.https://doi.org/10.3389/fmicb.2022.1045206.
23. Aguilar GR, Swetschinski LR, Weaver ND, Ikuta KS, Mestrovic T, Gray AP, Chung E, Wool EE, Han C, Hayoon AG, Araki DT. The burden of antimicrobial resistance in the Americas in 2019: a cross-country systematic analysis.The Lancet Regional Health–Americas. 2023 Sep 1;25.https://doi.org/10.1016/j.lana.2023.100561.
24. Mestrovic T, Aguilar GR, Swetschinski LR, Ikuta KS, Gray AP, Weaver ND, Han C, Wool EE, Hayoon AG, Hay SI, Dolecek C. The burden of bacterial antimicrobial resistance in the WHO European region in 2019: a cross- country systematic analysis. The Lancet Public Health. 2022 Nov 1;7(11):e897-913.https://doi.org/10.1016/S2468-2667(22)00225-0.
25. Jean SS, Harnod D, Hsueh PR. Global threat of carbapenem-resistant Gram-negative bacteria. Frontiers in cellular and infection microbiology. 2022 Mar 15;12:823684.https://doi.org/10.3389/fcimb.2022.823684.
26. PoudelAN, Zhu S, Cooper N, Little P, Tarrant C, Hickman M, Yao G. The economic burden of antibiotic resistance: A systematic review and meta-analysis. PLoS One. 2023 May 8;18(5):e0285170. PMID:37155660; PMCID:PMC10166566; DOI:10.1371/journal.pone.0285170.
27. Zhen X, Lundborg CS, Sun X, Hu X, Dong H. Economic burden of antibiotic resistance in ESKAPE organisms: a systematic review. Antimicrobial Resistance & Infection Control. 2019 Dec;8:1-23. DOI:10.1186/s13756-019-0590-7.
28. Bartsch SM, McKinnell JA, Mueller LE, Miller LG, Gohil SK, Huang SS, Lee BY. Potential economic burden of carbapenem-resistant Enterobacteriaceae (CRE) in the United States. Clinical Microbiology and Infection. 2017Jan 1;23(1):48-e9.https://doi.org/10.1016/j.cmi.2016.09.003.
29. Department of Economic and Social Affairs. The sustainable development goals. Goal 3. Ensure healthy lives and promote well-being for all at all ages. Available from:https://sdgs.un.org/goals/goal3[Accessed April 8, 20 24].
30. Russell NJ, Stöhr W, Plakkal N, Cook A, Berkley JA, Adhisivam B, Agarwal R, Ahmed NU, Balasegaram M, Ballot D, Bekker A. Patterns of antibiotic use, pathogens, and prediction of mortality in hospitalized neonates and young infants with sepsis: A global neonatal sepsis observational cohort study (NeoOBS)。 PLoS Medicine. 2023 Jun8;20(6):e1004179.https://doi.org/10.1371/journal.pmed.1004179.
31. Lee AS, Huttner BD, Catho G, Harbarth S. Methicillin-resistantStaphylococcus aureus: an update on prevention and control in acute care settings. Infectious Disease Clinics. 2021 Dec 1;35(4):931-52. Doi10.1016/j.idc.2021.07.001.
32. GBD 2017 Typhoid and Paratyphoid Collaborators. The global burden of typhoid and paratyphoid fevers: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Infect Dis. 2019;19(4):369–81.Doi:10.1016/S1473-3099(18)30685-6.
33. Marchello CS, Carr SD, Crump JA. A systematic review on antimicrobial resistance amongSalmonellaTyphiworldwide. Am J Trop Med Hyg. 2020;103(6):2518. Doi:10.4269/ajtmh.20-0258.
34. Qamar FN, Yousafzai MT, Dehraj IF, Shakoor S, Irfan S, HotwaniA, Hunzai MJ, Thobani RS, Rahman N, Mehmood J, Hemlock C. Antimicrobial resistance in typhoidalSalmonella: surveillance for enteric fever in Asia project, 2016–2019. Clinical Infectious Diseases. 2020 Nov 1;71(Supplement_3):S276-84.https://doi.org/10.1093/cid/ciaa1323.
35. Britto CD, Dyson ZA, Mathias S, Bosco A, Dougan G, Jose S, Nagaraj S, Holt KE, Pollard AJ. Persistent circulation of a fluoroquinolone-resistantSalmonellaenterica Typhi clone in the Indian subcontinent. Journal of Antimicrobial Chemotherapy. 2020 Feb 1;75(2):337-41.https://doi.org/10.1093/jac/dkz435.
20 WHO Bacterial Priority Pathogens List , 2024
36. Kumar, A., Kumar, A. Antibiotic resistome ofSalmonellaTyphi: molecular determinants for the emergence ofdrug resistance. Front. Med. 15, 693–703 (2021)。https://doi.org/10.1007/s11684-020-0777-6.
37. Saha S, Sajib MSI, Garrett D, Qamar FN. Antimicrobial Resistance in TyphoidalSalmonella: Around the World in
3 Days. Clin Infect Dis. 2020 Jul 29;71(Suppl 2):S91-S95. Doi:10.1093/cid/ciaa366. PMID: 32725234; PMCID:PMC7388716.
38. Walker J, Chaguza C, Grubaugh ND, Carey M, Baker S, Khan K, Bogoch II, Pitzer VE. Assessing the global risk of typhoid outbreaks caused by extensively drug resistantSalmonellaTyphi. Nature communications. 2023 Oct16;14(1):6502. Doi:https://www.nature.com/articles/s41467-023-42353-9
39. Majowicz SE, Musto J, Scallan E, Angulo FJ, Kirk M, O’Brien SJ, Jones TF, Fazil A, Hoekstra RM; International Collaboration on Enteric Disease ‘Burden of Illness’ Studies. The global burden of nontyphoidalSalmonellagastroenteritis. Clin Infect Dis. 2010 Mar 15;50(6):882-9. Doi:10.1086/650733. PMID: 20158401.
40. Cuypers WL, Jacobs J, Wong V, Klemm EJ, Deborggraeve S, Van Puyvelde S. Fluoroquinolone resistance inSalmonella: insights by whole-genome sequencing. Microbial genomics. 2018 Jul;4(7):e000195.https://doi.org/10.1099/mgen.0.000195.
41. KONGSOI, Siriporn; NAKAJIMA, Chie; SUZUKI, Yasuhiko. Quinolone resistance in nontyphoidal salmonella.current topics in salmonella and salmonellosis. IntechOpen, 2017, S. 115-135. Doi:10.5772/67154
42. Khalil IA, Troeger C, Blacker BF, Rao PC, Brown A, Atherly DE et al. Morbidity and mortality due to shigella and enterotoxigenicEscherichia colidiarrhoea: the Global Burden of Disease Study 1990–2016. Lancet infect Dis.2018;18(11):1229–40. Doi:10.1016/S1473-3099(18)30475-4.
43. Ud-Din AIMS, Wahid SUH, Latif HA, Shahnaij M, Akter M, Azmi IJ et al. Changing trends in the prevalence ofShigellaspp. : emergence of multi-drug resistantShigellasonnei biotype g in Bangladesh. PloS One.2013;8(12):e82601. Doi:10.1371/journal.pone.0082601.
44. Salleh MZ, Zuraina NMNN, Hajissa K, Ilias MI, Singh KKB, Deris ZZ. Prevalence of multidrug-resistant and extended-spectrum beta-lactamase-producingShigellaspp. in Asia: a systematic review and meta-analysis.Antibiotics (Basel)。 2022;11(11):1653. Doi:10.3390/antibiotics11111653.
45. Thorley K, Charles H, Greig DR, Prochazka M, Mason LCE, Baker KS et al. Emergence of extensively drug- resistant and multidrug-resistantShigellaflexneri serotype 2a associated with sexual transmission among gay, bisexual, and other men who have sex with men, in England: a descriptive epidemiological study. Lancet InfectDis. 2023;23(6):732–9. Doi:10.1016/S1473-3099(22)00807-6.
46. O’Flanagan H, Siddiq M, Llewellyn C, Richardson D. Antimicrobial resistance in sexually transmittedShigellain men who have sex with men: a systematic review. Int J STD AIDS. 2023;34(6):374–84.Doi:10.1177/09564624231154942.
47. Global health sector strategy on sexually transmitted infections. Geneva: World Health Organization; 2022. Available from:https://www.who.int/reproductivehealth/publications/rtis/ghss-stis/en/. [Accessed April 8,2024].
48. Newman L, Rowley J, Vander Hoorn S, Wijesooriya NS, Unemo M, Low N, Stevens G, Gottlieb S, Kiarie J, Temmerman M. Global estimates of the prevalence and incidence of four curable sexually transmitted infections in 2012 based on systematic review and global reporting. PloS one. 2015 Dec 8;10(12):e0143304. Doi:https://doi.org/10.1371/journal.pone.0143304
49. Kaveh Manavi, A review on infection with Chlamydia trachomatis, Best Practice & Research Clinical Obstetrics & Gynaecology, Volume 20, Issue 6, 2006, Pages 941-951, ISSN 1521-6934,https://doi.org/10.1016/j.bpobgyn.2006.06.003. Available from:https://www.sciencedirect.com/science/article/pii/S1521693406000666[Accessed April 8, 2024].
50. Unemo M, Del Rio C, Shafer WM. Antimicrobial resistance expressed byNeisseria gonorrhoeae: a major global public health problem in the 21st century. Microbiol Spectr 4: EI10-0009-2015. Available from:https://doi.org/10.1128/9781555819453.ch12[Accessed April 8, 2024].
51. Unemo M, Golparian D, Eyre DW. Antimicrobial resistance inNeisseria gonorrhoeaeand treatment of gonorrhea.Neisseria gonorrhoeae: methods and protocols. 2019:37-58. Doi:10.1007/978-1-4939-9496-0_3
52. Del Turco ER, Bartoletti M, Dahl A, Cervera C, Pericàs JM. How do I manage a patient with enterococcal bacteraemia?. Clinical Microbiology and Infection. 2021 Mar 1;27(3):364-71.https://doi.org/10.1016/j.cmi.2020.10.029.
53. Blasi F, Mantero M, Santus P, Tarsia P. Understanding the burden of pneumococcal disease in adults. Clinical Microbiology and Infection. 2012 Oct;18:7-14.https://doi.org/10.1111/j.1469-0691.2012.03937.
54. World Health Organization. Revised WHO classification and treatment of childhood pneumonia at health dacilities – evidence summaries. Geneva: WHO; 2014. Available from:https://www.who.int/publications/i/item/9789241507813[Accessed April 8, 2024].
55. Song JH, Jung SI, Ko KS, Kim NY, Son JS, Chang HH, Ki HK, Oh WS, Suh JY, Peck KR, Lee NY. High prevalence of antimicrobial resistance among clinicalStreptococcus pneumoniaeisolates in Asia (an ANSORP study)。 Antimicrobial agents and chemotherapy. 2004 Jun;48(6):2101-7. DOI:https://doi.org/10.1128/aac.48.6.2101-2107.2004.
56. Aliberti S, Cook GS, Babu BL, Reyes LF, Rodriguez AH, Sanz F, Soni NJ, Anzueto A, Faverio P, Sadud RF, Muhammad I. International prevalence and risk factors evaluation for drug-resistantStreptococcus pneumoniaepneumonia. Journal of Infection. 2019 Oct 1;79(4):300-11.https://doi.org/10.1016/j.jinf.2019.07.004.
57. World Health Organization. (n.d.)。 Immunization coverage [Fact sheet]. Retrieved fromhttps://www.who.int/news-room/fact-sheets/detail/immunization-coverage#:~:text=Pneumococcal%20vaccine%20had%20been%20introduced,the%20WHO%20Western%20Pacific%20Region. [Accessed April 8, 2024].
58. Machalek DA, Tao Y, Shilling H, Jensen JS, Unemo M, Murray G, Chow EP, Low N, Garland SM, Vodstrcil LA, Fairley CK. Prevalence of mutations associated with resistance to macrolides and fluoroquinolones inMycoplasma genitalium: a systematic review and meta-analysis. The lancet infectious diseases. 2020 Nov 1;20(11):1302-14.DOI:https://doi.org/10.1016/S1473-3099(20)30154-7.
59. Gnanadurai R, Fifer H.Mycoplasma genitalium: a review. Microbiology. 2020 Jan;166(1):21-9.https://doi.org/10.1099/mic.0.000830.
60. Tamma PD, Aitken SL, Bonomo RA, Mathers AJ, van Duin D, Clancy CJ. Infectious Diseases Society of America
2023 guidance on the treatment of antimicrobial resistant gram-negative infections. Clinical Infectious Diseases.
2023 Jul 18:ciad428.https://doi.org/10.1093/cid/ciad428.
61. Falcone M, Daikos GL, Tiseo G, Bassoulis D, Giordano C, Galfo V, Leonildi A, Tagliaferri E, Barnini S, Sani S, Farcomeni A. Efficacy of ceftazidime-avibactam plus aztreonam in patients with bloodstream infections caused by metallo-β-lactamase–producing Enterobacterales. Clinical Infectious Diseases. 2021 Jun 1;72(11):1871-8.https://doi.org/10.1093/cid/ciaa586.
62. Target regimen profiles for tuberculosis treatment, 2023 update. Geneva: World Health Organization; 2023 Available from:https://www.who.int/publications/i/item/9789240081512[Accessed April 8, 2024].
63. Bacterial vaccines in clinical and preclinical development 2021. An overview and analysis. Geneva: World Health Organization; 2022 Available from:https://www.who.int/publications/i/item/9789240052451[Accessed April8, 2024].
64. Turner B. Tackling antimicrobial resistance and climate change. Lancet. 2018;392(10163):2435–6. DOI:10.1016/S0140-6736(18)32413-9.
65. World Health Organization, Food and Agriculture Organization of the United Nations, United Nations Environment Programme, World Organisation for Animal Health. A one health priority research agenda for antimicrobial resistance. Geneva: World Health Organization; 2023 Available from:https://iris.who.int/bitstream/handle/10665/370279/9789240075924-eng.pdf?sequence=1[Accessed April 8, 2024].
ISBN 978-92-4-009346-1(电子版)ISBN 978-92-4-009347-8(印刷版)
世界卫生组织2024
保留一些权利。本作品可在知识共享署名-非商业性使用-类似共享3.0 IGO许可下获得(CC BY-NC-SA 3.0 IGO;https://creativecommons.org/licenses/by-nc-sa/3.0/igo)。
根据本许可证的条款,您可以出于非商业目的复制、再分发和改编该作品,前提是该作品被适当引用,如下所示。在使用本作品时,不应暗示世卫组织认可任何特定的组织、产品或服务。不允许使用世卫组织标志。如果您改编作品,那么您必须在相同或等效的知识共享许可下许可您的作品。如果您创建了此作品的翻译,您应该在建议的引用中添加以下免责声明:“此翻译不是由世界卫生组织(WHO)创建的。世卫组织不对本翻译的内容或准确性负责。英文原版应为具有约束力的权威版本”。
与许可证引起的争议相关的任何调解应根据世界知识产权组织的调解规则进行(http://www.wipo.int/amc/en/mediation/rules/)。
建议引用。世卫组织细菌优先病原体名单,2024年:对公共健康重要的细菌病原体,以指导研究,开发和预防控制抗生素耐药性的策略。日内瓦:世界卫生组织;2024.许可证:CC BY-NC-SA 3.0 IGO.
在版编目(CIP)数据。CIP数据可从以下网址获得https://iris.who.int/.
销售、权利和许可。要购买世卫组织出版物,请参阅https://www.who.int/publications/book-orders。若要提交商业使用请求以及有关权利和许可的查询,请参见https://www.who.int/copyright.
第三方材料。如果您希望重用本作品中属于第三方的材料,如表格、图表或图像,您有责任确定是否需要获得该重用的许可,并获得版权所有者的许可。因侵犯作品中任何第三方拥有的组件而导致的索赔风险完全由用户承担。
一般免责声明。本出版物中使用的名称和材料的介绍并不意味着世卫组织对任何国家、领土、城市或地区或其当局的法律地位,或对其边境或边界的划分表达任何意见。地图上的点划线表示可能尚未完全一致的近似边界线。
提及特定公司或某些制造商的产品,并不意味着世卫组织认可或推荐它们优于其他未提及的类似性质的公司。除了错误和遗漏,专有产品的名称以首字母大写来区分。
世卫组织已采取所有合理的预防措施来验证本出版物中包含的信息。但是,发布的材料没有任何形式的保证,无论是明示的还是暗示的。解释和使用材料的责任在于读者。在任何情况下,世卫组织对因其使用而导致的损害概不负责。
400通信有限公司设计和布局
Hits: 307