Contents
Mpox Clinical Guide
国家性传播疾病课程
信息指南
猴痘临床指南
- 拉卡·G·库姆巴卡尔,医学博士
- 杰森·E·祖克,医学博士
- 凯文·L·阿德,医学博士、公共卫生硕士
- 威廉·F·西姆斯,医学博士
- 克洛伊·布赖森·卡恩,医学博士
- 大卫·H·斯帕奇,医学博士
关于本信息指南
本指南是为参与照顾猴痘(原名猴痘)患者的医疗保健专业人员开发的。本指南由华盛顿大学传染病教育与评估项目(IDEA)制作。
使用本指南的许可
如果用于非商业目的,本教育指南可以在不获得许可的情况下复制。
最后更新日期
本教育指南最后一次更新于2025年2月4日。
作者所属机构
- 过敏与传染病科/华盛顿大学
- 传染病科/哥伦比亚大学
- 传染病科/麻省总医院
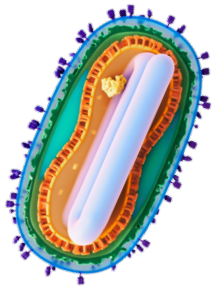
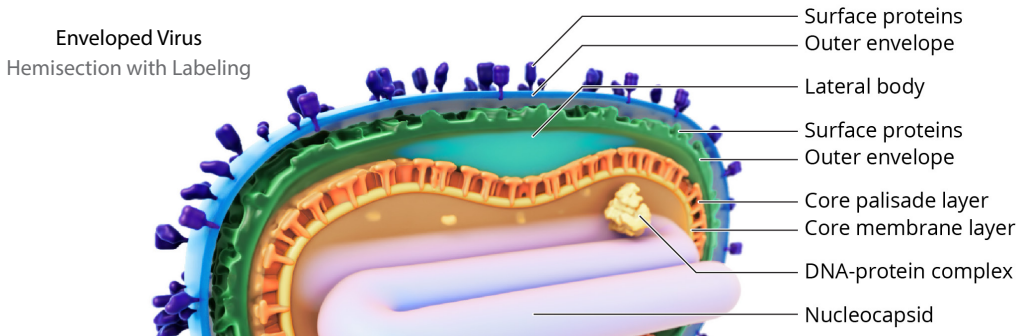
病毒结构描述
猴痘是由猴痘病毒引起的疾病,属于正痘病毒科。正痘病毒的特点是在冷冻电子断层扫描中呈现椭圆形砖块状形态。猴痘病毒的尺寸为360纳米×270纳米×250纳米,含有约197千碱基(kb)的线性双链DNA。该基因组编码超过200种蛋白质,这些蛋白质对病毒生命周期、病毒组装和逃避宿主免疫防御至关重要。猴痘感染病毒可以以两种不同的形式存在:细胞外包膜病毒(EEV,也简称为EV)和细胞内成熟病毒(IMV,也简称为MV)。
包膜病毒 | 包膜病毒 半透明 | 包膜病毒 半切除 |
成熟病毒 | 成熟病毒 半透明 | 成熟病毒 半切除 |
包膜病毒 带标记的半切除 | ||
猴痘病毒生命周期描述

1. 病毒进入:猴痘病毒可以以细胞外包膜病毒(EEV)或成熟病毒(MV)的形式附着并进入宿主细胞。MV包膜与质膜或内吞膜的融合涉及多种病毒蛋白。
- 早期转录和翻译:一些猴痘DNA立即被转录和翻译,产生早期蛋白质,包括生长因子、免疫反应调节因子以及DNA复制所需的因子。这一早期步骤发生在宿主细胞质中。
- 脱壳:细胞进入后,病毒核心发生脱壳,外层膜脱落,核心释放到细胞质中。核心的脱壳有助于DNA复制。
- DNA复制:大部分猴痘DNA复制形成串联体DNA(长连续DNA分子,包含相同DNA序列串联连接)。该过程发生在一个局部化的细胞质区域,称为病毒工厂。
- 中期基因转录和翻译:在病毒工厂区域内,新复制的(后代)猴痘病毒DNA可以进行中期转录和翻译,生成包括晚期转录所需转录因子的中期蛋白质。此外,还会生成晚期蛋白质,有些对病毒结构有贡献,其他则在早期转录和翻译中发挥作用。
6.晚期基因转录和翻译:此外,在病毒工厂区域内,后代猴痘病毒DNA可以进行晚期转录和翻译,从而产生晚期蛋白质,包括一些对病毒组装过程有贡献的蛋白质。
- 组装:猴痘DNA被分解成单个基因组,并与早期转录所需的蛋白质一起包装进核心。
- 组装:组装好的核心从病毒工厂区域移出,在那里获得外膜,成为成熟的病毒(MV)。MV通常被限制在细胞内,除非在罕见的细胞溶解事件中。
- 包装:部分总病毒颗粒进一步被跨高尔基体/晚期内体双膜包裹,形成细胞内包膜病毒(IEV)。
- 外泌作用:IEV通过微管迁移到细胞边缘,并通过外泌作用释放,成为细胞相关包膜病毒(CEV)。CEV可以感染邻近细胞。大约1%的CEV通过形成活动性肌动蛋白尾部,释放到细胞外空间,成为细胞外包膜病毒(EEV)。EEV负责病毒的远程传播。
| 猴痘的表现和症状 | 感染猴痘的人可能会出现一系列综合的体征和症状,其中可能包括皮疹、发热、身体不适、寒战、头痛以及淋巴结肿大。皮疹是最常见的表现,通常从最初的斑疹开始,逐渐发展为丘疹、水疱和脓疱。随着时间推移,一些脓疱性皮损会发生溃疡,但几乎所有的皮损最终都会结痂,然后形成硬痂。
对于近期可能接触过猴痘的人,即使只出现一些不太常见的症状和表现,临床医生也应高度怀疑猴痘,这些症状和表现包括直肠方面的(疼痛、里急后重和 / 或出血)、泌尿生殖系统方面的(尿痛和 / 或尿道炎)以及口咽部的(疼痛和 / 或淋巴结肿大)。最新数据显示,有些人在猴痘症状出现前 1 至 4 天就能够将猴痘病毒传播给他人。 |
向美国疾病控制与预防中心报告的猴痘(MPOX)病例:症状和体征

来源:疾病控制与预防中心,2022年疫情病例与数据。2022年12月21日。
编辑说明
口咽部症状并未包含在CDC猴痘病例报告中。根据病例系列研究,口咽部症状(包括咽炎)在确诊猴痘的患者中较为常见,占比在2-29%之间。
临床表现
| 猴痘病变进展 | 皮疹(病灶)可能出现在身体的任何部位。在2022年猴痘疫情报告的病例中,皮疹最常出现在肛门生殖器区域,但也常见于口腔、手部、面部、脚部或胸部。 有时,皮疹最初会在舌头和口腔内形成。这种情况被称为黏膜疹。 皮疹通常会经历以下所示的六个阶段。 |
MPOX病变进展描述和时间线

口鼻部及皮肤梅毒疹
 上腭部溃疡性病变 上腭部溃疡性病变 |
|
|
|
|
|
|
|
|
|
|
在临床环境中的感染预防/控制
| 要使用的个人防护设备(PPE)
完整的个人防护装备 | 注意:进入病房前保持手卫生,穿个人防护用品。 | |
 符合NIOSH认可的呼吸器(配备N95过滤器或更高版本) |  眼部保护(覆盖面部正面和侧面) | |
 手套 手套 |  长袍 | |
| 病人的衣室 | 对于疑似或确诊猴痘的患者,应将其安置在单人房间内;一般情况下无需特殊的空气处理(如负压隔离病房),但在进行插管、拔管以及可能会传播口腔分泌物的操作(如诱导痰标本采集)时除外。 理想情况下,应为猴痘患者配备专用的卫生间。 当患者离开房间时,所有外露的皮疹部位都应遮盖好,并且患者应佩戴贴合良好的医用口罩。 | |
| 清洁病人室 | 使用美国环境保护署(EPA)在《应对新型病毒病原体的消毒剂清单Q》中登记的消毒剂进行标准的清洁和消毒工作。 处理被污染的床上用品、毛巾和衣物时,应穿戴个人防护装备(PPE),随后妥善收纳;应避免抖动或随意处理这些物品,以防将传染性颗粒气雾化。避免采用干扫、清扫、吸尘或其他类似的清洁方式。 被污染的物品可按照处理其他传染性医疗废物的相同方式进行处置。本指南适用于与2022年猴痘疫情相关的猴痘病毒进化枝。 | |
| **编辑注** 未穿戴全套个人防护装备(PPE)而接触猴痘的医护人员,若无症状,应进行21天的症状自我监测,若一直无症状则可继续工作。根据接触情况,可能会建议医护人员接种JYNNEOS疫苗进行暴露后预防。 房间清洁完毕后,新患者可正常入住该房间。 | ||
诊断与测试
| 猴痘的诊断 | 猴痘的确诊是通过从皮肤或皮肤黏膜部位获取的标本中检测出猴痘病毒来实现的。以下展示了用于猴痘病毒分子检测的临床标本采集的正确技术。 |
| 概述 收集至少2个病变的2个标本 | 供应清单 ● 至少4支合成拭子 ● 每支拭子的容器* ● 样本袋 ● 患者标签 ● 无菌纱布 ● 美国环保署注册的消毒湿巾 ● 基本患者护理所需的其他用品 |
| *容器的类型、拭子和运输介质可能因当地实验室指南而异;请咨询您当地的检测点以获取偏好选择。 |
① 在采样前:在进入患者病房之前,先进行手部卫生并穿戴个人防护装备(PPE)。
② 在第一个病变部位:在采样前不要使用乙醇或其他消毒剂清洁病变区域。

A.牢牢握住棉签。避免在棉签头至少一英寸的地方触摸杆部。
B.在病变表面来回用力擦拭棉签3次。如果病变破裂,确保棉签收集到病变液体。不建议且不必要揭开病变覆盖物。
C.将棉签旋转180度。再次用力擦拭病变3次。
D.将棉签放入适当的容器中,如有必要可折断杆部。用EPA批准的消毒剂进行擦拭。

E.重复第2步,用第二根棉签在同一个病变部位进行A至D的步骤。
③在第二个病变部位:在第二个病变部位,重复第2步,进行A至E的步骤。
标记并包装样本:
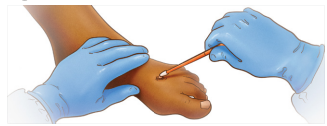
④第二个病变理想情况下位于身体的不同部位和/或具有不同的外观。

根据测试实验室制定的规范,对标本进行标记、包装、储存和运输。
编辑说明
在既往有性暴露史的情况下,即使没有皮肤病变,也要高度怀疑猴痘(mpox)在临床综合征中的存在,如排尿困难、咽炎和直肠炎。检测这些综合征中涉及的典型病原体,包括淋病、衣原体、梅毒和单纯疱疹病毒(HSV)。如果临床高度怀疑HSV和/或水痘-带状疱疹病毒,并且对这些病毒也进行了检测,那么临床医生应非常仔细地揭开病变。有报道称,医护人员在针刺伤害后感染了猴痘病毒。
MPOX患者的管理
| 应该为患者提供哪些支持性护理呢? | 疼痛是猴痘患者的常见症状。这包括局部疼痛(由皮疹引起)以及黏膜损伤部位的疼痛(直肠、尿道、口咽部)。疼痛控制是治疗的关键。 ● 疼痛控制策略包括使用非处方止痛药,如非甾体抗炎药和对乙酰氨基酚,如有需要,也可使用处方阿片类药物。 ● 对于直肠炎和严重直肠疼痛的病例,可以使用局部利多卡因、大便软化剂和坐浴。加巴喷丁也已在经验上进行了尝试,有报道称取得了一些积极效果。可以考虑使用局部类固醇,但鉴于存在直肠黏膜变薄以及加重疾病程度或损伤的风险,应谨慎使用。 ● 对于口咽部疼痛的病例,可以使用粘性利多卡因和盐水漱口。难以控制的疼痛或限制经口进食的口咽部疼痛可能是住院的指征。 |
| 谁应该被考虑进行药物治疗? | 某些个体可能适合药物治疗。这些人包括患有严重疾病的患者(例如,出血性疾病、大面积融合性皮损或伴有严重继发感染、败血症、眼部感染,或疼痛严重需要住院治疗的患者)。对于有发展为严重疾病高风险的人群,也应考虑进行治疗,包括严重免疫功能低下者、儿童群体、孕妇或哺乳期妇女,或患有影响皮肤完整性的皮肤病的患者。 |
| 对于正在等待检测结果的患者,应该如何对其进行指导呢? | 可能感染猴痘的患者应尽可能保持隔离状态。这意味着要待在家里并与他人隔开,不上班、不上学,也不前往其他公共场所。 如果可能的话,他们应避免乘坐公共交通工具或其他集体交通工具。若不可避免地要使用公共交通工具,他们应佩戴口罩,确保所有的皮损部位都被遮盖住,并且避免与他人有任何身体接触。 正在等待检测结果且需要进一步医疗护理的患者,应告知其医疗服务提供者自己已进行了猴痘检测。如果不可避免地需要就医(例如进行进一步的医学检测或治疗),患者应确保皮疹完全被遮盖,并且在整个就医过程中都佩戴口罩。 如果可能的话,考虑与狗等宠物隔离,因为已有记录显示存在人传狗的情况。 |
| 对于检测结果呈阳性的患者,应该如何对其进行指导呢? | 猴痘患者应遵循上述为等待检测结果的患者所描述的隔离指示。 如果猴痘患者无法与家中其他人完全隔离开,在共享空间时,他们应该佩戴口罩,避免身体接触,并遮盖住任何皮损部位。如果有条件,他们应尽量使用单独的浴室。 患者应经常用肥皂和水洗手,或使用含酒精的洗手液。任何被触碰过的物品都应进行清洁;衣物最好用机器清洗。 患者应保持隔离状态,直到所有皮疹完全消退、痂皮全部脱落且下面有新皮肤形成。这通常需要2 – 4周。如果患者没有出皮疹,应建议他们保持隔离,直到所有症状(如直肠疼痛、尿道疼痛)完全缓解。 |
| 背景 | 特考韦瑞(Tecovirimat,商品名Tpoxx,研发代号ST-246)是一种抗病毒药物,它能抑制正痘病毒特有的包膜包裹蛋白(p37)。特考韦瑞已获美国食品药品监督管理局(FDA)批准用于治疗天花。动物研究表明,它在治疗由正痘病毒(包括猴痘病毒)引起的疾病方面是有效的。该药物已被证实对健康成年人是安全的,并且是目前多项正在进行的人体疗效试验的重点研究对象。 |
 | |
| 适应症 | 在以下情况下应考虑使用特考韦瑞: – 患有严重猴痘疾病的患者,包括出血性疾病、大量皮损、眼部或眶周感染、败血症、脑炎或其他需要住院治疗的症状。 – 猴痘累及可能导致严重不良后遗症(包括瘢痕或狭窄)的解剖部位的患者。 – 有发展为严重猴痘相关疾病高风险的人群,包括免疫功能低下者、儿童(尤其是8岁以下儿童)、孕妇或哺乳期妇女,以及患有影响皮肤完整性疾病的人群。 |
| 剂量 | 特考韦瑞有口服(200毫克胶囊)和静脉注射两种剂型。剂量根据体重而定;对于大多数成年人(体重40千克至120千克),口服剂量为每12小时600毫克,静脉输注剂量为每12小时200毫克,每次输注需在6小时内缓慢进行。大多数情况下,疗程为14天。如需完整的剂量建议,请参考美国疾病控制与预防中心(CDC)的研究性新药申请(IND)。 |
| 体重(kg) | 推荐剂量(mg) | 推荐剂量(胶囊数) |
|---|---|---|
| 25 kg 至 <40 kg | 400 mg q12h | 2 粒胶囊 q12h |
| 40 kg 至 <120 kg | 600 mg q12h | 3 粒胶囊 q12h |
| 120 kg 及以上 | 600 mg q8h | 3 粒胶囊 q8h |
*具体的儿科用药建议可在IND(试验性新药申请)中获得,可能需要儿科咨询。
| 使用 | 目前,仅可通过以下两种途径获取特考韦瑞:(1)“猴痘治疗药物研究(STOMP)” 临床试验(网址:stomptpoxx.org);(2)依据美国疾病控制与预防中心(CDC)的研究性新药(IND)方案,从国家战略储备中获取。 |
| 临床考虑 | 目前尚未针对儿童或孕妇、哺乳期妇女开展特考韦瑞的临床研究。然而,如果认为使用特考韦瑞治疗猴痘感染对这些人群是合适的,不应将他们排除在治疗之外。在这些情况下使用特考韦瑞,应进行密切的临床评估,并与患者(或其父母)就特考韦瑞治疗的风险和益处进行充分讨论。由于静脉注射用特考韦瑞中的成分羟丙基-β -环糊精存在高暴露风险,2岁以下儿童在治疗期间应进行肾脏监测。 |
| 副反应 | 口服特考韦瑞最常见的不良反应是头痛、恶心、腹痛和呕吐;胃肠外使用特考韦瑞时,最常见的不良反应是输液部位反应(疼痛、肿胀、红斑和外渗)和头痛。 |
| 编辑笔记 | ||
 口服麦片麦片垫必须与高脂肪、高热量的膳食一起服用。 口服麦片麦片垫必须与高脂肪、高热量的膳食一起服用。 |  在提供口服特考韦瑞时,要考虑食物供应不足的情况。 在提供口服特考韦瑞时,要考虑食物供应不足的情况。 |  如果患者获得的食物有限,可以考虑为患者提供高脂肪食物,如坚果果酱。 如果患者获得的食物有限,可以考虑为患者提供高脂肪食物,如坚果果酱。 |
布林西多福韦(Brincidofovir)
| 背景 | 布林西多福韦(Tembexa)是西多福韦的前药,属于核苷酸类似物DNA聚合酶抑制剂。布林西多福韦对正痘病毒有活性,且已获得美国食品药品监督管理局(FDA)批准,用于治疗成人和儿童患者的天花。动物和体外研究表明,它在治疗由正痘病毒引起的疾病(包括猴痘病毒)方面是有效的。布林西多福韦含有一个较大的亲脂性侧链,有助于穿透宿主脂质膜。在细胞内,布林西多福韦通过亲脂性侧链的脂酯键断裂转化为西多福韦。然后西多福韦被磷酸化为西多福韦二磷酸,这是一种具有抗病毒活性的部分,当西多福韦掺入到正在生长的病毒DNA链中时,会抑制DNA聚合酶,进而减缓病毒DNA链的进一步延伸。 |
 | |
| 适应症 | 布林西多福韦可考虑用于以下情况: – 患有严重猴痘疾病或有进展为严重猴痘疾病高风险的患者; – 并且符合以下任一条件: – 在接受特考韦瑞治疗时出现临床上显著的猴痘病情进展,或在使用特考韦瑞初期病情改善后又出现病情复发(初期改善后病情恶化)的患者; – 存在口服或静脉注射特考韦瑞的其他禁忌证或不符合使用条件的患者。 |
| 剂量 | 布林西多福韦有片剂(100 毫克)和口服混悬液(10 毫克 / 毫升)两种剂型。两种制剂均为每周给药一次,共给药 2 剂(在第 1 天和第 8 天给药)。两种制剂的给药剂量均根据体重计算: |
| 年龄组 | 体重(kg) | 片剂(mg) | 口服混悬液(mg) |
|---|---|---|---|
| 成人及儿童 | ≥48 kg | 200 mg ,每周一次,共 2 剂 | 20 mL(200 mg),每周一次,共 2 剂 |
| 成人及儿童 | ≥10 kg 且 < 48 kg | 不适用(NA) | 200 mg ,每周一次,共 2 剂 |
| 儿童 | <10 kg | 不适用(NA) | 6 mg/kg ,每周一次,共 2 剂 |
| 使用 | 布林西多福韦作为美国食品药品监督管理局(FDA)授权的单患者紧急使用研究性新药(e-IND),可用于治疗猴痘感染。如果临床医生的猴痘患者需要使用布林西多福韦进行治疗,需通过电子邮件(DDI.EIND@fda.hhs.gov)或拨打电话301-796-3400 、1-855-543-3784 向FDA提交e-IND申请。 |
| 临床注意事项 | 布林西多福韦不建议在怀孕或哺乳期使用。对于有生育能力的女性,建议在使用布林西多福韦前进行妊娠检测。 |
| 不良反应 | 布林西多福韦相关的不良反应包括恶心、呕吐、腹泻、肝炎和腹痛。布林西多福韦也可能导致血清转氨酶(丙氨酸氨基转移酶或天冬氨酸氨基转移酶)和胆红素水平无症状性升高。在开始治疗前应检测血清转氨酶水平。布林西多福韦不会引起肾毒性,对于轻度、中度或重度肾功能损害患者,无需调整剂量。 |
| 药物相互作用 | 布林西多福韦绝不能与西多福韦同时使用。布林西多福韦与有机阴离子转运多肽1B1和1B3抑制剂(如克拉霉素、环孢素、红霉素、吉非罗齐、利福平、人类免疫缺陷病毒蛋白酶抑制剂和丙型肝炎病毒蛋白酶抑制剂)同时使用,可能会增加布林西多福韦的血药浓度,增加与布林西多福韦相关的毒性。 |
西多福韦(Cidofovir)
| 背景 | 正如之前布林西多福韦部分所述,西多福韦(维思达)是一种DNA聚合酶抑制剂,对正痘病毒有活性。西多福韦已获美国食品药品监督管理局(FDA)批准用于治疗巨细胞病毒视网膜炎。 |
 | |
| 适应症 | 在出现对特考韦瑞治疗无效的严重猴痘感染病例中,或者在无法耐受特考韦瑞且布林西多福韦难以获取的人群中,可以考虑使用西多福韦。 有对丙磺舒或其他磺胺类药物有临床严重过敏史的人群、血清肌酐大于1.5毫克/分升或肌酐清除率小于等于55毫升/分钟的人群,禁用西多福韦。西多福韦不应与其他肾毒性药物联合使用。 |
| 剂量 | 根据巨细胞病毒治疗的获批剂量推断,西多福韦的用药剂量应为每周5毫克/千克,持续2周。此后的维持剂量为每2周5毫克/千克。 成年患者应在使用西多福韦前3小时服用2克丙磺舒进行预处理,然后在输液后2小时和8小时分别服用1克丙磺舒。此外,患者应在输液前1 – 2小时至少接受1升生理盐水补液。如果他们能够耐受液体负荷,在药物输液期间或输液后应立即再接受1升生理盐水补液。 对于儿童,预处理和静脉补液的说明有所不同,应咨询儿科医生后确定。 |
| 使用 | 西多福韦已上市。 |
| 临床注意事项 | 不建议在妊娠的前三个月使用 |
| 不良反应 | 西多福韦具有导致肾损伤和急性肾衰竭的显著风险;为降低这种风险,应在使用西多福韦的同时进行预水化并服用丙磺舒。肾功能不全(肌酐清除率≤55毫升/分钟)者禁用西多福韦,且在治疗期间应监测肾功能。西多福韦还与中性粒细胞减少症有关。临床不良反应包括代谢紊乱、发热、恶心、呕吐、虹膜炎和葡萄膜炎。 |
| 药物相互作用 | 西多福韦绝不应与布多福韦联合使用。西多福韦可能会增加替诺福韦的水平,反之亦然;西多福韦可能会影响克拉德比滨的作用,并增加卡博扎替尼的水平。 |
牛痘免疫球蛋白(维吉夫)
| 背景 | 静脉注射用牛痘免疫球蛋白(VIGIV)是一种源自纯化人血浆的产品。它已获得美国食品药品监督管理局(FDA)批准,用于治疗牛痘疫苗接种后的并发症,包括牛痘性湿疹、进行性牛痘、严重全身性牛痘、有潜在皮肤病者的牛痘感染,以及由具有复制能力的牛痘病毒引起的其他感染。目前尚无关于VIGIV在猴痘治疗中有效性的数据。 |
| 适应症 | 对于严重猴痘感染患者,尤其是那些存在免疫抑制状况、可能无法产生强大抗体反应的患者,可以考虑使用静脉注射用牛痘免疫球蛋白(VIGIV)。对于接触过猴痘且接种疫苗存在禁忌、可能有严重免疫损伤(特别是T细胞功能损伤)的人群,也可考虑将其用于预防。 |
| 剂量 | 静脉注射用牛痘免疫球蛋白(VIGIV)仅通过静脉注射给药,一般剂量为每千克体重6000单位至9000单位。给药时应使用专用输液管路。 可根据症状的严重程度和治疗反应考虑重复给药,但重复给药应基于临床判断,并在获得专家咨询后进行。 |
| 批准 | 静脉注射用牛痘免疫球蛋白(VIGIV)只能通过扩大可及性的研究性新药项目(e-IND),在与美国疾病控制与预防中心(CDC)进行临床咨询后才能获取。如果临床医生的猴痘患者可能会从使用VIGIV中获益,那么该医生应通过电子邮件(eocevent482@cdc.gov)或电话(美国疾控中心应急行动中心,770-488-7100)联系美国疾控中心。在给药之前,必须获得患者的知情同意(获取链接:https://www.cdc.gov/poxvirus/monkeypox/pdf/Attachment-2_VIGIV-Informed-Consent-Form.pdf)。 |
| 临床注意事项 | 对于那些被诊断为IgA缺乏症的患者,应避免使用VIGIV。 |
| 不良反应 | 与静脉注射用牛痘免疫球蛋白(VIGIV)相关的不良事件包括头痛、恶心、寒战和头晕;其他免疫球蛋白输注还可能导致低血压、嗜睡、皮疹和其他影响。应监测患者是否出现由免疫球蛋白引起的罕见过敏反应。 |
| 药物相互作用 | 由于免疫球蛋白的使用会损害疫苗反应,减毒活病毒疫苗(包括麻疹、腮腺炎、风疹、水痘以及JYNNEOS/ACAM2000)应在静脉注射用牛痘免疫球蛋白(VIGIV)给药后约3个月再接种。 由于VIGIV含有麦芽糖,它会干扰一些血糖监测系统的准确性,导致血糖读数假性升高。因此,对于接受VIGIV治疗的患者,应仅使用葡萄糖特异性检测系统来监测血糖。 |
疫苗接种
| 使用的疫苗是什么? | 目前,用于预防猴痘的首选疫苗是JYNNEOS。该疫苗需接种两剂,间隔4周。本页面上的疫苗接种建议是基于2022年猴痘疫情的背景而给出的。 |
| 谁应该接种疫苗? | 推荐接种疫苗的人群分为两类:(1)已接触过猴痘患者的人进行暴露后预防(PEP);(2)可能在未来接触猴痘的人进行预防接种。无论出于何种接种目的,疫苗的剂量和接种时间表都是相同的。 – **暴露后预防(PEP)**:JYNNEOS疫苗适用于最近与猴痘患者有过密切接触的人。接受猴痘暴露后预防的人,理想情况下应在已知接触猴痘后的4天内接种疫苗。如果自接触之日起已超过4天,仍可考虑进行暴露后预防接种-前提是接触发生在14天内,但需注意,在接触后第4天之后接种疫苗,其效果可能不如在接触后4天内接种有效。 – **预防接种**:JYNNEOS疫苗用于对有感染猴痘风险的人群进行预防。被认为风险较高的人群包括男同性恋者、双性恋者、其他与男性发生性行为的男性或跨性别者,且这些人有多个性伴侣、近期曾感染过性传播疾病,和/或近期曾出席或参与过群交活动。应考虑进行猴痘预防接种的人群包括在过去6个月内有上述猴痘暴露风险的人,或预计未来会面临这些风险的人。 |

| |
| 编辑注: 一般来说,当疫苗需求大于供应时,皮内接种优于皮下接种,因为只需五分之一剂量的疫苗就能产生同等的免疫反应。 如果患者已接受皮下接种,第二剂可以选择皮下接种或皮内接种,反之亦然。 对于有形成瘢痕疙瘩病史的患者,应选择皮下接种而非皮内接种,以最大程度降低留疤风险。 | |
推荐的疫苗接种时间表

疫苗剂次的推荐间隔时间为28天;第二剂可在第一剂后最多提前4天或延后7天接种。然而,如果第二剂在24天前或35天后接种,则不建议重新开始疫苗系列。
关于疫苗共同使用的考虑因素有哪些?
疫苗可以与任何其他疫苗同时接种,尽管理想情况下是在不同的肢体接种。
提供者和患者可能会考虑在接种COVID-19疫苗(使用莫德纳、辉瑞或诺华-荷兰国际疫苗公司的疫苗)后等待4周,因为与这些疫苗和活病毒猴痘疫苗ACAM2000相关的罕见副作用心肌炎或心包炎。最近的数据表明,接种JYNNEOS疫苗后发生的心肌炎风险极低。
鉴于免疫力可能减弱,我们建议对符合接种条件的群体接种猴痘疫苗mpox,无论其之前是否接种过猴痘疫苗,包括如果在第一剂和第二剂疫苗之间发生感染时接种第二剂。
保护期限是多久?
疫苗第二剂接种后大约两周预期达到免疫高峰。预期的免疫持续时间尚不清楚。
编辑说明
对于感染猴痘病毒的患者,目前没有建议随后接种猴痘疫苗mpox,包括在第一剂和第二剂疫苗之间发生感染时接种第二剂。
参考文献
美国疾病控制与预防中心(CDC)。科学简报:在2022年IIb分支爆发期间检测和传播猴痘(以前称为猴痘)病毒。2023年2月2日更新[CDC]
西尔克劳夫 M、利纳罗迪斯 A、博伊库 M 等。全细胞冷冻电子断层扫描揭示了痘苗病毒独特的解离中间体。PLoS One. 2007;2:e420。[PMID:17487274]
西尔克劳夫 M,里斯科 C,费尔南德斯 JJ,希门尼斯 MV,埃斯特班 M,鲍姆海斯特 W,卡拉斯科萨 JL。痘苗病毒的冷冻电子断层扫描。美国国家科学院院刊。2005;102:2772-7。[PMID:15699328]
弗莱舍尔 AT,基尔 J,戴维森 M 等。评估人类从感染患者向医疗工作者传播猴痘的情况。临床传染病杂志。2005;40:689-94。[PMID 15714414]
格雷斯斯 MD,特拉克曼 P。痘苗病毒基因组的生命周期。年度病毒学评论。2022;9:239-59。[PMID:35584888]
赫森 CL,孔达斯 AV,毛德林 MR 等。一种潜在的猴痘治疗药物——布利西多福韦,在致死性猴痘病毒动物模型中的药代动力学和疗效。mSphere。2021;6:e00927-20。[PMID:33536322]
兰西奥 E,贾因 N,莱瓦库玛 S,雷尼乌斯 A。人类猴痘病毒(hMPXV)的病毒学概述。病毒研究。2022;322:198932。[PMID:36165924]
劳 M,卡特 GC,罗伯茨 KL,霍利斯黑德 M,史密斯 GL。由配体诱导和非融合性溶解病毒膜。美国国家科学院院刊。2006;103:5989-94。[PMID:16585508]
麦吉 WC,霍斯泰特勒 KY,埃文斯 DH。西多福韦二磷酸盐对痘苗病毒 DNA 聚合酶的抑制机制。抗菌药物化学疗法。2005;49:3153-62。[PMID:16048917]
米查奥 O,奥吉纳 D,蒂塔尼 BK 等。猴痘。柳叶刀。2023;401:60-74。[PMID 36403582]
奥拉夫林 K,托博洛夫斯基 FA,埃尔莫 R 等。根据新药研究方案使用 tecovirimat(Tpoxx)治疗猴痘——美国,2022年5月至8月。美国疾病控制与预防中心《发病率与死亡率周刊报告》2022年第71卷第11期,第1190-1195页。[PMID 36107794]
彼得森BW、哈姆斯TJ、雷诺兹MG、哈里森LH。关于在实验室和医疗工作者中使用猴痘痘苗病毒疫苗预防职业暴露于正痘病毒的建议——美国免疫实践咨询委员会(ACIP)2015年的建议。《发病率与死亡率周刊报告》2016年第65卷第2期,第257-262页。[PMID 26985679]
拉奥AK、彼得森BW、怀特希尔F等。关于使用JYNNEOS(猴痘和猴痘疫苗,活病毒,非复制型)对职业暴露于正痘病毒风险的个体进行预暴露疫苗接种的建议——美国2022年的建议。《发病率与死亡率周刊报告》2022年第71卷第7期,第734-742页。[PMID 35653347]
斯提特勒AK、内茨J、内斯恩斯L等。在致命猴痘病毒感染中,抗病毒治疗比接种猴痘疫苗更有效。《自然》杂志。2006年第439卷第745-748页。[PMID 16341204]
索恩希尔JP、巴卡提S、沃尔姆斯利S等。2022年4月至6月,16个国家的人类感染猴痘病毒。《新英格兰医学杂志》2022年第387卷第679-691页。[PMID 35866746]
作者披露
本指南的作者没有任何披露或利益冲突。
致谢
作者感谢英格·K·达蒙博士、博士、FIDSA对有关猴痘结构、生命周期及药物作用机制部分内容的仔细审阅和意见。感谢Negusse Ocbamicheal,PA-C在指南中呈现的所有临床图片。作者还感谢彼得·哈里森公共卫生硕士的设计和制作工作,以及Cognition Studio, Inc.本指南中所有的插图。
Hits: 115
- 生物类似药药学相似性研究的问题与解答(征求意见稿)
- 麻疹疫苗:世卫组织的立场文件
- 已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(预防用生物制品)
- 生物技术/生物制品在生产工艺变更前后的可比性
- 疫苗生产场地变更质量可比性研究技术指导原则
- 已上市疫苗药学变更研究技术指导原则(征求意见稿)
- 已上市生物制品药学变更研究技术指导原则(试行)
- 青少年免疫接种讨论指南
- 推荐的儿童和青少年免疫计划:美国,2025年:政策声明
- 儿童免疫接种讨论指南
- 建议用于出生至 6 岁儿童疫苗接种计划
- 脑膜炎(细菌性)和脑膜炎球菌病:识别、诊断和管理NICE指南更新摘要
- 轮状病毒疫苗:世卫组织立场文件-2021年7月
- 关于新冠肺炎疫苗抗原成分的声明 2024年12月
- 多糖结合疫苗药学研究及评价技术指导原则(试行)
- 疫苗临床试验统计学指导原则(试行)
- ACIP建议
- 药物临床试验样本量估计指导原则(试行)
- 预防用猴痘疫苗临床试验技术指导原则(试行)
- 美国胃肠病学会免疫抑制药物治疗期间乙型肝炎病毒再激活的预防和治疗指南
- 免疫抑制情况下的乙型肝炎再激活
- 使用自体配子降低生育治疗期间病毒传播风险的建议:委员会意见
- HBV筛查、检测和诊断
- 选择初始 HBV 治疗方案
- 何时开始HBV治疗
- 监测开始接受丙肝治疗、正在接受治疗或已经完成治疗的患者
- 慢性乙型肝炎患者的初步评估
- 疫苗说明书临床相关信息撰写指导原则(试行)
- 预防用猴痘疫苗药学研究技术指导原则(试行)
- 了解疫苗接种率的行为和社会驱动因素 世卫组织立场文件 – 2022年5月
- 2025年至2026年夏季新冠肺炎疫苗使用指南
- COVID-19 体征、症状和疾病严重程度:临床医生指南
- 预防和控制儿童流感的建议,2024–2025:政策声明
- 预防和控制儿童流感的建议,2024–2025:技术报告
- 卡介苗疫苗:世卫组织立场文件——2018年2月
- 减轻疫苗接种疼痛:世界卫生组织(WHO)立场文件—2015年9月
- 霍乱疫苗:世卫组织立场文件 – 2017 年 8 月
- 维生素A用于美国麻疹管理
- 生物制品注册受理审查指南(试行)
- 登革热疫苗:世卫组织立场文件 – 2024 年 5 月
- 白喉疫苗:世卫组织立场文件——2017年8月
- 世卫组织关于甲型肝炎疫苗的立场文件 – 2022年10月
- 世界卫生组织《根除特定类型脊髓灰质炎后遏制脊髓灰质炎病毒指南》 — 全球,2015 年
- 老年人 RSV 疫苗指南
- 英国2025年常规免疫计划
- 麻疹、腮腺炎、风疹疫苗 (PRIORIX):免疫实践咨询委员会的建议 — 美国,2022 年
- 2025 年推荐的7至18岁儿童和青少年免疫接种计划
- 乙型肝炎疫苗:世界卫生组织立场文件(2017 年 7 月)
- 全科医生带状疱疹疫苗接种计划技术指南
- AGA 关于预防和治疗高危人群乙型肝炎病毒再激活的临床实践指南
- 世界卫生组织关于戊型肝炎疫苗的立场文件(2015 年5 月)
- 世界卫生组织立场文件:b 型流感嗜血杆菌疫苗的接种(2013 年 7 月)
- 人乳头状瘤病毒疫苗:世卫组织立场文件(2022年更新)
- 2022年美国动物医院协会(AAHA)推荐的犬类疫苗指南
- 流感疫苗:世卫组织立场文件—— 2022年5月
- 日本脑炎疫苗:WHO 立场文件
- 猴痘临床指南
- 疟疾疫苗:世卫组织的立场文件
- 麻疹疫苗:世卫组织立场文件—2017年4月
- 脑膜炎球菌疫苗:世卫组织关于非洲脑膜炎地带国家使用多价脑膜炎球菌结合疫苗的立场文件,2024 年 1 月
- A 群脑膜炎球菌结合疫苗:更新后的指导意见(2015 年 2 月)
- 百日咳疫苗:世卫组织立场文件 – 2015 年 8 月
- 猴痘的临床管理与感染预防与控制 临时快速响应指南
- 老年人肺炎球菌疫苗接种考虑因素
- 肺炎球菌疫苗:世卫组织关于其在社区爆发环境中使用的立场文件
- 婴幼儿使用的肺炎球菌结合疫苗:世卫组织立场文件——2019年2月
- 脊灰疫苗:世卫组织立场文件 – 2022年6月
- 风疹疫苗:世卫组织立场文件——2020年7月
- 世界卫生组织关于破伤风疫苗的立场文件——2017 年 2 月
- 蜱传脑炎疫苗: 世卫组织立场文件 – 2011 年
- 伤寒疫苗:世卫组织立场文件 – 2018 年 3 月
- 水痘疫苗和带状疱疹疫苗: 世界卫生组织立场文件(2014年6月)
- LC16m8(冻干牛痘减毒活疫苗)天花和 mpox 疫苗:临时指南,2025 年 4 月 22 日
- 世卫组织关于黄热病疫苗的立场文件(2013 年 6 月)
- 黄热病疫苗:世卫组织对分次剂量使用的立场 – 2017 年 6 月
- 世卫组织关于免疫接种以保护婴儿感染呼吸道合胞病毒病的立场文件 2025 年 5 月
- 世卫组织接触者追踪指南
- 世卫组织关于带状疱疹疫苗的立场文件 – 2025 年 7 月
- 世卫组织立场文件:5岁以下婴幼儿肺炎球菌结合疫苗——2025年9月
- 世界卫生组织关于水痘疫苗的立场文件 ——2025 年 11 月
- 减轻疫苗接种时的疼痛:世界卫生组织立场文件 ——2015 年 9 月





 mpox咽炎扁桃体渗出物
mpox咽炎扁桃体渗出物 下唇下溃疡性病变伴继发感染
下唇下溃疡性病变伴继发感染 手上和手指上的斑点
手上和手指上的斑点 手掌上的斑点进化的多个阶段
手掌上的斑点进化的多个阶段 面部受损
面部受损 腹股沟折痕处的红斑性脓疱病变
腹股沟折痕处的红斑性脓疱病变 前臂室性病变
前臂室性病变 生殖器区的脓疱性病变
生殖器区的脓疱性病变
