Contents
要点
- 疫苗在成功保护人们和社区免受传染病侵害方面有着悠久的历史。
- 疫苗接种提高了许多人的生活质量,天花等严重疾病已经被消灭。
- 随着疫苗技术的进步,研究人员可以开发出更好、更安全的疫苗。
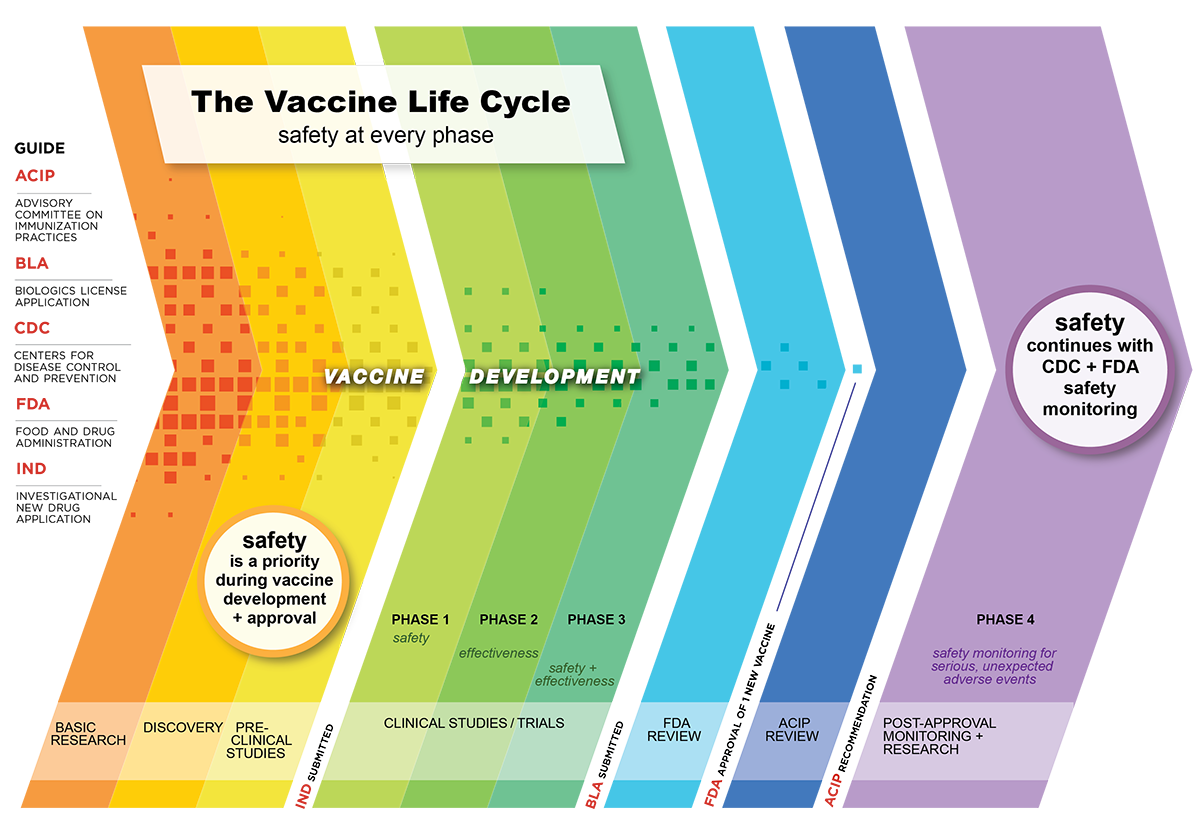
新疫苗是如何开发的
美国美国食品药品监督管理局公司(FDA)生物制品评估和研究中心(CBER)负责管理美国的疫苗使用。
疫苗开发的一般阶段是:
- 研究和发现
- 概念证明
- 测试疫苗
- 制造过程
- 批准疫苗
- 推荐使用疫苗
- 批准后监控安全性
概念证明
在疫苗可以在人体上测试之前,研究人员研究了它引起流感的能力免疫响应像老鼠这样的小动物。在这个阶段,研究人员可能会对疫苗进行调整,使其更加有效。疫苗的有效性很重要,因为它衡量疫苗接种在多大程度上保护人们免受感染、有症状的疾病、住院和死亡等后果的影响。
如果疫苗显示出足够有前景的结果,它将进入临床试验阶段进行人体测试。
测试疫苗
接下来,疫苗进入临床研发阶段,也叫临床试验。为此,研究人员向FDA提交一份研究新药(IND)申请,其中包括动物研究数据、生产技术信息和疫苗质量。疫苗质量很重要,因为它影响着疫苗提供长期和短期疾病保护的效果。
临床开发阶段是一个三阶段的过程,如果疫苗获得FDA批准,可能包括第四阶段。
第1阶段
一小部分人(20到100)接受试验疫苗。在这个阶段,研究人员收集关于疫苗在人体内安全性的信息。这包括了解和识别副作用,并研究疫苗如何有效地引起免疫反应。
第2阶段
临床试验扩大到数百(100-300)名试验参与者,他们的特征(如年龄和身体健康)与疫苗的预期接受者相似。他们还可以包括来自不同背景的人群,以确保不同人群的代表性。
这一阶段提供了关于副作用和风险的额外安全信息,以及关于疫苗如何有效引起免疫反应的更多信息。
第3阶段
临床试验扩大到数千人(1000–3000人)。在这一阶段,研究人员确认疫苗的效果如何,监测常见和不太常见的副作用,并收集信息以支持人类的安全使用。
第4阶段(FDA批准后)
在FDA批准(也称为“许可”)用于普通人群的疫苗后,它可能会进入一个额外的临床试验阶段,有数千名参与者。第4阶段是一项正式的、正在进行的研究,旨在评估新疫苗在更长时间内的安全性和有效性。
有关临床开发阶段的更多信息,请访问FDA的疫苗开发101页面。
疫苗制造过程
在3期临床试验期间,FDA检查了该公司提出的疫苗生产工艺。FDA还将检查生产疫苗的工厂,以确保工厂具备可靠和一致的大规模生产所需的一切。
制造商生产称为“批次”的疫苗批次。这些批次经过一系列测试,以确保不同批次的疫苗一致。FDA要求制造商提交这些测试的数据,以支持成功的生产过程,即使是在批准之后。
批准疫苗
在疫苗被批准在美国使用之前,一家公司向FDA提交生物许可申请(BLA)。BLA包括:
- 临床前和临床数据
- 制造过程的细节
- 关于制造工厂的信息
在审查BLA时,FDA会查看临床试验数据,以确定结果是否表明疫苗是安全有效的。BLA还包含处方信息,即关于疫苗用法、剂量和管理的信息——所有这些都基于科学数据。如果需要,处方信息可以更新,美国食品和药物管理局将审查。从这里,FDA决定是否批准疫苗使用。
要了解更多关于FDA在疫苗审批过程中的作用,请访问FDA的生物许可申请审批流程网页。
VRBPAC
在某些情况下,食品和药物管理局的疫苗和相关生物制品咨询委员会(VRBPAC)提供关于科学数据的输入,以查看疫苗的安全性、有效性和使用。VRBPAC由独立的科学和公共卫生专家组成,他们在公共论坛上讨论拟议的疫苗。
大规模制造
在FDA批准新疫苗后,该公司可以生产更大批量的疫苗分发给公众。FDA将继续监控疫苗生产活动,包括对生产设施的定期检查,以确保遵守FDA的规定。只要制造商持有疫苗产品的许可证,这种情况就会持续下去。
跟踪疫苗质量
FDA通过要求制造商提交每批疫苗的样品进行测试来实时监控疫苗产品的质量。这些测试通常会报告:
- 安全
- 纯度(它只包含必要的成分)
- 效力(疫苗产生预期的免疫反应)
当不同批次的疫苗一致时,FDA可以确认该产品对人类使用仍然是可靠和安全的。
推荐使用疫苗
免疫实践咨询委员会(ACIP)是一个由医学和公共卫生专家组成的团体,他们为在美国使用疫苗提供建议。
ACIP只推荐FDA批准的疫苗。在推荐任何疫苗之前,ACIP还会考虑:
- 在特定年龄接种疫苗的安全性和有效性。一个人的免疫反应会随着他们接种疫苗时的年龄而变化。疫苗制造商必须进行严格的研究,以表明疫苗在特定年龄是安全有效的。
- 疫苗可预防的疾病有多严重。如果没有疫苗,这种疾病可能会严重到可能导致儿童和成人的长期健康问题或死亡。
- 如果没有疫苗,有多少人会得这种病。ACIP的任务之一是确定疫苗是否对公众健康有益。如果一种疫苗不能让很多人受益,他们可能不会推荐给所有人。
在ACIP推荐疫苗后,CDC主任将决定是否批准该推荐。一旦疾病预防控制中心主任批准该建议,它将成为美国疾病预防控制中心安全使用疫苗的官方公共卫生指南。被批准的建议也可能导致疫苗成为美国官方成人和儿童免疫计划的一部分。
有关ACIP在推荐疫苗中的作用的信息,访问ACIP网站.
批准后监控安全性
在疫苗开发和批准过程中,安全性是一个优先考虑的问题。甚至在疫苗被批准并推荐给公众使用后,CDC和FDA使用不同的系统来监控他们的安全,这有助于确保疫苗在美国的持续成功。
VAERS
这疫苗不良事件报告系统(VAERS)是一个早期预警系统,帮助CDC和FDA监控疫苗接种后的问题。谁都可以报告疑似疫苗反应和VAERS的问题。
疫苗安全数据链
这疫苗安全数据链(VSD)是美国疾病预防控制中心(CDC)和几个卫生组织之间的合作项目,允许对疫苗相关数据进行持续监控和主动搜索。
当ACIP推荐在美国使用的新疫苗或对疫苗的推荐进行修改时,VSD将监控这些疫苗的安全性。
CISA
疾控中心的临床免疫安全评估(CISA)项目是疾病预防控制中心和几个医疗中心之间的合作项目,这些医疗中心对特定人群中疫苗相关的健康风险进行临床研究。
Hits: 53
- 免疫类型
- 寻找可信的疫苗信息
- 疫苗里有什么?
- 疫苗可能产生的副作用
- 疫苗是如何开发和批准使用的
- 疫苗基础知识
- 解释疫苗的工作原理
- 按疾病分类的疫苗
- 按年龄推荐的疫苗
- 您和您家人的疫苗接种计划
- 推荐给成人的疫苗接种,易于阅读的格式
- 疫苗资源
- 美国上市疫苗名称
- 当前疫苗短缺和延迟
- 疫苗缩写
- 疫苗时间表
- 按年龄划分的儿童和青少年免疫计划(2024年6月27日更新的附录)
- 免疫计划
- 儿童和青少年免疫计划中的疫苗和其他免疫制剂
- 日程变更和指导
- 在你的网站上整合免疫资源
- 儿童和青少年免疫计划
- 儿童和青少年补充免疫计划
- 按医学指征分列的儿童和青少年免疫计划
- 儿童免疫计划附录
- 儿童免疫接种计划说明
- 儿童免疫计划附录(2024年6月27日更新)
- 成人免疫计划中的疫苗和其他免疫制剂*
- 成人免疫计划
- 按年龄划分的成人免疫计划(附录于2024年6月27日更新)
- 按医疗状况和其他指征列出的成人免疫接种计划
- 成人免疫接种计划说明
- 成人免疫计划附录
- 成人免疫计划附录(附录于2024年6月27日更新)
- 卫生保健提供者免疫计划相关资源
- 紧急使用授权(EUA)概况介绍
- 卫生保健提供者的疫苗交流资源
- 免疫计划资源
- 合作伙伴网站
- 获奖免疫网站
- 要求和法律
- HIPAA和在IQIP和VFC访问期间访问病历常见问题
- HIPAA与围产期乙型肝炎预防常见问题
- HIPAA概述和疫苗管理
- 州疫苗接种要求
- 会议、大会和活动
- Moderna新冠肺炎疫苗概要
- 诺瓦瓦克斯新冠肺炎疫苗摘要
- 辉瑞新冠肺炎疫苗摘要
- GSK RSV疫苗概述
- Moderna呼吸道合胞病毒疫苗概述
- 辉瑞RSV疫苗摘要
- 赛诺菲RSV产品概述
- 免疫和疫苗产品摘要
- 年龄较大的儿童和青少年也需要疫苗!(符合)
- 筛查禁忌症和注意事项
- 回顾免疫史
- 评估所需的免疫接种
- 与父母谈论婴儿疫苗
- 教育家长或患者
- 准备疫苗
- 疫苗是如何工作的?
- 按年龄分列的儿童和青少年免疫计划 2025年
- 按年龄分列的成人免疫计划 2025年
- 疫苗禁忌症和注意事项
- 疫苗接种计划
- 免疫生物制剂的时间和间隔
- 儿童和青少年免疫接种时间表(按年龄划分)(2025年8月7日更新的附录)
- 成人免疫接种时间表(按年龄划分)(2025年8月7日更新附录)
- 医疗保健专业人员:儿童和青少年按年龄划分的免疫接种计划
