Contents
The Status of Vaccine Development Against the Human Cytomegalovirus
摘要
许多针对巨细胞病毒 (CMV) 感染和疾病的候选疫苗正在开发中。上一篇文章[1]提供了有关疫苗接种相关问题的背景和观点,而本文则提供了有关正在积极开发的疫苗的具体情况,正如2018年9月4日至6日在美国国立卫生研究院主办的贝塞斯达会议上所报告的那样。在这里,疫苗开发商提供了他们的候选疫苗的概要,以免疫女性以预防先天性 CMV 疾病,并预防移植器官或造血干呼叫接受者 CMV 疾病的后果。第一作者认为,这些项目大致按其发展阶段的降序排列。
处于先进临床开发阶段的疫苗
默沙东
一种名为 V160 的条件复制缺陷病毒目前正在 MSD 的 II 期临床试验中进行评估。该疫苗源自AD169减毒活病毒,并经过基因改造以恢复gH/gL/pUL128-131五聚体复合物(PC)的表达[2]。病毒基因组中还引入了 2 个必需基因 IE1 和 UL51 的分子开关。疫苗病毒复制可以在生产过程中由合成化合物打开;但接种后无法完成复制周期。
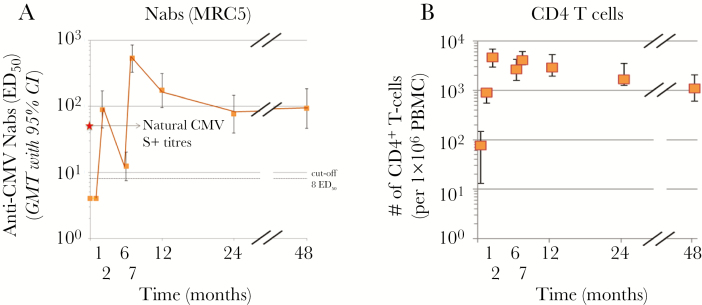
V160 疫苗在 I 期临床试验中显示出有希望的安全性和免疫原性。在第 1 天以及第 1 个月和第 6 个月接种了三剂疫苗。总体而言,该疫苗耐受性良好,在疫苗接种者中未检测到病毒脱落。在血清阴性受试者中,接种疫苗后针对上皮细胞感染的中和抗体 (nAb) 滴度显着增加。在第三剂后 1 个月,V160 诱导的 nAb 滴度与自然感染引起的滴度相当。抗体水平在第 18 个月仍高于基线。还观察到通过干扰素(IFN)γ酶联免疫斑点(ELISPOT)测定的稳健而持久的巨细胞病毒(CMV)IE1和pp65特异性细胞反应[3]。
对 V160 反应的详细分析表明,IE1 和 pp65 特异性 T 细胞主要是具有效应或效应记忆表型的 CD8+。这些 T 细胞通过响应抗原刺激产生多种细胞因子而表现出高度的多功能性。此外,在长期自然血清阳性个体中观察到,疫苗接种诱导了五聚体和糖蛋白 B (gB) 特异性记忆 B 细胞的高频率。V160疫苗接种产生的抗体也能够通过一组临床分离株中和上皮细胞感染[4]。
赛诺菲
赛诺菲巴斯德公司自1990年代以来一直致力于CMV疫苗的开发,特别是来自Towne菌株的gB,该菌株可诱导中和和非nAb[5\u20127]。他们最初制备的缺乏跨膜结构域的可溶性gB来自Chiron公司(现为GSK),并辅以MF59油水佐剂。与安慰剂相比,在CMV血清反应阴性女性中评估候选gB/MF59后,随后一年的感染减少了50%。在研究入组后长达42个月,疫苗组的受试者比安慰剂组的受试者更有可能保持无CMV感染(P = .02)[8]。在青春期女孩中,总体疫苗有效性为43%(P = .20)。无论年龄大小,两剂都足以使血清阴性受试者的疫苗有效性达到45%(P = .08)[9]。最后,在CMV阳性女性和一组CMV血清阳性移植受者中,gB疫苗接种增强了nAb反应[10,11]。 在接受血清阳性供体移植的血清阴性患者中,疫苗接种者的病毒血症持续时间(P = .0480)和更昔洛韦治疗天数(P = .0287)有所减少[11]。
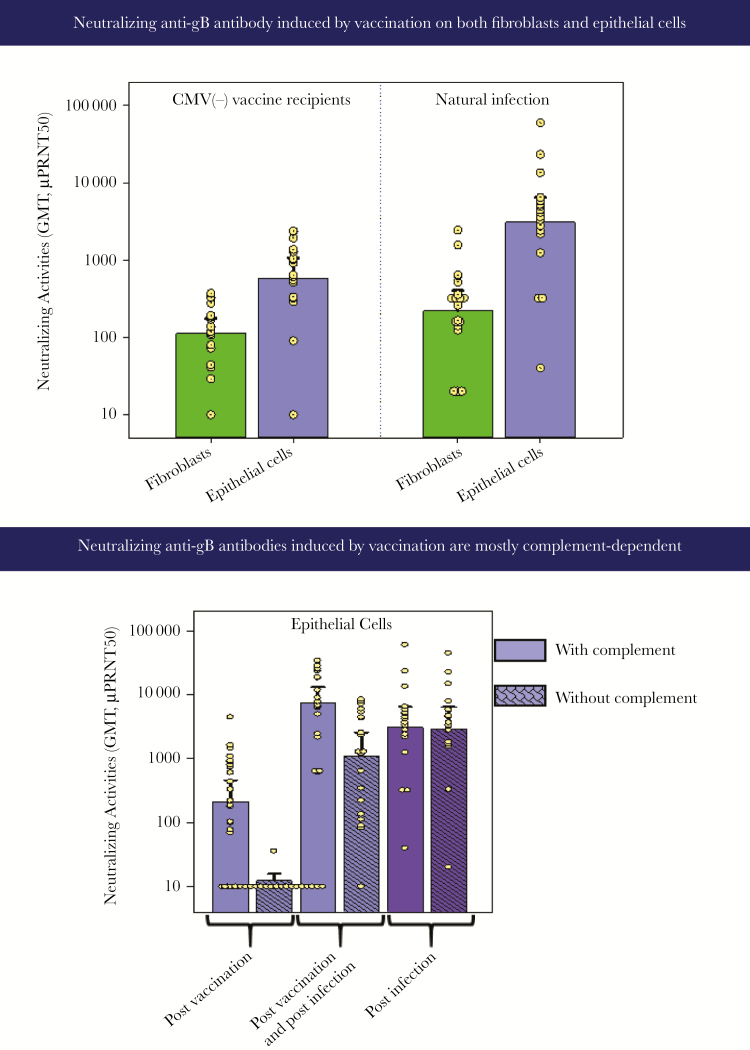
gB/MF59 疫苗能够诱导中和抗 gB 抗体,这些抗体在补体依赖性斑块减少测定中使用成纤维细胞或上皮细胞检测到(图 1)。
图 1.
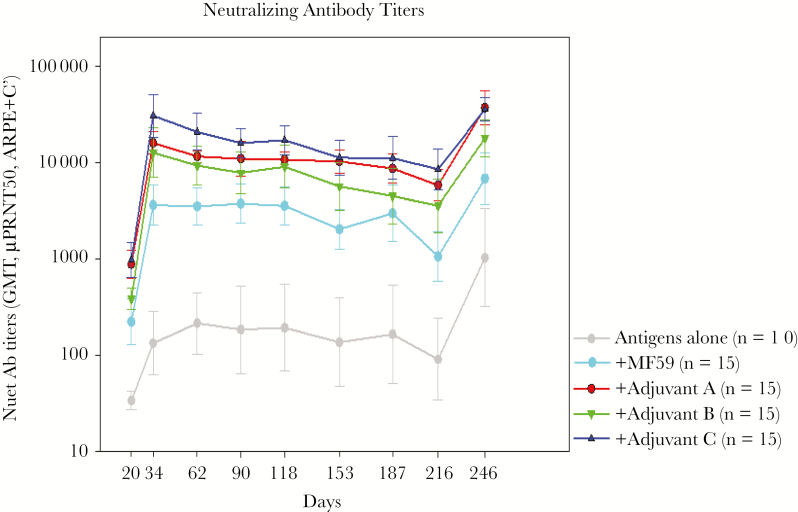
赛诺菲现在正在研究较新的未命名佐剂,这些佐剂可提供更高、更持久的抗体反应,如图 2 所示。此外,CD4+ T 细胞反应受到刺激,这被认为是保护的关键相关性,赛诺菲已经生产了一种重组五聚体,将其添加到最终的疫苗制剂中。基于对母胎传播保护相关性的研究,赛诺菲将进入更多 gB/pentamer 联合疫苗的临床试验。
图 2.
希望之城三联疫苗
巨细胞病毒是同种异体造血干细胞移植 (HCT) 受者的主要并发症。City of Hope选择了一种高度减毒、非增殖的病毒载体,称为改良的安卡拉牛痘(MVA)来插入3种免疫显性CMV抗原:pp65、IE-1-exon4和IE2-exon5[12\u21217]。最近,一项多中心、随机和安慰剂对照的 II 期临床试验完成了对高危 HCT 接受者的疫苗保护效力测试 [18, 19]。
符合条件的患者是 CMV 阳性,并接受来自匹配的相关/无关供体的血液系统恶性肿瘤的 HCT,而无需使用离体或体内 T 细胞耗竭。随机分组后,患者在 HCT 后第 28 天和第 56 天接受三联或安慰剂注射,并观察 1 年。主要终点定义为HCT后第100天之前的任何CMV再激活(≥500个CMV基因组拷贝,gc/mL或1250国际单位[IU]\mL)、低水平再激活促使抗病毒治疗或CMV疾病。该疫苗耐受性良好,在整个 1 年的观察期内,疫苗组与安慰剂组相比,免疫反应显着增加。这些增加包括 CD4 阳性和 CD8 阳性 CMV 特异性 T 细胞。Triplex 在血清阳性 HCT 受者中耐受性良好,在预防病毒血症病例并伴有改善的 CMV 特异性 T 细胞重建方面明显优于安慰剂 [18, 19]。
基于中度风险 HCT 接受者随机 II 期试验的成功,希望之城正在进行一项临床试验 (NCT03560752),其中 CMV 阳性 HCT 接受者的捐赠者将接受 1 次 Triplex 注射,无论是否直接向接受者注射额外注射。该临床试验的前提是在供体内产生 CMV 特异性 T 细胞反应,该反应将转移给 HCT 接受者,并有能力在使用抗病毒药物(例如莱特莫韦)预防之前克服早期病毒血症。将评估对 HCT 接受者的进一步注射,目的是将保护期从 HCT 后 100 天的风险期延长到 200 天。
成功证明三联疫苗在儿科 HCT 受者中的耐受性(clinicaltrials.gov 待定,NCT03354728)将促使另一种方法为供体接种疫苗,类似于成人试验,我们将该试验描述为一种在使用莱特莫韦进行抗病毒预防之前预防早期再激活事件的方法。City of Hope 也处于对各种实体器官移植 (SOT) 受者进行临床研究的计划阶段;然而,该人群的目标是在 CMV 阴性 SOT 接受者中建立初级免疫,以预防 CMV 阳性器官(如肺、肝或肾)接受者的 CMV 病毒血症。
希望之城巨细胞病毒 PepVax
在过去的20年里,人们开展了一项将人白细胞抗原(HLA)A* 0201 pp65495-503细胞毒性T淋巴细胞表位作为疫苗的研究[20\u201224]。最近回顾了导致本文描述的临床试验的临床前研究。辉瑞 CpG 佐剂PF03512676和肽疫苗在 I 期临床研究中进行了测试。该组合在人类中表现出很强的免疫原性。嵌合肽与破伤风表位的结合反应原性低于PADRE(Pan DR表位)肽的反应原性,正如一项针对健康志愿者的研究表明的那样[25]。
一项开放标签 IB 期试验在美国的一个中心进行。符合条件的患者为CMV血清阳性,HLA A* 0201阳性,年龄18-75岁,并接受来自匹配或匹配的无亲缘供体的HCT治疗[26]。
36 名患者被分配到疫苗组或观察组,按 CMV 供体血清状态分层。CMVPepVax 在 HCT 后第 28 天和第 56 天皮下给药(NCT01588015 与 clinicaltrials.gov)。没有证据表明疫苗耐受性降低或意外不良事件(AE)。在中位观察期为 461 天 (P = .015) 的中位观察期内,使用 Kaplan-Meier 估计值发现分配到疫苗组的患者与观察组相比,无复发生存期更好 (P = .015)。此外,与使用 Kaplan-Meier 估计的观察组相比,疫苗组在 180 天内 CMV 再激活显着减少 (P = .039)。使用主要组织相容性复合物I类pp65495-503多聚体以及CD28和CD45记忆标记物进一步分析HCT受者已完成的1B期试验的血液标本,以检测CMV特异性免疫重建[27]。主要发现是,到第 70 天,在 CMV 再激活的高风险时期,联合 T 效应记忆 (TEM) 和 T 效应记忆 RA (TEMRA) 表型占接种疫苗患者中 pp65 特异性 CD8 T 细胞的中位数 90%。在接受 CMVPepVax 且免疫重建较强的患者中未检测到巨细胞病毒病毒血症。具有高频率效应表型的 CMV 特异性 T 细胞的快速重建可能对 IB 期临床试验的良好结果发挥作用。
一项 II 期研究正在进行中,其中正在一项针对 HCT 接受者的多中心研究中评估疫苗的保护益处(clinicaltrials.gov 年NCT02396134)。该临床试验将累积 96 名 HLA A* 0201 CMV 血清阳性 HCT 接受者,他们将接受 CMVPepVax 或安慰剂。还将在 365 天的观察中研究使用多聚体探针策略的巨细胞病毒细胞免疫。这项多中心II期试验的成功将促使与美国食品和药物管理局的II期会议结束,以协调注册试验的进一步开发和规划。
胡基帕制药
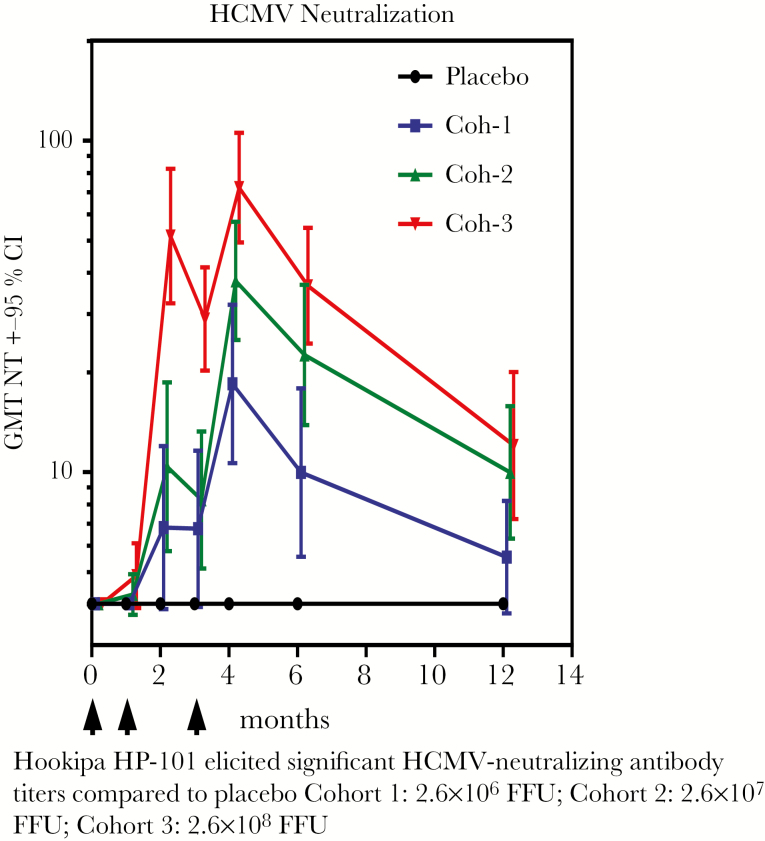
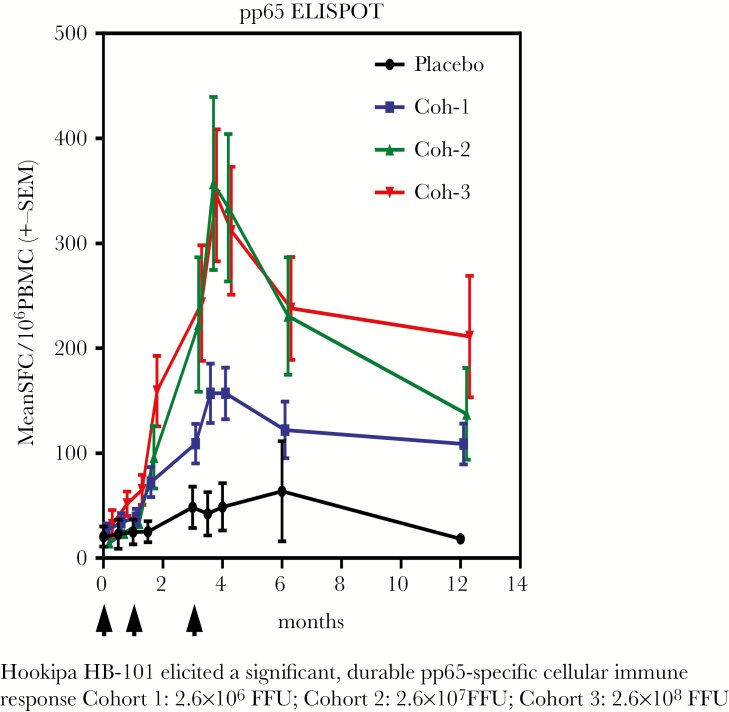
淋巴细胞脉络膜脑膜炎病毒(LCMV)是一种主要对啮齿动物的病原体,但当它变得非传染性时,它可以用作能够诱导抗体和强细胞反应的载体,包括CD8+ T细胞[28]。将 CMV gB 和 pp65 抗原的基因插入 LCMV 载体中。豚鼠CMV系统的临床前研究显示出良好的保护[29]。在 54 名健康成年志愿者(ClinicalTrials.gov Identifier NCT02798692)中进行了一项安慰剂对照、双盲 I 期剂量递增试验。更重要的是,没有诱导LCMV载体nAb。然而,2.6 × 10-7 和 2.6 × 10-8 的剂量诱导了高水平的 CMV-nAb,流式细胞术显示诱导了高比例的多功能人 CMV (hCMV) 特异性 CD4+ 和 CD8+ T 细胞(图 3 和 4)。后者针对 pp65 并表达 IFN-γ、白细胞介素 (IL)-2 和肿瘤坏死因子 (TNF)-α。一项 II 期试验已经开始在 CMV 血清阴性肾移植患者中进行,这些患者将接受血清阳性捐赠者的器官(ClinicalTrials.gov Identifier NCT03629080),以研究免疫原性,次要目标是减少 CMV 病毒血症和使用抗病毒药物。
图 3.
图 4.
安斯泰来
Vical Corporation 开发了一种基于 gB 和 pp65 基因的脱氧核糖核酸 (DNA) 质粒疫苗。在一项针对血行干细胞移植患者进行的II期试验中,该疫苗以具有临床意义的方式降低了CMV病毒载量,与保护相关的免疫反应是产生pp65特异性IFN-γ的T细胞[30]。该产品由安斯泰来公司接管,该公司在接受血清阳性供体肾脏的血清阴性肾移植患者中开展了一项名为ASP0113的类似疫苗的随机试验[31]。移植受者在移植后第 30/60/90/120/180 天随机 (1:1) 接受 5 剂 ASP0113 (5 mg;n = 75) 或安慰剂 (n = 74),并在移植后 10-100 天接受预防性缬更昔洛韦/更昔洛韦。主要终点是第一次研究疫苗注射后第 100 天至 1 年内患有 CMV 病毒血症 ≥1000 IU/mL 的移植受者比例。ASP0113组和安慰剂组之间的主要终点无统计学意义差异(比值比,0.79;95%置信区间,0.43-1.47;P = .307)。各组之间出现治疗中出现的 AE 的移植受者数量相似;然而,与安慰剂相比,ASP0113组的移植受者报告注射部位疼痛的人数更多。ASP0113未证明在这种 CMV 血清阴性肾移植人群中预防 CMV 病毒血症的疗效,但它显示出与安慰剂相似的安全性。应根据确凿的证据表明抗体对此类患者具有保护作用,并且接受ASP0113的患者缺乏任何体液免疫诱导来考虑该疫苗的失败。
因此,有许多候选 CMV 疫苗正在开发中,包括针对预防先天性感染的疫苗和针对预防移植后感染的疫苗。
早期临床开发中的疫苗
葛兰素史克
葛兰素史克还首先开发了一种基于 gB 的疫苗。2008 年,GSK CMV 候选疫苗在 I 期临床研究中进行了评估。候选药物包括基于 AD169 菌株的重组中国仓鼠卵巢 (CHO) 产生的 hCMV gB 蛋白,并删除了跨膜和细胞质结构域。
在 I 期开放试验中,年龄在 18-40 岁 (n = 40) 之间的健康男性 CMV 血清阴性受试者在第 0、1 和 6 个月接受了 3 剂由 gB、15 μg 组成的疫苗,并辅以 AS01E 佐剂系统(由 25 μg MPL、25 μg QS21 和脂质体组成)。经常报告轻度 AE,但观察到的数据表明没有安全问题。3剂疫苗诱导了高亲和力的抗gB免疫球蛋白(Ig)G(存在或不存在尿素的酶联免疫吸附测定)和抗CMV nAb,如使用五聚体缺陷的AD169病毒株在MRC-5成纤维细胞中测量的那样,至少持续到第24个月(最后一次疫苗接种后18个月),并且与在自然感染中观察到的范围相同(来自39名健康受试者的血清在相同的测定中评估)(图5).还评估了细胞介导的免疫;通过流式细胞术定量外周血单核细胞中的CMV gB特异性T细胞,采用细胞内细胞因子染色产生IFN-γ、IL-2和TNF-α以及CD40L的表达。诱导了强而持续水平的 gB 特异性 CD4+ T 细胞,其中大多数同时表达 CD40L 和 IL-2。根据 ELISPOT 测定,还在 24 个月时测量了 CMV gB 特异性抗体分泌 B 细胞的稳健水平。在第 48 个月(第三次接种疫苗后 42 个月)重新评估了 27 名接种疫苗的受试者的血清中成纤维细胞 nAb,这些数据证实了免疫反应的良好持久性,与自然感染诱导的免疫反应相当。在这个较晚的时间点,CD4+ T细胞也以高频维持(图6)。
图 5.
图6.
然而,gB已不再被认为足够,CMV病毒学的科学领域现在已将重点转向hCMV PC,它已被证明是人血清中nAbs的主要靶点[32]。研究表明,PC特异性抗体在中和上皮细胞进入方面比gB抗体更有效[33,34],并且母体PC抗体与较低的胎儿感染风险相关[35]。最近发表的PC晶体结构为葛兰素史克(GSK)对重组PC进行详细研究和设计提供了基础,以评估作为疫苗抗原[36]。最近阐明的 PC 很可能与 gB 一起成为关键的疫苗抗原,建立在重组 gB 和 AS01 佐剂产生的有希望的数据之上。
莫德纳
封装在脂质纳米颗粒 (LNP) 中的修饰信使核糖核酸 (mRNA) 已成为快速开发疫苗的多功能平台。利用mRNA平台,Moderna开发了多抗原hCMV疫苗,该疫苗包含编码全长hCMV gB和gH/gL/UL128/UL130/UL131A复合物(五聚体)或显性T细胞抗原pp65以及gB和五聚体的多个mRNA[37]。在体外显示 gB 和五聚体均在细胞表面表达,并使用一组构象依赖性单克隆抗体验证了五聚体的正确组装。
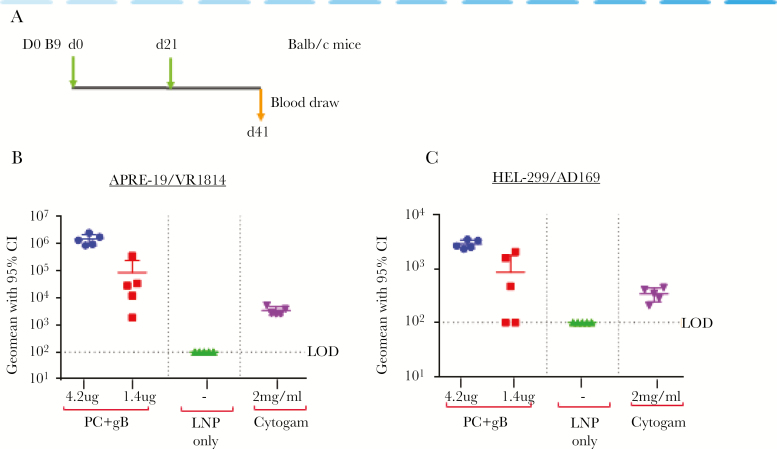
使用这些 mRNA/LNP 疫苗进行的免疫研究在小鼠和非人灵长类动物中都引发了有效且持久的 nAb。值得注意的是,在同一 LNP 中结合多种抗原不会干扰 nAb 反应。CytoGam 是一种来自 CMV 血清阳性供体混合血浆的 CMV 免疫球蛋白,被批准用于预防移植患者 CMV,用作中和测定中的对照。在小鼠中最高剂量下,hCMV mRNA gB+pentamer 疫苗产生的中和反应在估计的临床水平上比 CytoGam 高 20 到 100 倍(图 7)。此外,五聚体+gB+pp65 mRNA疫苗引发了对五聚体的强效T细胞反应。然而,与 pp65 mRNA 疫苗相比,该疫苗引起的 T 细胞对 pp65 的反应减弱,这表明 T 细胞表位竞争。在五聚体存在下,T细胞对pp65的反应受到抑制,通过对pp65进行异源启动/加强免疫,然后接种五聚体+gB+pp65 mRNA疫苗[37]。因此,mRNA/LNP 平台提供了混合和匹配抗原的灵活性,以实现抗体和细胞反应的最佳平衡。
图7.
Moderna 的 gB+pentamer mRNA 疫苗目前正在美国进行一项 1 期研究进行评估。该试验是一项随机、观察者盲法、安慰剂对照、剂量范围研究,旨在评估不同剂量水平的疫苗在 hCMV 血清阳性和血清阴性健康成人中的安全性和免疫原性。免疫原性评估包括针对五聚体和 gB 的抗体滴度、针对上皮细胞和成纤维细胞 hCMV 感染的 nAb 滴度以及抗原特异性 T 细胞反应。
VBI 疫苗
通过用编码鼠白血病病毒 Gag 的质粒转染 HEK 293 细胞,生产了一种基于包膜病毒样颗粒 (eVLP) 的 gB 疫苗,从而产生颗粒。编码目标糖蛋白的共转染质粒使从细胞表面出芽的颗粒能够将糖蛋白掺入脂质双层中。使用表达 CMV gB 蛋白胞外结构域的 eVLP 融合到水疱性口炎病毒 G 蛋白 (gB-G) 的跨膜和细胞质结构域。
在过去使用基于 gB 的疫苗的临床试验中观察到的中和活性的广度一直不是最佳的,这可能是由于未能引发针对与强效和广泛中和活性相关的表位的抗体反应。CMV gB蛋白有5个抗原结构域[38,39]。 几乎100%的CMV感染者会产生针对AD-1结构域的抗体,尽管这些抗体通常没有中和活性[40];相比之下,在大多数 CMV 血清阳性受试者中观察到的针对 AD-4 和 AD-5 结构域的抗体反应通常具有中和活性。AD-2结构域的免疫原性较差[40,41],但针对2个表位中的1个(位点I)的抗体具有有效且广泛的中和活性,其基础是阻断病毒细胞融合但不结合的能力[42]。针对AD-2的抗体反应与SOTs的CMV血清阳性受者病毒血症发生率降低相关[43],AD-2抗体反应与移植后更好的结局相关[40],即使没有针对PC的抗体。
对表达天然 gB 与 gB-G 的 eVLP 的电子显微镜分析表明存在不同的结构,临床前研究表明,使用 gB-G eVLP 免疫诱导对成纤维细胞和上皮细胞 CMV 感染的中和活性远大于使用同等剂量的 gB eVLP 或重组 gB 蛋白进行免疫。最近对 gB 与 gB-G eVLP 的表位图谱表明,针对 AD-2 表位的单克隆抗体与 gB-G 独特结合,但不与 gB eVLP 结合。
一种基于 gB-G eVLP (VBI-1501) 的候选 CMV 疫苗已在一项人体临床研究中进行了评估 (clinicaltrials.gov NCT02826798)。将 18 至 40 岁的健康 CMV 血清阴性成年人随机分配到 4 种剂量制剂中的一种(含明矾的 0.5 μg、1 μg 或 2 μg gB-G 含量)或 1 μg gB(不含明矾),或在第 0、56 和 168 天给予安慰剂。结果测量是针对成纤维细胞和上皮细胞 CMV 感染的主动和主动 AE、严重 AE (SAE)、gB 抗体结合滴度和 nAb。在 128 名参与者中,最常见的局部和一般 AE 分别是疼痛和头痛。没有发生 SAE 或提款。在第 2 剂和第 3 剂后观察到 nAb 滴度的提高,明矾佐剂 2.0 μg 剂量接受者的滴度最高。100% 的 2.0 μg 剂量受者中存在成纤维细胞 nAb,31% 中存在上皮细胞 nAb。上皮细胞nAb与较高的几何平均gB结合滴度相关,成纤维细胞和上皮细胞nAb滴度之间存在相关性。总之,一种新型 CMV gB 的 eVLP 表现在健康血清阴性成人中以非常低的剂量具有免疫原性,并且未观察到安全信号。计划于 2019 年底进行 II 期剂量范围研究。
临床前开发中的疫苗
辉瑞
辉瑞公司假设,优异的抗PC中和反应比gB免疫更能预防CMV的水平传播[44]。正如将在未来的出版物中描述的那样,以及在美国国立卫生研究院研讨会上进行高级别总结的那样,为了在临床前检验这一假设,辉瑞在特定的无病原恒河猴中开发了一种严格的恒河猴 CMV (RhCMV) 口服攻击模型,以回答以下问题:(1) 用 PC 免疫是否可以防止 RhCMV 水平传播?(2)在PC中添加gB或表达pp65-2的质粒是否会增加疗效?
猕猴单独接受 3 剂佐剂 QS21 作为对照、QS21 佐剂 RhCMV PC 或 QS21 佐剂 PC,含 gB 和表达 pp65-2 的质粒。免疫接种后,每周口服接种 5 次 8 ×10 个 5 个斑块形成单位的 RhCMV(菌株 UCD52,与抗原同源),这种方案始终感染大多数(但不是全部)未接种疫苗的猕猴。
该疫苗引起的 RhCMV nAb 滴度与自然 RhCMV 感染引起的 IFN-γ 阳性 ELISPOT 反应相似,并且 pp65 特异性 IFN- 阳性 ELISPOT 反应更大。然而,该疫苗并不能防止口服接种病毒的感染或阻止病毒传播到泌尿道。因此,针对亚基/DNA疫苗中PC、gB和pp65佐剂组合的高滴度nAb和T细胞反应不能防止口服RhCMV感染或随后的病毒传播。RhCMV 的免疫逃避,通过类似于允许 RhCMV 在初次感染后再次感染的机制,也可能允许 RhCMV 在对猕猴进行免疫接种后感染。
在这些研究中,没有测试对垂直传播的潜在保护。静脉输注强效RhCMV超免疫球蛋白可抑制静脉接种的RHCMV在RhCMV血清阴性、妊娠、CD4+ T细胞耗尽的恒河猴中的垂直传播,并防止胎儿丢失[6]。含 PC 的疫苗引发的恒河猴上皮细胞的中和滴度相当于输注高效 HIG 后达到的血清中和滴度。因此,未来研究可能有必要测试含 PC 的配方是否可以防止垂直传播。
印度血清研究所
Pepperl等[45]利用了CMV在细胞培养中产生所谓的致密体的优势:含有许多重要CMV抗原的非感染性包膜颗粒。这种方法正在由世界上最大的疫苗制造商之一开发。致密小体已被证明可以在不使用佐剂的情况下在转基因人HLA-A2分子的小鼠中诱导抗体和细胞毒性T细胞[45]。考虑到先天性CMV感染在发展中国家也很常见,血清研究所的参与很重要[46]。
结论
因此,有许多候选 CMV 疫苗正在开发中,包括针对预防先天性感染的疫苗和针对预防移植后感染的疫苗。II 期试验的早期证据表明,接种疫苗可以预防在自然界中暴露于 CMV 的血清阴性女性感染 CMV,并且有确凿的证据表明,血清阴性实体器官受者和血行干细胞受者的 CMV 疾病是可以预防的。目前还没有 III 期数据,但许多候选疫苗正在推进,其中包括几种旨在预防先天性 CMV 疾病的疫苗。
笔记
补充赞助。本补充由 NIAID 和 NICHD 赞助。
潜在的利益冲突。如果表明,提交人是开发候选疫苗的公司的雇员。S. A. P. 博士是许多开发 CMV 疫苗的公司的付费顾问。D. W. 是默沙东的员工和股东。D. W. 还从普林斯顿大学拥有的 CMV 五聚体复合物专利中获得了特许权使用费。A. O. 赛诺菲巴斯德的员工和赛诺菲的股东。AC 是 Moderna 的员工。S. M. 是葛兰素史克集团公司的雇员和股东。D. A. 是 VBI Vaccines 的员工和股东。P. R. D. 是辉瑞的员工和股东。在研究进行期间,CNK 博士报告了 Hookipa 的咨询、默克的咨询/裁决、葛兰素史克的咨询、夏尔的咨询/裁决、Oxford Immunotec 的咨询、QIAGEN 的咨询、安斯泰来的裁决。所有作者均已提交 ICMJE 潜在利益冲突披露表。
Plotkin SA, Wang D, Oualim A, Diamond DJ, Kotton CN, Mossman S, Carfi A, Anderson D, Dormitzer PR. The Status of Vaccine Development Against the Human Cytomegalovirus. J Infect Dis. 2020 Mar 5;221(Suppl 1):S113-S122. doi: 10.1093/infdis/jiz447. PMID: 32134478; PMCID: PMC7057802.
Hits: 86