Contents
Strategies for Improving Vaccine Communication and Uptake
- 理解疫苗接种和疫苗犹豫的概念和潜在决定因素。
- 理解疫苗犹豫和可预防医疗费用之间的关系。
- 当出现犹豫时,识别并解决护理人员的具体问题(如疫苗安全)。
疫苗接种:定义和理解疫苗犹豫的常见原因
在讨论疫苗接种时,明确所用的术语至关重要。一个有用的方法是在态度、意图和行为框架内对术语进行分类。疫苗态度表明一个人对疫苗接种的想法和感受。1疫苗态度塑造疫苗意图,疫苗意图反映了一个人对这些态度采取行动的意愿。反过来,疫苗的意图又塑造了疫苗的行为,疫苗的行为包括一个人对疫苗接种所采取的行动。
疫苗信心,描述了对疫苗是安全、有效的,并且是值得信赖的医疗系统的一部分的信念,2,–4是疫苗态度。疫苗犹豫,一种对接种疫苗感到矛盾或反对的动机状态,是一种疫苗意向。疫苗接种,定义为接受疫苗,是一种疫苗行为。获得疫苗的障碍以及有意拒绝和延迟接种疫苗是疫苗行为的两个重要预测因素。
疫苗犹豫可能导致一系列行为,从拒绝所有疫苗接种到接受所有推荐的疫苗接种,同时仍然对疫苗接种有所顾虑。1,5,6美国疾病控制和预防中心(CDC)全国免疫调查发现,2019年,20%的美国父母报告说他们“对童年注射犹豫不决”。7关于父母对疫苗的态度、意图和行为的几个分类框架已经出现,如所示表1.8一小部分家长(1%到3%)拒绝所有疫苗,可能对疫苗有更固定的信念和态度。5,9,–12一项疫苗安全数据链(VSD)研究证实,大多数儿童按时接受了早期儿童疫苗接种(2017年出生的儿童为68.4%),并指出,每次就诊时持续接受少于建议数量的疫苗更常见(2.04%),而在出生后2年内没有接受疫苗的儿童数量较少,但正在增加(2004年为0.35%,2017年为1.28%)。13在新冠肺炎疫情后的几年里,按时常规疫苗接种率下降14,–17;然而,目前还不确定这种下降是否更多地与错过井访预约有关,而不是疫情期间疫苗犹豫的变化。一些美国和加拿大的调查显示,自疫情开始以来,疫苗接种的犹豫没有明显改变。18,–20与少数坚决拒绝任何疫苗的人相反,大多数犹豫不决的父母可能对疫苗接种决定有一些矛盾心理,许多人可能会接受关于常规儿童疫苗的信息和指导,以提高他们的信心和他们的孩子的摄取。
表1 父母对疫苗的态度、意图和行为的范例原型5,11
| 示例原型 | |
|---|---|
| 免疫支持者 | 父母认识到疫苗的重要性,给孩子接种疫苗。父母通常与他们的卫生保健提供者有很强的关系,或者对卫生保健系统有很强的信任。 |
| 相处融洽 | 父母不会质疑疫苗,通常会给孩子接种疫苗,但可能缺乏疫苗的详细知识。 |
| 谨慎的接受者 | 父母可能对疫苗有点担心,但最终会给孩子接种疫苗。 |
| 中立 | 父母对疫苗非常关注。父母可能对疫苗有所了解,或者花时间考虑过疫苗。父母可以给孩子接种部分或全部疫苗,也可以拒绝或延迟接种疫苗。在疫苗信息方面,父母可能不信任他们的卫生保健提供者。 |
| 拒绝者 | 父母拒绝为他们的孩子接种所有疫苗。他们拒绝的原因可能包括对医疗系统的不信任、安全顾虑以及宗教或其他个人信仰。 |
世界卫生组织的框架将疫苗犹豫不决的决定因素分为情境因素、个人因素和群体因素,以及疫苗因素(表2)。3在上下文层次上,获得可靠的疫苗信息来源和错误信息的传播都可能影响对疫苗及其所预防疾病的信念。个人和群体对“天然”或“有机”健康方法的偏好也与疫苗犹豫有关,21,–24这些偏好往往与对卫生保健专业人员和医疗系统的不信任相重叠。22,–25疫苗态度背后的心理因素包括重视自主性、共谋思维和人们如何权衡概率和当前及未来风险的认知偏差。26,–29相比之下,社会规范有助于促进疫苗接种。30,–32接种疫苗也与感知的疾病风险或易感性密切相关。33
表2 疫苗犹豫矩阵的决定因素(世界卫生组织)3
| 决定因素 | |
|---|---|
| 背景影响:来自历史、社会文化、环境、健康、系统或制度、经济或政治因素的影响 | 通信和媒体环境; 有影响力的领导人、免疫计划守门人以及反对或支持接种的游说团体; 历史影响; 宗教、文化、性别或社会经济; 政治或政策; 地理障碍; 对制药行业的看法 |
| 个人和群体影响:来自个人对疫苗认知的影响或社会或同伴环境的影响 | 个人、家庭和/或社区成员的疫苗接种经历,包括疼痛; 关于健康和预防的信念、态度; 知识和意识; 保健系统和提供者——信任和个人经验; 风险和收益(感知的、启发式的); 免疫作为一种社会规范,而不是不需要或有害的 |
| 疫苗或接种——具体问题:与疫苗或接种直接相关 | 风险和益处(流行病学和科学证据); 引进新疫苗或新配方或对现有疫苗的新建议; 管理方式; 疫苗接种计划或交付模式的设计(如常规计划或大规模疫苗接种运动); 疫苗和/或疫苗接种设备供应的可靠性和/或来源; 疫苗接种时间表; 成本; 建议的力度和/或知识库和/或卫生保健专业人员的态度 |
改编自:世界卫生组织,SAGE工作组。SAGE疫苗犹豫工作组的报告。世界卫生组织;2014.
相反,拒绝疫苗可能与较低的感知疾病风险相关,并与个人和社区层面的麻疹、百日咳和肺炎球菌感染等疾病的风险增加相关。34,–37拒绝接种疫苗的地理聚集进一步增加了某些社区爆发传染病的风险,即使在州或国家一级的疫苗接种率总体上仍然很高。36,38,–40例如,2010年代美国的大规模麻疹爆发经常发生在拥有共同宗教和文化信仰的疫苗接种不足的社区。41,–46
在新冠肺炎疫情期间,常规儿科疫苗接种中断,导致许多儿童容易感染疫苗可预防的疾病,并导致美国和世界各地更多地方容易爆发疫情。47,–50尽管证据仍不确定,51,–54疾病复发可能有助于提高疫苗接种率,媒体对近期麻疹爆发的报道与更多的疫苗前沟通和积极的父母疫苗态度有关。51,53,–56相比之下,儿科新冠肺炎疫苗的接种一直很慢,因为在这两种疾病的持续传播、不断发展的建议和错误信息中,家长们正在考虑针对新疾病的新疫苗。新冠肺炎提醒人们,疾病流行只是影响疫苗接受度的众多因素之一。
基于历史和当前歧视的对卫生系统的不信任,以及不平等的获得保健的机会,是造成疫苗接种方面种族和族裔差异的相互交织的挑战。57,58尽管在减少儿童疫苗接种覆盖率的种族、民族和社会经济差异方面取得了进展,59新冠肺炎·疫情清楚地表明还有多少工作要做。60,61减少差异和促进疫苗接种的解决方案必须建立信任,改善所有社区获得护理和信息的机会,增加科学家和卫生保健专业人员队伍的多样性和代表性,62并承认结构性和人际种族主义对健康差距的贡献。有希望的方法包括与可信的信使合作,促进疫苗接种和社区参与,以了解疫苗接种的障碍,并利用现有的信息和联系来源。32,63与来自历史少数群体的父母进行疫苗对话可能还需要更明确地承认这些群体经历的医疗虐待和排斥,以及这对医疗和公共卫生当局的信任产生的破坏性影响。
拒绝接种疫苗的财务影响
当人们对疫苗失去信心时,影响是广泛的。除了对儿童和公共健康、医疗实践和医生-父母关系的影响(在政策部分后面讨论),拒绝接种疫苗还会产生巨大的经济成本。拒绝接种疫苗和推迟接种疫苗对儿童造成的经济影响分为四类:(1)社会,承担应对疫苗可预防疾病影响的额外成本;(2)个人病人和家庭,他们面临照顾病人的相关费用;(3)私人和公共付费者,承担与提供护理相关的费用;和(4)儿科医生和其他儿科临床医生,他们在日常工作流程中面临着关于疫苗安全性和有效性的长期讨论的成本。虽然这些成本不一定是为单个儿童接种疫苗的理由,但它们确实对家庭和整个社会产生了影响,需要得到承认。
社会成本
许多疫苗可预防疾病的发生是可报告的事件,64引发旨在确定其来源和潜在传播的公共卫生反应。这种报告之后通常会迅速实施大规模公共卫生干预措施,包括疾病监测、交流和疫苗接种计划。这种反应的费用由负责疾病调查和控制的公共卫生机构承担,通常是地方和州卫生部门;最终,因为这些是政府实体,这些成本由纳税人承担。
个体成本
当孩子生病而不能去他们通常的学校或儿童保育机构时,除了孩子失去教育机会的成本之外,父母经常必须放弃工作来提供照顾。虽然这是任何儿童疾病的情况,但如果疾病是疫苗可预防的,这些都是可以避免的间接成本。在纽约市麻疹爆发中,81%的感染者年龄在18岁或以下,中位年龄为3岁,46这意味着这些家庭失去了大量的工作和收入。这一代价可能会从有受感染儿童的家庭扩大到那些其子女受到感染的家庭,甚至在疫情爆发时扩大到整个教室或学校。这一负担往往不成比例地落在资源已经不足和缺乏替代性护理安排的人口身上,因此,对这些群体的家庭财务有更大的影响。
付款人成本
疫苗接种项目的直接成本效益比估计至少为1:3(如果考虑间接成本,则为1:10),70这表明,每1美元没有用于疫苗接种,支付者将花费3美元来提供医疗服务。尽管这种增加的支出最终也是由社会资助的,但直接影响的是支付者,包括自我保险和公共资助项目(如医疗补助)的雇主,总的净增加成本可归因于每剂错过的疫苗。此外,因拒绝而错过的免疫接种将影响付款人的医疗保健有效性数据和信息集(HEDIS)评分,从而影响付款人的营销和盈利能力。
儿科实践成本
儿科实践在处理以三种方式拒绝给孩子接种疫苗的家庭时可能会产生费用。首先,当未接种疫苗的患者出现后来被诊断为疫苗可预防疾病的症状时,医疗机构必须实施控制程序,包括接触追踪、增强的个人防护设备和卫生程序,以及可能影响可能就诊患者数量和就诊所需预防措施的工作流程变化。这些费用不是微不足道的。71
第二,在基于价值的护理模式下,儿科医生可以根据绩效指标获得很大一部分报酬,其中之一是完成儿童和青少年免疫接种。目前的绩效工资模式没有认识到疫苗拒绝对儿科医生指标的影响,这可能导致支付减少,尽管儿科医生尽了最大努力。
最后,儿科医生为那些对疫苗犹豫不决的父母提供咨询所需的时间增加了成本。根据1986年国家儿童疫苗伤害法案的要求,儿科医生建议他们的病人和家庭接种疫苗。72在2010年接受调查的儿科医生中,超过一半的人花了10到19分钟向父母提供疫苗咨询,几乎十分之一的人花了20分钟以上,通常每天几次。73支付给儿科医生的咨询费用包含在疫苗注射费用中。74然而,咨询费用要求在咨询时实际接种疫苗,因此咨询和与拒绝接种疫苗的父母讨论是无偿的。然而,自2021年12月1日起,医疗保险和医疗补助服务中心实施了一项政策,即新冠肺炎疫苗咨询将由所有医疗补助计划覆盖,并且今后,所有儿童疫苗的疫苗咨询就诊(无论是否接种疫苗)将由早期和定期筛查、诊断和治疗计划覆盖。75各州正在以不同的要求实施这一法规,但最终的影响将是减少儿科医生的非补偿咨询时间。然而,私人保险公司是否采用这一政策还不确定,因此当儿科医生花时间咨询私人保险的患者或父母,而疫苗最终被拒绝时,还没有办法补偿在咨询中花费的时间和精力。这种额外的无补偿时间对办公室工作流程产生负面影响,减少了医生在门诊期间可以护理的患者数量,并造成了医生受到经济激励以确保接种疫苗的误解。此外,近一半的儿科医生报告说,父母要求“分发”疫苗降低了他们的工作满意度76;这些要求也有可能增加精神痛苦的比率,77这可能导致倦怠,78对儿科劳动力产生不利影响。对于选择“分散”疫苗的家庭来说,多次带孩子也可能对其他办公室工作人员(如护士)产生负面影响,并导致后勤和调度负担。
疫苗安全性和解决问题的策略
在拒绝疫苗或对疫苗表示犹豫的父母中,安全性一直是首要关注的问题。5,9,73,79因此,儿科医生和其他护理儿童的临床医生必须了解紧急使用授权和疫苗许可、疫苗安全和疫苗安全监控的流程,以解决父母的问题和顾虑。因为疫苗通常是给健康人接种以预防疾病,所以它们比其他药物具有更高的安全标准。80在疫苗成为常规免疫计划的一部分之前,有一个多步骤的过程,包括临床前动物研究、人体临床试验、向美国美国食品药品监督管理局(FDA)提交许可申请(或如新冠肺炎疫苗的情况,紧急使用授权)、FDA的批准或授权,以及免疫实践咨询委员会(ACIP)和CDC的使用建议。81,–85在每一个步骤中,安全都是首要考虑的因素。
许可前临床试验和临床开发阶段的进展受FDA的监督。许可前1期试验的目的是了解疫苗的安全性和副作用,通常在20至100名健康志愿者中进行。如果在这一阶段没有安全问题,疫苗可以进入第二阶段试验,通常在数百名志愿者中进行,除了进一步扩大对疫苗安全性的了解外,还要评估免疫原性。对于具有可接受的2期安全性数据和有希望的免疫原性数据的疫苗,可以进行3期试验,通常有数千名志愿者参与,以评估在更大人群中的有效性和不太常见的不良事件的检测。这些预许可阶段通常按顺序进行,但发展阶段重叠也并不罕见。在三期试验完成后,疫苗制造商可以向FDA提交许可申请。然后,美国食品和药物管理局审查申请;如果它确定疫苗是安全有效的,并确认生产和设施信息确保产品质量和一致性,它可以授予使用许可证。FDA对其批准的疫苗许可申请的审查在FDA网站上公开发布。然后,ACIP检查提交给FDA的可用数据以及其他贡献数据,以确定疫苗接种的益处是否超过目标人群的任何可能风险。尽管一些审议是在FDA和CDC内部进行的,但这一过程是高度透明的,公开的ACIP会议提供了书面或口头公开评论的机会。86根据紧急用途授权和随后的ACIP建议,新冠肺炎疫苗的授权程序与完全许可的疫苗产品非常相似,尽管由于疫情的紧急性质,时间表加快了。87
尽管许可前试验可以在疫苗接种后的有限时间内识别常见的不良事件,但进行足够大的临床试验来检测所有罕见的疫苗相关事件(即每10 000名疫苗接种者中< 1起事件)是不可行的。因此,美国已经建立了一个强有力的上市后疫苗安全监测系统。可以说,最广为人知的两个组成部分是疫苗不良事件报告系统(VAERS)88还有VSD,89,–92这两个机构都成立于1990年。VAERS是一个由CDC和FDA管理的自发监测系统,是美国疫苗不良事件的早期预警系统。虽然VAERS对疫苗安全监测至关重要,但它不能普遍评估因果关系。因此,VAERS是一个假说生成系统。另一方面,由疾病预防控制中心和13个综合医疗保健组织合作的VSD是一个假设测试系统并能评估因果关系。使用具有高度准确数据的电子健康记录(EHRs ),如果在其自身的监测、VAERS或其他地方发现了可能的疫苗不良事件的信号,则可以在VSD进行进一步的研究,以使用几种不同类型的方法确定是否存在关联,例如病例对照(比较接种疫苗和未接种疫苗个体中可能的不良事件的发生率)和自身对照病例系列(其中仅使用接种疫苗前后的风险区间检查经历了感兴趣结果的个体)。
VSD已经能够识别接种疫苗后罕见的不良事件,例如麻疹、腮腺炎和风疹(MMR)疫苗与免疫性血小板减少性紫癜之间的关联93以及接种麻疹、腮腺炎、风疹和水痘疫苗后热性惊厥风险的增加。94也许更重要的是,VSD已经能够证明许多疫苗与所谓的疫苗不良事件之间没有关联。95,–100FDA的积极监督工作包括生物制品有效性和安全性(BEST)系统,101覆盖超过1亿人,包含大规模索赔数据、EHR和链接的索赔-EHR数据库。最好的系统利用多种数据源,实现快速查询以检测或评估不良事件,以及研究以回答疫苗的特定安全问题。
除了VSD、VAERS和BEST,美国还有其他几个监测疫苗安全性的重要系统,包括临床免疫安全性评估项目(CISA)、102通过国防部的各种监测系统,以及随着新冠肺炎疫情病毒的爆发,v-safe疫苗接种后检查。103美国还通过与世界卫生组织、欧洲药品管理局和泛美卫生组织等机构的伙伴关系,在国际上合作研究疫苗安全。美国几个主要疫苗安全监测系统的详细信息见表3.
表3 美国主要疫苗安全监测系统的例子
| 监控系统 | 数据源 | 受监测人口 | 管理 | 特征 | 强项 | 限制 |
|---|---|---|---|---|---|---|
| 疫苗不良事件报告系统(VAERS) | 在线报告系统; 法律要求卫生保健提供者和疫苗制造商在接种疫苗后报告某些事件 | 整个美国 | 美国食品药品管理局,美国疾病控制中心 | “国家预警系统”; 被动、自发的报道; 假设生成; 85%到90%的报告是非严重的; 对严重的报告进行跟进 | 接受任何人的报告; 所有数据都是公开的 | 一般无法评估因果关系; 倾向于多报和漏报 |
| 疫苗安全数据链(VSD) | 来自美国13家大型医疗保健组织的电子健康记录数据 | 1250万 | 疾病预防控制中心,与综合卫生保健组织合作 | 主动监视系统; 假设检验; 可以进行病历审查以验证结果; 开发多种方法进行有效、准确的疫苗安全性研究 | 能够估计潜在的因果关系; 能够实时监控; 高质量数据 | 评估延迟或潜伏发作的不良事件的能力有限; 可能无法控制所有混杂因素; 代表被保险的人群 |
| 生物制品有效性和安全系统(BEST) | 大规模索赔数据、电子健康记录(EHR)和关联的索赔-EHR数据库 | 一亿 | 美国食品和药物管理局 | 支持快速查询以检测或评估不良事件,以及研究以回答疫苗的特定安全问题 | 人口非常多; 有可能在已有疾病的亚人群或孕妇中研究疫苗的安全性 | 迄今为止对儿科疫苗的有限评估; 统计信号必须通过严格的流行病学研究进一步评估 |
| 临床免疫安全性评估(CISA) | 通常来自临床医生的医疗记录 | NA | 疾病控制中心,与医学研究中心合作 | 深入的临床、病理生理学和疫苗学专业知识,以评估疫苗和不良事件之间的因果关系 | 美国卫生保健提供者如果对特定患者有复杂的疫苗安全问题,可以联系CISA要求咨询 | 范围有限 |
NA;不适用。
总之,疫苗在获得授权或许可前,由FDA对其安全性、有效性和生产质量进行全面评估。疫苗是在大量受试者中开发和测试的,受FDA监管,并在获得许可后通过由CDC和FDA资助的综合安全监测系统进行严格监控。在发现安全问题的情况下,采取监管或其他措施来保障公众健康。
对疫苗安全监测系统和儿童免疫计划安全性的广泛了解使儿科医生能够准备好应对父母对疫苗安全的担忧。推荐的儿童疫苗和推荐的时间表的安全性已经得到多个独立审查的肯定,包括来自国家医学科学院和医疗保健研究和质量机构的审查。104,105美国国家医学科学院2013年的报告包括对已知疫苗不良事件证据的审查,并被用于为疫苗伤害赔偿计划提供信息。医疗保健研究和质量机构报告的2021年更新没有发现与推荐的疫苗接种计划相关的新的安全风险,儿科医生可以使用这些信息来解释推荐计划的时间安排的原因。许多疫苗可预防的疾病,如麻疹、百日咳、轮状病毒、呼吸道合胞病毒、肺炎球菌流感嗜血杆菌感染与婴儿期和幼儿期较高的发病率和死亡率有关。推迟接种疫苗会使儿童在最危险的年龄得不到保护。研究疫苗是为了确保在推荐年龄时的安全性和足够的免疫反应。例如,对人乳头瘤病毒(HPV)疫苗的免疫反应在较早年龄接种时会更强,推迟接种疫苗可能会导致需要更多剂量才能获得足够的保护。106
追求不推荐的疫苗接种计划与儿童早期疫苗接种的可能性较低相关13,107,108并且意味着追求一种还没有被研究过的方法,这与已经被研究过的推荐时间表形成对比。104,105推迟或限制疫苗接种直接违背了ACIP和美国儿科学会(AAP)传染病委员会的建议,并使儿童、其家庭和社区面临暴露于疫苗可预防疾病的风险。在最年幼的儿童中推迟接种疫苗也可能使他们在生命中最容易受到感染的时候无法预防疫苗可预防的疾病。同样重要的是,在儿童与其他儿童一起参加集体活动之前,让他们充分接种疫苗(例如,任何类型的以中心为基础的儿童保育机构、幼儿园或小学,在这些地方接触疫苗可预防疾病的风险会增加)。当偏离疫苗时间表时,这一目标可能会受到损害。因此,通常不鼓励偏离推荐的时间表。在尽合理努力与一个家庭讨论推荐的疫苗接种计划后,如果偏离推荐的计划是为儿童接种疫苗的唯一方法,则可以考虑偏离推荐的计划。
一些家长担心儿童接种疫苗的数量或疫苗中的特定成分。临床医生可以回应一些家长的担忧,即同时给予“太多”疫苗,并提供基于证据的、有效的、文化敏感的声明,以促进疫苗的接种。这可能有助于解释当前方案中的抗原比历史方案中的少,历史方案包括全细胞百日咳疫苗。109免疫系统有能力同时对大量刺激做出反应,并对其通过常规童年食物、环境和循环疾病暴露在疫苗接种之外遇到的许多免疫原性物质做出反应。
父母有时会担心疫苗会导致他们实际上正在努力预防的感染。儿科医生可以解释说,除了减毒活疫苗,疫苗只含有他们正在努力预防的一部分细菌或病毒,最常见的疫苗副作用来自免疫系统反应,而不是感染的迹象。一些疫苗(如新冠肺炎)只含有特定蛋白质的遗传物质,并指导身体产生少量的蛋白质,这一过程已被证明是安全有效的。由于疫苗株病毒复制导致疫苗相关疾病的风险,减毒活疫苗对一些免疫功能低下的人是禁忌的;然而,这些疫苗不会在免疫活性人群中引起感染或疾病。
其他常见的问题集中在特定的疫苗或疫苗成分上。一项被广泛揭穿和撤回的研究表明MMR疫苗与自闭症有关,但仍导致许多父母认为疫苗会导致自闭症。110,–117在美国,2000年代初,大多数疫苗产品中的汞已被去除。硫柳汞(含有乙基汞)仍被用作防腐剂,以防止多剂量小瓶供应的一些流感疫苗受到污染,但美国的其他常规儿童疫苗,包括单剂量小瓶流感疫苗,不含乙基汞。对汞暴露的神经系统影响(如自闭症)的担忧是基于与甲基汞相关的风险,而乙基汞代谢更快,与同样的风险无关。118铝在一些疫苗中被用作佐剂,以促进强烈的免疫反应。疫苗中的铝含量是安全的,受监管的,与婴儿通过母乳和配方喂养接触到的铝含量相当。119,120VSD最近的一项研究表明,疫苗中铝含量与EHR中显示的哮喘诊断之间可能存在微弱但具有统计学意义的联系。121虽然这项研究有局限性(例如,未能充分考虑未测量的混杂因素,如二手烟、母乳喂养、儿童护理和环境污染物),但它是疫苗监测系统中整合的严格安全性监测的一个例子,需要更明确的后续研究。
胎儿细胞系已用于一些疫苗和其他药物的开发、测试和生产,但疫苗不含流产胎儿的细胞或DNA。大多数主要宗教都发表声明,澄清疫苗的使用并不违反宗教教义,在疫苗开发中使用胎儿细胞并不禁止这些疫苗的使用,一些宗教还指出,接种疫苗在道德上有利于保护儿童和周围人的健康。122
疾病控制中心的疫苗可预防疾病的流行病学:粉书和发病率和死亡率周报包含ACIP疫苗接种建议是关于疫苗禁忌症和注意事项、成分、时间表和副作用的更详细信息的有用资源。123,124中提供了常见误解的摘要以及相关事实表4.
表4 关于免疫的常见误解和误区
| 要求 | 事实 |
|---|---|
| 增强免疫力的“自然”方法,如感染疾病和母乳喂养,比接种疫苗更好。 | 接种疫苗是获得免疫力最安全的方法;“自然免疫”意味着患有潜在的非常严重的传染病。当一个人在未来暴露于预防性疫苗时,对预防性疫苗的免疫力提供了对疾病的保护。这种免疫力通常类似于从自然感染中获得的免疫力,尽管儿童可能需要注射几剂疫苗才能产生足够的免疫反应。虽然母乳喂养有很多好处,包括免疫,但它不能提供与疫苗同等水平的预防疫苗可预防疾病的保护。 |
| 同时注射多种疫苗会导致免疫系统“过载”。 | 疫苗接种不会使儿童的免疫系统负担过重;推荐的疫苗只使用了免疫系统“记忆”的一小部分。尽管在最近几十年里,施用的独特疫苗的数量增加了,但是由于科学和制造的进步,施用的抗原的数量减少了。美国国家医学研究院(NAM)得出结论,没有证据表明免疫计划是不安全的。 |
| 疫苗无效。 | 疫苗使数百万人免受毁灭性疾病的影响。 |
| 在使用疫苗之前,由于营养和卫生条件的改善,这些疾病已经开始减少。 | 在19世纪和20世纪,由于卫生设施、洁净水、消毒牛奶和害虫控制的改善,一些传染病开始得到更好的控制。然而,疫苗可预防的疾病在这些疾病的疫苗获得批准并给予大量儿童后大幅减少。 |
| 疫苗会导致不为人知的疾病或紊乱,如自闭症、婴儿猝死综合征(SIDS)、免疫功能障碍、糖尿病、神经系统紊乱、过敏性鼻炎和湿疹。 | 这些说法是错误的。多项高质量的科学研究未能证实疫苗和这些健康状况之间的任何联系。见不结盟运动报告。 |
| 疫苗会削弱免疫系统。 | 疫苗实际上增强了免疫系统。接种疫苗的儿童降低了感染的风险。重要的是,流感、麻疹和水痘等自然感染会削弱免疫系统,增加其他感染的风险。 |
| 同时注射多种疫苗未经测试。 | 新疫苗在与现有疫苗同时使用的研究中进行测试,现有疫苗以相同或重叠的时间表给药。进行这些研究是为了证实新疫苗不会影响同时施用的现有疫苗的安全性或有效性,并且同时施用的现有疫苗不会影响新疫苗的安全性或有效性。 |
| 疫苗可以被延迟、分离和间隔而没有后果。 | 许多疫苗可预防的疾病发生在婴儿早期。随着时间的推移,最佳的疫苗诱导免疫可能需要一系列疫苗。在接受适龄免疫接种方面的任何延误都会增加接种疫苗预防疾病的风险。间隔接种疫苗也可能产生心理后果,因为更多的办公室访问将与注射有关。 |
改编自美国儿科学会。红皮书:免疫实践委员会2021年报告。Kimberlin DW,Barnett ED,Lynfield R,Sawyer MH,eds第三十二版。美国儿科学会;2021;还有迈尔斯MG,皮内达d。疫苗会导致这种情况吗?疫苗安全性评估指南。公共卫生免疫接种;2008:79.
提高儿童疫苗接种率的循证沟通策略
使用强有力的疫苗建议和假定格式来发起疫苗讨论
儿科医生和其他儿科临床医生的疫苗交流策略之一是提供疫苗建议,有强有力的证据表明儿童和青少年疫苗的接种增加。130,131这项建议的力度和质量也很重要。父母接受了临床医生非常强烈的疫苗推荐的儿童的疫苗接种率高于没有接受的儿童。132自信地提供如此强有力建议的能力是基于几十年来广泛的国家和国际儿科卫生保健经验、数据收集以及对疫苗安全性、功效和有效性的严格、精心设计的研究。
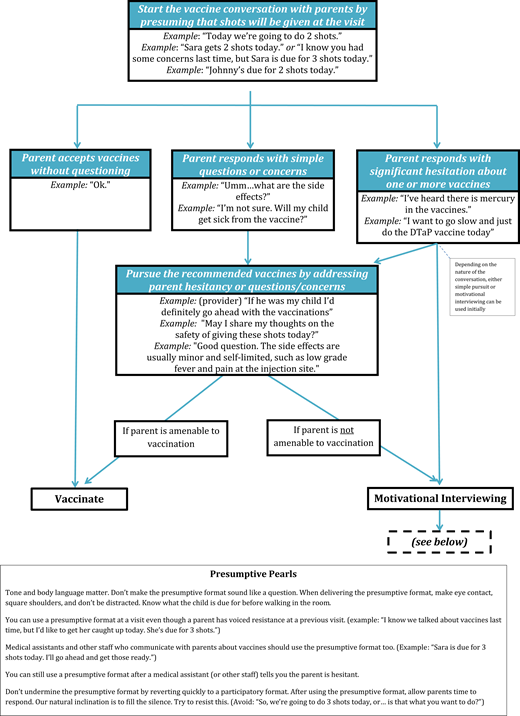
一个相关的沟通策略是,儿科医生或临床医生使用一种假定的形式来发起疫苗讨论,这种策略同样有力地证明了疫苗接种率的增加。133,–137假定格式是这样一种格式,其中临床医生使用封闭式陈述断言关于疫苗的立场,例如“Sara今天应该接种几种疫苗”或“嗯,我们必须打几针。”138这种策略与参与式模式形成对比,在参与式模式中,开放式问题用于更明确地邀请家长发表意见,如“你对今天的疫苗有什么看法?”
临床医生使用假定格式与疫苗接种率增加相关,甚至在对疫苗持否定态度的父母中也是如此。例如,对疫苗持消极态度的父母明显减少,消极态度的定义是在关于儿童疫苗的有效父母态度调查中得分≥50的父母,139,–145当供应商使用假定(相对于参与)启动格式时,拒绝疫苗建议。135此外,考虑到疫苗接种和讨论的纵向性质,临床医生在多次访视中对疫苗态度消极的父母重复使用假定(相对于参与)模式,显著降低了儿童的免疫不足率。146总的来说,临床医生认为在实践中实施假定的形式节省时间,易于使用,并且是促进疫苗接种作为常规护理的一部分的一种方式。147前台工作人员、医疗助理、护士和其他工作人员通常在疫苗接种过程中发挥重要作用,因此让办公室或住院部中所有与父母就疫苗进行沟通的团队成员参与使用假定形式发起疫苗讨论的基本原理和技术,可以最大限度地提高其效果。
对于表示犹豫的父母,使用额外的循证沟通策略
虽然强烈建议和使用一种假定的形式与父母开始疫苗讨论是有效的,但它们不是万灵药:尽管使用了这些策略,一部分对疫苗持否定态度的父母仍然会表示最初抵制给他们的孩子接种疫苗。135对于继续表示犹豫的父母,需要额外的疫苗沟通策略。一个这样的策略是动机面试(MI)。MI是一个以患者为中心的行为改变框架,有助于利用个人行为的内在动机。157,–159有几种MI通信技术被发现即使在单个会话中也是有效的(参见图一对于特定的MI示例)。160,161
支持在疫苗接种中使用MI的观察性研究证据越来越多。162,–166心肌梗塞最有力的证据来自一项大规模的随机对照试验。167干预实践中的临床医生接受培训,以使用假定的形式为所有父母发起HPV疫苗讨论,然后在与最初表示不愿意让他们的孩子接受HPV疫苗的父母的讨论中使用MI。临床医生在控制实践中提供通常的护理。研究人员发现,在接受干预治疗(相对于对照组)的父母的孩子中,HPV疫苗的开始和完成显著增加。一项旨在评估类似沟通策略对两岁儿童疫苗接种状况的影响的试验结果预计将于2024年公布。168,169
有证据支持其有效性的其他辅助性临床医生疫苗沟通策略包括(1)尽管家长最初不愿意,但坚持儿童在访视时应接种的推荐疫苗,以及(2)将儿童在访视时有资格接种的所有疫苗的讨论捆绑在一起。坚持是指对父母最初不愿意让孩子接种疫苗的态度立即做出回应,重申推荐的疫苗对孩子的重要性,如“他真的需要这些疫苗”。138在几项观察性研究中,在最初父母不情愿之后,当临床医生执行他们的疫苗建议(相对于默许)时,父母对他们孩子的疫苗口头接受度显著提高。133,135,170将儿童在就诊时应接种的所有疫苗的讨论捆绑在一起得到了观察工作的支持,在观察工作中,研究人员发现,同时讨论流感疫苗和儿童也应接种的其他疫苗与更高的流感疫苗接种率有关。133临床医生可能还会提到,他们使用策略来最大限度地减少与疫苗接种相关的疼痛,因为这是家长们普遍关心的问题。171,172
最后,在讨论疫苗接种的必要性时,临床医生可以强调他们自己的经历,包括对疫苗可预防疾病的个人经历,以及他们和他们的家人因为对疫苗的安全性和有效性有信心而接种疫苗的事实。76根据现有证据,包括假定方法和MI的使用,总结了推荐的疫苗沟通方法,如所示图一,169中提供了改进疫苗交流和接种的策略和建议的总体总结表5.
表5 改善疫苗交流和接种的策略和建议
| 提供商通信 |
| 儿科医生在父母疫苗决策中发挥着重要作用 |
| 使用强有力的疫苗建议和假定格式来发起疫苗讨论 |
| 准备好回答关于疫苗安全性、疫苗成分、疫苗安全监测系统和儿童疫苗接种计划的问题,以基于证据的、有效的、文化敏感的陈述来促进疫苗接种 |
| 对表示犹豫的父母使用额外的疫苗沟通策略(例如,动机访谈) |
| 疫苗接种计划 |
| 推荐的疫苗接种时间表是由CDC和AAP认可的;尚未评估替代计划 |
| 在尽合理努力与家庭讨论推荐的疫苗接种计划后,如果这是为儿童接种疫苗的唯一方法,可以考虑偏离推荐的计划 |
| 考场外的努力 |
| 支持临床接触之外的疫苗接种计划(例如,提醒或召回、学校和儿童保健进入要求、免疫信息系统的使用、与信任的信使合作) |
| 实践层面的政策 |
| 实践应考虑为拒绝或延迟接种疫苗的家庭提供统一的政策 |
| 解散家庭的做法存在伦理问题 |
| 然而,在反复尝试帮助理解和解决父母的价值观和疫苗问题、建立信任和加强治疗联盟后,解雇拒绝疫苗的家庭可能是一个可以接受的选择。解雇前,其他考虑因素包括: |
| 不太激烈的替代方案是不可行的,并且临床医生已经试图最小化对儿童的潜在负面影响 |
| 这是按照适用的州法律禁止遗弃病人的方式进行的 |
| 需要正式通知父母或法定监护人,并提供寻找新医生的信息 |
| 解雇医生有义务继续目前的治疗,并在一段合理的时间内(通常为30天)提供紧急护理 |
| 实践有时使用的其他策略包括: |
| 不接受父母不同意按照建议的时间表给其子女接种所有疫苗的新患者 |
| 要求父母签署一份合同,声明他们的孩子必须在一定年龄前达到最新水平,但父母可以分发疫苗 |
| 关于拒绝接种疫苗的家庭的实践政策应统一适用于所有此类家庭 |
| 缺乏证据表明任何类型的实践层面政策对个别儿童或周围社区接种疫苗的影响,对疫苗态度和对医疗系统的信任的影响,或被解雇的儿童在哪里接受医疗护理 |
利用系统、组织方法和社区倡议来提高父母获得疫苗的机会
儿科医生-家长沟通只是实现和保持高疫苗接种覆盖率所需的众多努力之一。对于儿科医生和其他为儿童服务的临床医生来说,培养文化能力和理解他们所服务的社区是很重要的。也有许多既定和长期的循证做法来提高疫苗接种覆盖率,如疫苗接种长期订单、提醒和召回、免疫信息系统的使用、学校和儿童保健入学要求以及审计和反馈等。173还出现了新的基于社区的方法,旨在建立信任和解决特定人群的关切,包括宗教和弱势群体。32,174,–176这可能包括以社区和学校为基础的疫苗接种计划,这可能有助于证明疫苗接种是一种社会规范,并鼓励更多的人接受。177虽然这些不是本临床报告的重点,儿科医生可以在他们自己的临床环境中尽可能地使用它们。有效地实施这些策略有可能通过减少讨论疫苗所需的时间来节省临床会面的时间。美国社区预防服务工作组维护了一个强大的网站,详细介绍了这些策略背后的证据,178AAP有许多在办公室环境中实施它们的在线资源(表6)。
表6 疫苗信息和交流资源
针对拒绝或延迟接种疫苗的家庭的政策
儿科实践和个体儿科医生已经采取了各种方法来解决那些选择拒绝或延迟为他们的孩子接种疫苗的家庭。2019年在儿科医生中进行的一项全国调查显示,51%的儿科医生报告说,他们的办公室有一项政策,如果家庭拒绝为他们的孩子接种初级系列疫苗,就会解雇他们,37%的儿科医生报告说,他们经常或总是这样做。187解雇家庭的做法似乎在上升,因为2013年只有21%的儿科医生报告说他们经常或总是解雇家庭。188
更少的儿科医生报告解雇“传播”疫苗的家庭(28%报告办公室政策,8%的个体儿科医生报告经常或总是解雇这些家庭)。19%的儿科医生报告说,他们的办公室有一项政策,要求父母签署一份合同,声明他们的孩子必须在一定年龄前接种疫苗,但父母可能会分散疫苗。187儿科医生采取的另一种方法是不接受父母不同意按照建议的时间表给孩子接种所有疫苗的新患者(46%的人报告了这种办公室政策)。绝大多数报告有解雇政策的儿科医生都是私人执业。187,188由于组织政策,医院和大型医疗保健组织的员工通常无法解雇患者,而在安全网系统或农村环境中工作的儿科医生可能不会基于类似的组织政策和这些实践中的儿童不太可能在其他地方找到护理的事实解雇家庭。
支持和反对解雇政策都有伦理上的争论。支持解雇政策的一个论点是,鉴于接种疫苗的成本很低,父母有道德义务给孩子接种疫苗,以减少感染他人的风险。189根据这种容易救援的义务论点,群体免疫是一种集体利益,实现群体免疫是一种集体道德义务,只要它的代价很小(例如,预约疫苗、接受疫苗、产生副作用的小风险等费用)。因此,解雇政策可能是合理的,因为它不鼓励父母逃避这一道德义务。
一个类似的论点基于契约论,其中疫苗接种被视为一种社会契约:如果几乎每个人都接种了疫苗,每个人都会因为群体免疫而受到保护。然而,为了分享这一集体利益,出于公平,个人必须接受与疫苗接种相关的微小负担。个人从那些接受这些小负担的人的行为中受益,而自己却不分担负担,这是不公平的,也是对社会契约的违反。解雇政策有助于维护这种社会契约,并限制接种疫苗负担的不公平分配。
然而,这些解雇政策的伦理论据并非没有弱点。例如,尽管父母在道德上有义务为其子女接种疫苗,但通过解雇政策强制执行这一义务需要额外的理由,说明为什么这一道德义务优先于其他竞争性的道德主张,如身体完整权。同样,尽管解雇政策可能会限制父母及其子女之间接种疫苗负担的不公平分配,但它们可能会在临床医生和实践中造成不平等的负担。例如,除非所有的实践都有解雇政策,否则这种政策的不规则实施将会不公正地重新分配照顾未免疫患者的负担。190
解雇政策还有其他几个实际的论据。支持者认为,驳回政策有助于说服大多数拒绝疫苗的父母接受疫苗;需要它们来保护实践中的其他儿童免受疫苗可预防疾病的影响;实践中的父母倡导这样的政策;允许父母拒绝为他们的孩子接种疫苗会让医生面临法医学风险;接受非疫苗接种者的儿科实践存在隐性财务成本;他们有助于促进“最高标准的医疗服务”191,–193这些观点也有弱点。194一个明显的弱点是,很少有实证证据表明解雇政策会产生积极的结果。例如,关于解雇家庭的做法,以下情况仍然未知:(1)解雇政策在多大程度上增加了儿童接种疫苗的可能性;(2)将拒绝接种疫苗的家庭留在实践中是否增加了接种疫苗的可能性;(3)被遣散家庭的儿童接受医疗的地方;(4)面临解雇前景的父母对疫苗接种态度和对医疗系统总体信任度的影响;和(5)这些政策在人群水平上对疫苗接种和疫苗可预防疾病的影响和相互作用。
反对解雇政策或根本不接受疫苗拒绝者的政策的伦理论点集中在医学伦理中促进患者福祉的基本原则上。194这一义务当然是通过在父母的允许下给孩子接种疫苗来实现的。然而,当父母拒绝允许时,取消父母和孩子的这种做法可以说是忽视了这一义务。例如,一些儿童,如农村地区的儿童,在被解雇后可能很少得到医疗保健监督,因为缺乏其他初级保健替代方案。这种做法可能会加剧差距,因为来自历史上被剥夺权利的社区的家庭代表着一个群体,他们对政府和有组织的医疗的不信任可能会导致他们抵制疫苗接种。因此,解雇政策的反对者主张采取一种更符合促进患者福祉的方法,而不是导致患者脱离自己护理的政策。194这种方法包括文化谦逊和尊重地探索临床医生和父母之间的价值差异,这可以创造机会改变父母的想法,同时实施解雇政策的不太激烈的替代方案,这可以减轻将免疫不足的儿童包括在实践中的一些潜在风险(例如将未免疫和免疫不足的儿童隔离在单独的等候室)。190,194,–199有证据表明,拒绝接种疫苗是一种可以改变的行为,犹豫不决的父母可以在与孩子的儿科医生交谈后改变主意,133,167特别是当儿科医生采用上述循证沟通策略时,支持这种方法。
解雇拒绝接种疫苗的父母的儿童患者可能是一个困难的决定,这是在考虑了多种因素并记录了对拒绝接种疫苗的家庭进行咨询的尝试后做出的。然而,如果反复尝试帮助理解和解决父母的价值观和疫苗问题未能产生信任,促使父母接受疫苗,或加强治疗联盟,解雇可能是一个可以接受的选择。当考虑解雇拒绝接种疫苗的父母时,重要的是核实不太激烈的替代方案是不可行的,并努力将对孩子的潜在负面影响降至最低。例如,办公室解雇政策的考虑、设计和实施将理想地考虑实践环境、患者群体、附近其他可靠的儿童医疗保健来源的可用性以及政策的制定(强调疫苗接种的重要性)。此类政策的透明度和公平应用也很重要。解雇也必须以符合适用的州法律禁止遗弃病人的方式进行。虽然这些法律因州而异,但需要正式通知父母或法定监护人,并提供寻找新医生的信息。父母拒绝推荐的疫苗和试图劝告家人的行为应记录在患者的病历中。此外,解雇医生有义务继续目前的治疗,并在一段合理的时间内(通常为30天)提供紧急护理。200
结论
大多数美国父母根据推荐的时间表给他们的孩子接种疫苗。实施循证技术以提高疫苗接种率可能是说服许多犹豫不决的父母给孩子接种疫苗所需要的全部。这包括使用假定的方法(“她今天应该注射一些疫苗”)来引入疫苗,这可能会克服轻度或中度的犹豫。对于仍然不愿意给孩子接种疫苗的父母来说,儿科医生的强烈建议可能会让他们相信接种疫苗的重要性。对于其他人来说,更详细的谈话可能是必要的,而沟通技术,如动机访谈,显示了作为疫苗谈话的有效框架的前景。最终,即使经过长时间的交谈,仍有一些父母会拒绝接种疫苗。
对于儿科医生来说,重要的是要认识到对疫苗犹豫不决的父母是一个异质的群体,需要单独识别和解决特定的父母疫苗问题。倾听父母的担忧并回答关于疫苗安全性、当前疫苗计划背后的科学、每种疫苗在获得许可前后的广泛测试以及所预防疾病的严重程度的问题是任何预防保健工作的正常组成部分。
在临床实践过程中,通过儿科医生和父母之间的公开交流和讨论,可以最好地提高疫苗的接种率。因为大多数父母同意给他们的孩子接种疫苗,这种对话可以早在产前访视时就开始,是一个持续的过程。在第一次免疫访视前提供疫苗相关信息可以让父母清楚地表达他们的担忧,以便儿科医生能够充分解决这些问题。201与对疫苗有疑问的父母一起工作是与家庭建立融洽关系和信任的绝佳机会,最终保护他们的孩子免受疫苗可预防疾病的祸害。
主要作者
FAAP医学博士,公共卫生硕士
道格拉斯·j·欧宝,医学博士,MPH
杰西卡·r·卡塔尔迪,医学博士,FAAP
杰西·哈克尔,医学博士,FAAP
传染病委员会,2022–2023
FAAP医学博士,公共卫生硕士,主席
James D. Campbell,医学博士,硕士,FAAP
FAAP MSCS DO的Monica I. Ardura
FAAP医学博士Ritu Banerjee博士
FAAP医学博士克里斯蒂娜·布赖恩特
FAAP医学博士玛丽·t·卡塞塔
FAAP医学博士罗伯特·弗伦克
FAAP医学博士Jeffrey S. Gerber
FAAP医学博士、理学硕士昌迪·c·约翰
Athena P. Kourtis,医学博士,公共卫生硕士,FAAP
FAAP医学博士,公共卫生硕士
FAAP医学博士,公共卫生硕士
FAAP医学博士,公共卫生硕士
FAAP MSCE医学博士萨米尔·沙阿
按照职务
大卫·w·金伯利,医学博士,FAAP贵族名鉴编者ˌ编辑
FAAP医学博士伊丽莎白·d·巴尼特红皮书合伙人编者ˌ编辑
FAAP医学博士Ruth Lynfield红皮书合伙人编者ˌ编辑
FAAP医学博士Mark H. Sawyer红皮书合伙人编者ˌ编辑
FAAP MHCM DO的Henry h . Bernstein–刚刚过去贵族名鉴在线销售线索
联络人
FAAP国立卫生研究院医学博士、公共卫生硕士Cristina Cardemil
美国美国食品药品监督管理局医学博士Karen M. Farizo
Lisa M. Kafer,医学博士,FAAP-AAP流动医疗实践委员会
David Kim,医学博士——HHS传染病和艾滋病政策办公室
Eduardo López Medina,医学博士,理学硕士——拉丁美洲儿科传染病学会
Denee Moore,医学博士,美国家庭医师学会
Lakshmi Panagiotakopoulos,医学博士,公共卫生硕士——疾病控制和预防中心
FAAP疾病控制和预防中心医学博士José R. Romero
Laura Sauvé,医学博士,公共卫生硕士,FAAP,加拿大儿科学会
Jeffrey R. Starke,医学博士,FAAP-美国胸科协会
珍妮·汤普森,医学博士——美国妇产科学院
梅林达·沃顿,医学博士,公共卫生硕士——疾病控制和预防中心
FAAP儿科传染病学会
员工
詹妮弗·弗兰茨,公共卫生硕士
吉莉安·吉布斯,公共卫生硕士
生物伦理委员会,2022–2023
FAAP医学博士Naomi Tricot Laventhal,主席
FAAP医学博士吉娜·玛丽·盖修
黛博拉·苏珊·勒夫,医学博士,FAAP
FAAP,医学博士,公共卫生硕士
玛丽·奥特,医学博士,马萨诸塞州,FAAP
顾问
Nanette Elster,法学博士,公共卫生硕士
联络
FAAP医学博士、公共卫生硕士——美国儿科委员会
Kavita Arora,医学博士,医学硕士,美国妇产科学院
Maria McGee,医学博士,公共卫生硕士——美国儿童和青少年精神病学学会
员工
安吉·伊曼纽尔,公共卫生硕士
实践和流动医学委员会,2022–2023
杰西·哈克尔,医学博士,FAAP,主席
FAAP医学博士Yvette Marie Almendarez
FAAP医学博士阿贝巴·梅布拉图·伯哈尼
FAAP医学博士帕特里夏·e·坎特雷尔
丽莎·米歇尔·卡弗,医学博士,FAAP
FAAP医学博士托米特拉·拉蒂默
罗宾·沃纳,医学博士,FAAP
FAAP医学博士Robert H. Wiskind
联络人
凯瑟琳·斯查费,FAAP-AAP行政和实践管理部
亚里沙·斯卡楚德——家庭联络员
员工
麦肯齐·马格努斯,工商管理硕士,公共卫生硕士
致谢
作者要感谢医学博士Jeremy Michel代表政策执行伙伴关系所做的重要贡献。
所有作者都为作品的概念化做出了贡献;参与起草、审查和修改手稿;并批准了最终的手稿出版。
美国儿科学会的临床报告受益于联络人、内部(AAP)和外部审查者的专业知识和资源。然而,美国儿科学会的临床报告可能不反映联络人或他们所代表的组织或政府机构的观点。
本报告中的指南并不表示治疗的唯一过程,也不作为医疗护理的标准。考虑到个人情况,变化可能是适当的。
所有来自美国儿科学会的临床报告在发表后5年自动失效,除非在那时或之前被重申、修订或废弃。
本文件受版权保护,是美国儿科学会及其董事会的财产。所有作者都向美国儿科学会提交了利益冲突声明。任何冲突都已通过董事会批准的流程得到解决。美国儿科学会既没有寻求也没有接受任何商业参与本出版物内容的开发。
资金来源:没有外部资助。
财务/利益冲突披露:作者表示他们没有潜在的利益冲突要披露。
AAP:美国儿科学会
ACIP:免疫实践咨询委员会
BEST:生物制品的有效性和安全性
CDC:疾病控制和预防中心
FDA:美国食品药品监督管理局
HPV:人乳头瘤病毒疫苗
MI:动机面试
参考
1 Brewer NT, Chapman GB, Rothman AJ, Leask J, Kempe A. Increasing vaccination: putting psychological science into action. Psychol Sci Public Interest. 2017;18(3):149–207
2 Dudley MZ, Privor-Dumm L, Dubé È, MacDonald NE. Words matter: vaccine hesitancy, vaccine demand, vaccine confidence, herd immunity and mandatory vaccination. Vaccine. 2020;38(4):709–711
3 SAGE Working Group; World Health Organization. Report of the SAGE working group on vaccine hesitancy. Available at: https://www.who.int/immunization/sage/meetings/2014/october/1_Report_WORKING_GROUP_vaccine_hesitancy_final.pdf. Accessed April 21, 2021
4 Centers for Disease Control and Prevention. What is vaccine confidence?. Available at: https://www.cdc.gov/vaccines/covid-19/vaccinate-with-confidence/building-trust.html. Accessed March 29, 2022
5 Gust D, Brown C, Sheedy K, Hibbs B, Weaver D, Nowak G. Immunization attitudes and beliefs among parents: beyond a dichotomous perspective. Am J Health Behav. 2005;29(1):81–92
6 Dubé E, Laberge C, Guay M, Bramadat P, Roy R, Bettinger J. Vaccine hesitancy: an overview. Hum Vaccin Immunother. 2013;9(8):1763–1773
7 Santibanez TA, Nguyen KH, Greby SM, et al. Parental vaccine hesitancy and childhood influenza vaccination. Pediatrics. 2020;146(6):e2020007609
8 Edwards KM, Hackell JM; Committee on Infectious Diseases; The Committee on Practice and Ambulatory Medicine. Countering vaccine hesitancy. Pediatrics. 2016;138(3):e20162146
9 Gust DA, Darling N, Kennedy A, Schwartz B. Parents with doubts about vaccines: which vaccines and reasons why. Pediatrics. 2008;122(4):718–725
10 Smith PJ, Humiston SG, Marcuse EK, et al. Parental delay or refusal of vaccine doses, childhood vaccination coverage at 24 months of age, and the Health Belief Model. Public Health Rep. 2011;126 Suppl 2(Suppl 2):135–146
11 Leask J, Kinnersley P, Jackson C, Cheater F, Bedford H, Rowles G. Communicating with parents about vaccination: a framework for health professionals. BMC Pediatr. 2012;12:154
12 Kahan DM. Vaccine risk perceptions and ad hoc risk communication: an empirical assessment (January 27, 2014)。 CCP Risk Perception Studies Report No. 17. Yale Law & Economics Research Paper No. 491. Available at: https://ssrn.com/abstract=2386034. Accessed January 10, 2024
13 Daley MF, Reifler LM, Shoup JA, et al. Temporal trends in undervaccination: a population-based cohort study. Am J Prev Med. 2021;61(1):64–72
14 Hill HA, Chen M, Elam-Evans LD, Yankey D, Singleton JA. Vaccination coverage by age 24 months among children born during 2018–2019 – national immunization survey-child, United States, 2019–2021. MMWR Morb Mortal Wkly Rep. 2023;72(2):33–38
15 Patel Murthy B, Zell E, Kirtland K, et al. Impact of the COVID-19 pandemic on administration of selected routine childhood and adolescent vaccinations – 10 U.S. jurisdictions, March-September 2020. MMWR Morb Mortal Wkly Rep. 2021;70(23):840–845
16 Seither R, Laury J, Mugerwa-Kasujja A, Knighton CL, Black CL. Vaccination coverage with selected vaccines and exemption rates among children in kindergarten – United States, 2020-21 school year. MMWR Morb Mortal Wkly Rep. 2022;71(16):561–568
17 Seither R, Calhoun K, Yusuf OB, et al. Vaccination coverage with selected vaccines and exemption rates among children in kindergarten – United States, 2021-22 school year. MMWR Morb Mortal Wkly Rep. 2023;72(2):26–32
18 Opel DJ, Furniss A, Zhou C, et al. Parent attitudes towards childhood vaccines after the onset of SARS-CoV-2 in the United States. Acad Pediatr. 2022;22(8):1407–1413
19 Humble RM, Scott SD, Dubé E, Olson J, MacDonald SE. The impact of the COVID-19 pandemic on parents’ perceptions and acceptance of routine childhood vaccination in Canada: a national longitudinal study. Vaccine. 2023;41(2):407–415
20 Funk C, Tyson A, Kennedy B, Pasquini G. Americans’ largely positive views of childhood vaccines hold steady. Available at: https://www.pewresearch.org/science/2023/05/16/americans-largely-positive-views-of-childhood-vaccines-hold-steady/. Accessed May 25, 2023
21 Gidengil C, Chen C, Parker AM, Nowak S, Matthews L. Beliefs around childhood vaccines in the United States: a systematic review. Vaccine. 2019;37(45):6793–6802
22 Díaz Crescitelli ME, Ghirotto L, Sisson H, et al. A meta-synthesis study of the key elements involved in childhood vaccine hesitancy. Public Health. 2020;180:38–45
23 Majid U, Ahmad M. The factors that promote vaccine hesitancy, rejection, or delay in parents. Qual Health Res. 2020;30(11):1762–1776
24 Olson O, Berry C, Kumar N. Addressing parental vaccine hesitancy towards childhood vaccines in the United States: a systematic literature review of communication interventions and strategies. Vaccines (Basel)。 2020;8(4):590
25 Salmon DA, Moulton LH, Omer SB, DeHart MP, Stokley S, Halsey NA. Factors associated with refusal of childhood vaccines among parents of school-aged children: a case-control study. Arch Pediatr Adolesc Med. 2005;159(5):470–476
26 Pomares TD, Buttenheim AM, Amin AB, et al. Association of cognitive biases with human papillomavirus vaccine hesitancy: a cross-sectional study. Hum Vaccin Immunother. 2020;16(5):1018–1023
27 Callaghan T, Motta M, Sylvester S, Lunz Trujillo K, Blackburn CC. Parent psychology and the decision to delay childhood vaccination. Soc Sci Med. 2019;238:112407
28 Finkelstein SR, Boland WA, Vallen B, Connell PM, Sherman GD, Feemster KA. Psychological reactance impacts ratings of pediatrician vaccine-related communication quality, perceived vaccine safety, and vaccination priority among U.S. parents. Hum Vaccin Immunother. 2020;16(5):1024–1029
29 Cataldi JR, Sevick C, Pyrzanowski J, et al. Addressing personal parental values in decisions about childhood vaccination: measure development. Vaccine. 2019;37(38):5688–5697
30 Korn L, Böhm R, Meier NW, Betsch C. Vaccination as a social contract. Proc Natl Acad Sci USA. 2020;117(26):14890–14899
31 Attwell K, Freeman M. I immunise: an evaluation of a values-based campaign to change attitudes and beliefs. Vaccine. 2015;33(46):6235–6240
32 Schoeppe J, Cheadle A, Melton M, et al. The immunity community: a community engagement strategy for reducing vaccine hesitancy. Health Promot Pract. 2017;18(5):654–661
33 Brewer NT, Chapman GB, Gibbons FX, Gerrard M, McCaul KD, Weinstein ND. Meta-analysis of the relationship between risk perception and health behavior: the example of vaccination. Health Psychol. 2007;26(2):136–145
34 Glanz JM, McClure DL, Magid DJ, et al. Parental refusal of pertussis vaccination is associated with an increased risk of pertussis infection in children. Pediatrics. 2009;123(6):1446–1451
35 Glanz JM, McClure DL, O’Leary ST, et al. Parental decline of pneumococcal vaccination and risk of pneumococcal related disease in children. Vaccine. 2011;29(5):994–999
36 Omer SB, Enger KS, Moulton LH, Halsey NA, Stokley S, Salmon DA. Geographic clustering of nonmedical exemptions to school immunization requirements and associations with geographic clustering of pertussis. Am J Epidemiol. 2008;168(12):1389–1396
37 Phadke VK, Bednarczyk RA, Salmon DA, Omer SB. Association between vaccine refusal and vaccine-preventable diseases in the United States: a review of measles and pertussis. JAMA. 2016;315(11):1149–1158
38 May T, Silverman RD. ‘Clustering of exemptions’ as a collective action threat to herd immunity. Vaccine. 2003;21(11-12):1048–1051
39 Sinclair DR, Grefenstette JJ, Krauland MG, et al. Forecasted size of measles outbreaks associated with vaccination exemptions for schoolchildren. JAMA Netw Open. 2019;2(8):e199768
40 Gromis A, Liu KY. Spatial clustering of vaccine exemptions on the risk of a measles outbreak. Pediatrics. 2022;149(1):e2021050971
41 Gastañaduy PA, Budd J, Fisher N, et al. A measles outbreak in an underimmunized Amish community in Ohio. N Engl J Med. 2016;375(14):1343–1354
42 Leslie TF, Delamater PL, Yang YT. It could have been much worse: the Minnesota measles outbreak of 2017. Vaccine. 2018;36(14):1808–1810
43 Hall V, Banerjee E, Kenyon C, et al. Measles outbreak – Minnesota April-May 2017. MMWR Morb Mortal Wkly Rep. 2017;66(27):713–717
44 Carlson A, Riethman M, Gastañaduy P, et al. Notes from the field: community outbreak of measles – Clark County, Washington, 2018-2019. MMWR Morb Mortal Wkly Rep. 2019;68(19):446–447
45 McDonald R, Ruppert PS, Souto M, et al. Notes from the field: measles outbreaks from imported cases in orthodox Jewish communities – New York and New Jersey, 2018-2019. MMWR Morb Mortal Wkly Rep. 2019;68(19):444–445
46 Zucker JR, Rosen JB, Iwamoto M, et al. Consequences of undervaccination – measles outbreak, New York City, 2018-2019. N Engl J Med. 2020;382(11):1009–1017
47 Causey K, Fullman N, Sorensen RJD, et al. Estimating global and regional disruptions to routine childhood vaccine coverage during the COVID-19 pandemic in 2020: a modelling study. Lancet. 2021;398(10299):522–534
48 World Health Organization. COVID-19 pandemic leads to major backsliding on childhood vaccinations, new WHO, UNICEF data shows. Available at: https://www.who.int/news/item/15-07-2021-covid-19-pandemic-leads-to-major-backsliding-on-childhood-vaccinations-new-who-unicef-data-shows. Accessed October 15, 2021
49 DeSilva MB, Haapala J, Vazquez-Benitez G, et al. Association of the COVID-19 pandemic with routine childhood vaccination rates and proportion up to date with vaccinations across 8 US health systems in the vaccine safety datalink. JAMA Pediatr. 2021;176(1):68–77
Google ScholarCrossref
50 Feldman AG, O’Leary ST, Danziger-Isakov L. The risk of resurgence in vaccine-preventable infections due to coronavirus disease 2019-related gaps in immunization. Clin Infect Dis. 2021;73(10):1920–1923
51 Cacciatore MA, Nowak G, Evans NJ. Exploring the impact of the us measles outbreak on parental awareness of and support for vaccination. Health Aff (Millwood)。 2016;35(2):334–340
52 Oster E. Does disease cause vaccination? Disease outbreaks and vaccination response. J Health Econ. 2018;57:90–101
53 Schober T. Effects of a measles outbreak on vaccination uptake. Econ Hum Biol. 2020;38:100871
54 Wolf ER, Opel D, DeHart MP, Warren J, Rowhani-Rahbar A. Impact of a pertussis epidemic on infant vaccination in Washington state. Pediatrics. 2014;134(3):456–464
55 Deiner MS, Fathy C, Kim J, et al. Facebook and Twitter vaccine sentiment in response to measles outbreaks. Health Informatics J. 2019;25(3):1116–1132
56 Cataldi JR, Dempsey AF, O’Leary ST. Measles, the media, and MMR: impact of the 2014-15 measles outbreak. Vaccine. 2016;34(50):6375–6380
57 Marcelin JR, Swartz TH, Bernice F, et al. Addressing and inspiring vaccine confidence in black, indigenous, and people of color during the coronavirus disease 2019 pandemic. Open Forum Infect Dis. 2021;8(9):ofab417
58 Goldenberg MJ. Vaccine Hesitancy: Public Trust, Expertise, and the War on Science. University of Pittsburgh Press; 2021
Google ScholarCrossref
59 Walsh B, Doherty E, O’Neill C. Since the start of the vaccines for children program, uptake has increased, and most disparities have decreased. Health Aff (Millwood)。 2016;35(2):356–364
60 Hammershaimb EA, Campbell JD, O’Leary ST. Coronavirus disease-2019 vaccine hesitancy. Pediatr Clin North Am. 2023;70(2):243–257
61 Opel DJ, Brewer NT, Buttenheim AM, et al. The legacy of the COVID-19 pandemic for childhood vaccination in the USA. Lancet. 2023;401(10370):75–78
62 Diekema DS. Rhetoric, persuasion, compulsion, and the stubborn problem of vaccine hesitancy. Perspect Biol Med. 2022;65(1):106–123
63 Milien E, Enoma E, Pierre-Louis L, et al. We got us: a community-centered approach to increasing vaccine access for minoritized groups. J Hosp Med. 2022;17(9):765–768
64 Adams DA, Thomas KR, Jajosky RA, et al; Nationally Notifiable Infectious Conditions Group. Summary of notifiable infectious diseases and conditions – United States, 2015. MMWR Morb Mortal Wkly Rep. 2017;64(53):1–143
65 Rosen JB, Arciuolo RJ, Khawja AM, Fu J, Giancotti FR, Zucker JR. Public health consequences of a 2013 measles outbreak in New York City. JAMA Pediatr. 2018;172(9):811–817
66 Pike J, Leidner AJ, Gastañaduy PA. A review of measles outbreak cost estimates from the United States in the postelimination era (2004–2017): estimates by perspective and cost type. Clin Infect Dis. 2020;71(6):1568–1576
67 Pike J, Melnick A, Gastañaduy PA, et al. Societal costs of a measles outbreak. Pediatrics. 2021;147(4):e2020027037
68 Ortega-Sanchez IR, Vijayaraghavan M, Barskey AE, Wallace GS. The economic burden of sixteen measles outbreaks on United States public health departments in 2011. Vaccine. 2014;32(11):1311–1317
69 Barskey AE, Schulte C, Rosen JB, et al. Mumps outbreak in Orthodox Jewish communities in the United States. N Engl J Med. 2012;367(18):1704–1713
70 Zhou F, Shefer A, Wenger J, et al. Economic evaluation of the routine childhood immunization program in the United States, 2009. Pediatrics. 2014;133(4):577–585
71 Wendorf KA, Kay M, Ortega-Sanchez IR, Munn M, Duchin J. Cost of measles containment in an ambulatory pediatric clinic. Pediatr Infect Dis J. 2015;34(6):589–593
72 Cook KM, Evans G. The national vaccine injury compensation program. Pediatrics. 2011;127(Suppl 1):S74–S77
73 Kempe A, Daley MF, McCauley MM, et al. Prevalence of parental concerns about childhood vaccines: the experience of primary care physicians. Am J Prev Med. 2011;40(5):548–555
74 American Academy of Pediatrics. Vaccine counseling and preventive care visits. Available at: https://www.aap.org/en/practice-management/practice-financing/coding-and-valuation/vaccine-financing-and-coding/vaccine-counseling-and-preventive-care-visits/. Accessed February 27, 2022
75 Center for Medicare and Medicaid Services. Biden-Harris administration makes 100% federal Medicaid matching funds available for state expenditures on certain COVID-19 vaccine counseling visits for children and youth. Available at: https://www.cms.gov/newsroom/press-releases/biden-harris-administration-makes-100-federal-medicaid-matching-funds-available-state-expenditures. Accessed May 4, 2022
76 Kempe A, O’Leary ST, Kennedy A, et al. Physician response to parental requests to spread out the recommended vaccine schedule. Pediatrics. 2015;135(4):666–677
77 Dean W, Talbot S, Dean A. Reframing clinician distress: moral injury not burnout. Fed Pract. 2019;36(9):400–402
Google ScholarPubMed
78 Klitzman R. Needs to address clinicians’ moral distress in treating unvaccinated COVID-19 patients. BMC Med Ethics. 2022;23(1):110
79 Ugale JL, Spielvogle H, Spina C, et al. “It’s like 1998 again”: why parents still refuse and delay vaccines. Glob Pediatr Health. 2021;8:2333794X211042331
Google ScholarPubMed
80 Salmon DA, Pavia A, Gellin B. Editors’ introduction: vaccine safety throughout the product life cycle. Pediatrics. 2011;127(Suppl 1):S1–S4
81 Marshall V, Baylor NW. Food and Drug Administration regulation and evaluation of vaccines. Pediatrics. 2011;127(Suppl 1):S23–S30
82 Curlin G, Landry S, Bernstein J, et al. Integrating safety and efficacy evaluation throughout vaccine research and development. Pediatrics. 2011;127(Suppl 1):S9–S15
83 Ball R, Horne D, Izurieta H, Sutherland A, Walderhaug M, Hsu H. Statistical, epidemiological, and risk-assessment approaches to evaluating safety of vaccines throughout the life cycle at the Food and Drug Administration. Pediatrics. 2011;127(Suppl 1):S31–S38
84 Kanesa-thasan N, Shaw A, Stoddard JJ, Vernon TM. Ensuring the optimal safety of licensed vaccines: a perspective of the vaccine research, development, and manufacturing companies. Pediatrics. 2011;127(Suppl 1):S16–S22
85 Pickering LK, Meissner HC, Orenstein WA, Cohn AC. Principles of vaccine licensure, approval, and recommendations for use. Mayo Clin Proc. 2020;95(3):600–608
86 Pickering LK, Orenstein WA, Sun W, Baker CJ. FDA licensure of and ACIP recommendations for vaccines. Vaccine. 2017;35(37):5027–5036
87 Oliver SE, Gargano JW, Marin M, et al. The Advisory Committee on Immunization Practices’ interim recommendation for use of Pfizer-BioNTech COVID-19 vaccine – United States, December 2020. MMWR Morb Mortal Wkly Rep. 2020;69(50):1922–1924
88 Shimabukuro TT, Nguyen M, Martin D, DeStefano F. Safety monitoring in the Vaccine Adverse Event Reporting System (VAERS)。 Vaccine. 2015;33(36):4398–4405
89 Baggs J, Gee J, Lewis E, et al. The Vaccine Safety Datalink: a model for monitoring immunization safety. Pediatrics. 2011;127(Suppl 1):S45–S53
90 McNeil MM, Gee J, Weintraub ES, et al. The Vaccine Safety Datalink: successes and challenges monitoring vaccine safety. Vaccine. 2014;32(42):5390–5398
91 Yih WK, Kulldorff M, Fireman BH, et al. Active surveillance for adverse events: the experience of the Vaccine Safety Datalink project. Pediatrics. 2011;127(Suppl 1):S54–S64
92 Chen RT, Glasser JW, Rhodes PH, et al; The Vaccine Safety Datalink Team. Vaccine Safety Datalink project: a new tool for improving vaccine safety monitoring in the United States. Pediatrics. 1997;99(6):765–773
93 France EK, Glanz J, Xu S, et al; Vaccine Safety Datalink Team. Risk of immune thrombocytopenic purpura after measles-mumps-rubella immunization in children. Pediatrics. 2008;121(3):e687–e692
94 Klein NP, Fireman B, Yih WK, et al; Vaccine Safety Datalink. Measles-mumps-rubella-varicella combination vaccine and the risk of febrile seizures. Pediatrics. 2010;126(1):e1–e8
95 Glanz JM, Clarke CL, Daley MF, et al. The childhood vaccination schedule and the lack of association with type 1 diabetes. Pediatrics. 2021;148(6):e2021051910
96 Kharbanda EO, Vazquez-Benitez G, DeSilva MB, et al. Association of inadvertent 9-valent human papillomavirus vaccine in pregnancy with spontaneous abortion and adverse birth outcomes. JAMA Netw Open. 2021;4(4):e214340
97 Panagiotakopoulos L, McCarthy NL, Tepper NK, et al. Evaluating the association of stillbirths after maternal vaccination in the vaccine safety datalink. Obstet Gynecol. 2020;136(6):1086–1094
98 Glanz JM, Clarke CL, Xu S, et al. Association between rotavirus vaccination and type 1 diabetes in children. JAMA Pediatr. 2020;174(5):455–462
99 Sukumaran L, McCarthy NL, Kharbanda EO, et al. Infant hospitalizations and mortality after maternal vaccination. Pediatrics. 2018;141(3):e20173310
100 Donahue JG, Kieke BA, Yih WK, et al; Vaccine Safety DataLink Team. Varicella vaccination and ischemic stroke in children: is there an association? Pediatrics. 2009;123(2):e228–e234
101 Deady M, Ezzeldin H, Cook K, et al. The Food and Drug Administration biologics effectiveness and safety initiative facilitates detection of vaccine administrations from unstructured data in medical records through natural language processing. Front Digit Health. 2021;3:777905
102 LaRussa PS, Edwards KM, Dekker CL, et al. Understanding the role of human variation in vaccine adverse events: the Clinical Immunization Safety Assessment Network. Pediatrics. 2011;127(Suppl 1):S65–S73
103 Gee J, Marquez P, Su J, et al. First month of COVID-19 vaccine safety monitoring – United States, December 14, 2020-January 13, 2021. MMWR Morb Mortal Wkly Rep. 2021;70(8):283–288
104 Gidengil C, Goetz MB, Maglione M, et al. Safety of Vaccines Used for Routine Immunization in the United States: An Update. Agency for Healthcare Research and Quality; 2021
Google ScholarPubMed
105 Institute of Medicine. The Childhood Immunization Schedule and Safety: Stakeholder Concerns, Scientific Evidence, and Future Studies. The National Academies Press; 2013:236
PubMed
106 Meites E, Kempe A, Markowitz LE. Use of a 2-dose schedule for human papillomavirus vaccination – updated recommendations of the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep. 2016;65(49):1405–1408
107 Offit PA, Moser CA. The problem with Dr Bob’s alternative vaccine schedule. Pediatrics. 2009;123(1):e164–e169
108 Robison SG, Groom H, Young C. Frequency of alternative immunization schedule use in a metropolitan area. Pediatrics. 2012;130(1):32–38
109 Offit PA, Quarles J, Gerber MA, et al. Addressing parents’ concerns: do multiple vaccines overwhelm or weaken the infant’s immune system? Pediatrics. 2002;109(1):124–129
110 Wakefield AJ, Murch SH, Anthony A, et al. Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. Lancet. 1998;351(9103):637–641
111 Deer B. Wakefield’s “autistic enterocolitis” under the microscope. BMJ. 2010;340:c1127
112 Deer B. How the case against the MMR vaccine was fixed. BMJ. 2011;342:c5347
113 Deer B. Secrets of the MMR scare. How the vaccine crisis was meant to make money. BMJ. 2011;342:c5258
114 Deer B. Secrets of the MMR scare. The Lancet’s two days to bury bad news. BMJ. 2011;342:c7001
115 Deer B. Pathology reports solve “new bowel disease” riddle. BMJ. 2011;343:d6823
116 Deer B. More secrets of the MMR scare. Who saw the “histological findings”? BMJ. 2011;343:d7892
117 Gerber JS, Offit PA. Vaccines and autism: a tale of shifting hypotheses. Clin Infect Dis. 2009;48(4):456–461
118 Offit PA. Thimerosal and vaccines–a cautionary tale. N Engl J Med. 2007;357(13):1278–1279
119 Keith LS, Jones DE, Chou CH. Aluminum toxicokinetics regarding infant diet and vaccinations. Vaccine. 2002;20(Suppl 3):S13–S17
120 Mitkus RJ, King DB, Hess MA, Forshee RA, Walderhaug MO. Updated aluminum pharmacokinetics following infant exposures through diet and vaccination. Vaccine. 2011;29(51):9538–9543
121 Daley MF, Reifler LM, Glanz JM, et al. Association between aluminum exposure from vaccines before age 24 months and persistent asthma at age 24 to 59 months. Acad Pediatr. 2022;23(1):37–46
122 Grabenstein JD. What the world’s religions teach, applied to vaccines and immune globulins. Vaccine. 2013;31(16):2011–2023
123 Hall E, Wodi AP, Hamborsky J, Morelli V, Schillie S. Epidemiology and Prevention of Vaccine-Preventable Diseases. US Department of Health and Human Services; 2021
Google Scholar
124 Centers for Disease Control and Prevention. ACIP vaccine recommendations and guidelines. Available at: https://www.cdc.gov/vaccines/hcp/acip-recs/index.html. Accessed February 2022
125 Eller NM, Henrikson NB, Opel DJ. Vaccine information sources and parental trust in their child’s health care provider. Health Educ Behav. 2019;46(3):445–453
126 Freed GL, Clark SJ, Butchart AT, Singer DC, Davis MM. Sources and perceived credibility of vaccine-safety information for parents. Pediatrics. 2011;127(Suppl 1):S107–S112
127 Smith PJ, Kennedy AM, Wooten K, Gust DA, Pickering LK. Association between health care providers’ influence on parents who have concerns about vaccine safety and vaccination coverage. Pediatrics. 2006;118(5):e1287–e1292
128 Rubincam C, Greyson D, Haselden C, Saunders R, Bettinger JA. Is the pre-natal period a missed opportunity for communicating with parents about immunizations? Evidence from a longitudinal qualitative study in Victoria, British Columbia. BMC Public Health. 2022;22(1):237
129 Danchin MH, Costa-Pinto J, Attwell K, et al. Vaccine decision-making begins in pregnancy: correlation between vaccine concerns, intentions and maternal vaccination with subsequent childhood vaccine uptake. Vaccine. 2018;36(44):6473–6479
130 Smith LE, Amlôt R, Weinman J, Yiend J, Rubin GJ. A systematic review of factors affecting vaccine uptake in young children. Vaccine. 2017;35(45):6059–6069
131 Newman PA, Logie CH, Lacombe-Duncan A, et al. Parents’ uptake of human papillomavirus vaccines for their children: a systematic review and meta-analysis of observational studies. BMJ Open. 2018;8(4):e019206
132 Dempsey AF, Pyrzanowski J, Lockhart S, Campagna E, Barnard J, O’Leary ST. Parents’ perceptions of provider communication regarding adolescent vaccines. Hum Vaccin Immunother. 2016;12(6):1469–1475
133 Hofstetter AM, Robinson JD, Lepere K, Cunningham M, Etsekson N, Opel DJ. Clinician-parent discussions about influenza vaccination of children and their association with vaccine acceptance. Vaccine. 2017;35(20):2709–2715
134 Opel DJ, Mangione-Smith R, Robinson JD, et al. The influence of provider communication behaviors on parental vaccine acceptance and visit experience. Am J Public Health. 2015;105(10):1998–2004
135 Opel DJ, Heritage J, Taylor JA, et al. The architecture of provider-parent vaccine discussions at health supervision visits. Pediatrics. 2013;132(6):1037–1046
136 Sturm L, Donahue K, Kasting M, Kulkarni A, Brewer NT, Zimet GD. Pediatrician-parent conversations about human papillomavirus vaccination: an analysis of audio recordings. J Adolesc Health. 2017;61(2):246–251
137 Brewer NT, Hall ME, Malo TL, Gilkey MB, Quinn B, Lathren C. Announcements versus conversations to improve HPV vaccination coverage: a randomized trial. Pediatrics. 2017;139(1):e20161764
138 Opel DJ, Robinson JD, Heritage J, Korfiatis C, Taylor JA, Mangione-Smith R. Characterizing providers’ immunization communication practices during health supervision visits with vaccine-hesitant parents: a pilot study. Vaccine. 2012;30(7):1269–1275
139 Opel DJ, Taylor JA, Zhou C, Catz S, Myaing M, Mangione-Smith R. The relationship between parent attitudes about childhood vaccines survey scores and future child immunization status: a validation study. JAMA Pediatr. 2013;167(11):1065–1071
140 Opel DJ, Taylor JA, Mangione-Smith R, et al. Validity and reliability of a survey to identify vaccine-hesitant parents. Vaccine. 2011;29(38):6598–6605
141 Opel DJ, Mangione-Smith R, Taylor JA, et al. Development of a survey to identify vaccine-hesitant parents: the parent attitudes about childhood vaccines survey. Hum Vaccin. 2011;7(4):419–425
142 Hofstetter AM, Simon TD, Lepere K, et al. Parental vaccine hesitancy and declination of influenza vaccination among hospitalized children. Hosp Pediatr. 2018;8(10):628–635
143 Strelitz B, Gritton J, Klein EJ, et al. Parental vaccine hesitancy and acceptance of seasonal influenza vaccine in the pediatric emergency department. Vaccine. 2015;33(15):1802–1807
144 Cunningham RM, Minard CG, Guffey D, Swaim LS, Opel DJ, Boom JA. Prevalence of vaccine hesitancy among expectant mothers in Houston, Texas. Acad Pediatr. 2018;18(2):154–160
145 Williams SE, Morgan A, Opel D, Edwards K, Weinberg S, Rothman R. Screening tool predicts future underimmunization among a pediatric practice in Tennessee. Clin Pediatr (Phila)。 2016;55(6):537–542
146 Opel DJ, Zhou C, Robinson JD, et al. Impact of childhood vaccine discussion format over time on immunization status. Acad Pediatr. 2018;18(4):430–436
147 Malo TL, Hall ME, Brewer NT, Lathren CR, Gilkey MB. Why is announcement training more effective than conversation training for introducing HPV vaccination? A theory-based investigation. Implement Sci. 2018;13(1):57
148 Ariely D. Predictably Irrational. Harper-Collins; 2009
Google Scholar
149 Johnson EJ, Goldstein D. Medicine. Do defaults save lives? Science. 2003;302(5649):1338–1339
150 Halpern SD, Ubel PA, Asch DA. Harnessing the power of default options to improve health care. N Engl J Med. 2007;357(13):1340–1344
151 Reñosa MDC, Landicho J, Wachinger J, et al. Nudging toward vaccination: a systematic review. BMJ Glob Health. 2021;6(9):e006237
152 Opel DJ, Omer SB. Measles, mandates, and making vaccination the default option. JAMA Pediatr. 2015;169(4):303–304
153 Bazerman MH, Moore DA. Judgment in Managerial Decision-Making. Wiley; 2013
Google Scholar
154 Samuelson W, Zeckhauser R. Status quo bias in decision making. J Risk Uncertain. 1988;1(1):7–59
Google ScholarCrossref
155 Blumenthal-Barby JS, Opel DJ. Nudge or grudge? choice architecture and parental decision-making. Hastings Cent Rep. 2018;48(2):33–39
156 National Center for Immunization and Respiratory Diseases CfDCaP. Talking with parents about vaccines for infants. Available at: https://www.cdc.gov/vaccines/hcp/conversations/talking-with-parents.html. Accessed February 12, 2022
157 Miller WR, Rollnick S. Motivational Interviewing: Preparing People for Change. The Guilford Press; 1991
Google Scholar
158 Rollnick S, Miller WR, Butler CC. Motivational Interviewing in Health Care: Helping Patients Change Behavior. The Guilford Press; 2008
Google Scholar
159 Miller WR. Motivational interviewing: research, practice, and puzzles. Addict Behav. 1996;21(6):835–842
160 Brand V, Bray K, Macneill S, Catley D, Williams K. Impact of single-session motivational interviewing on clinical outcomes following periodontal maintenance therapy. Int J Dent Hyg. 2013;11(2):134–141
161 Hides L, Carroll S, Scott R, Cotton S, Baker A, Lubman DI. Quik fix: a randomized controlled trial of an enhanced brief motivational interviewing intervention for alcohol/cannabis and psychological distress in young people. Psychother Psychosom. 2013;82(2):122–124
162 Gagneur A. Motivational interviewing: a powerful tool to address vaccine hesitancy. Can Commun Dis Rep. 2020;46(4):93–97
163 Lemaitre T, Carrier N, Farrands A, Gosselin V, Petit G, Gagneur A. Impact of a vaccination promotion intervention using motivational interview techniques on long-term vaccine coverage: the PromoVac strategy. Hum Vaccin Immunother. 2019;15(3):732–739
164 Gagneur A, Battista MC, Boucher FD, et al. Promoting vaccination in maternity wards — motivational interview technique reduces hesitancy and enhances intention to vaccinate, results from a multicentre non-controlled pre- and post-intervention RCT-nested study, Quebec, March 2014 to February 2015. Euro Surveill. 2019;24(36):1800641
165 Gagneur A, Lemaître T, Gosselin V, et al. A postpartum vaccination promotion intervention using motivational interviewing techniques improves short-term vaccine coverage: PromoVac study. BMC Public Health. 2018;18(1):811
166 Glanternik JR, McDonald JC, Yee AH, et al. Evaluation of a vaccine-communication tool for physicians. J Pediatr. 2020;224:72–78.e1
167 Dempsey AF, Pyrznawoski J, Lockhart S, et al. Effect of a health care professional communication training intervention on adolescent human papillomavirus vaccination: a cluster randomized clinical trial. JAMA Pediatr. 2018;172(5):e180016
168 Opel DJ, Robinson JD, Spielvogle H, et al. ‘Presumptively Initiating Vaccines and Optimizing Talk with Motivational Interviewing’ (PIVOT with MI) trial: a protocol for a cluster randomised controlled trial of a clinician vaccine communication intervention. BMJ Open. 2020;10(8):e039299
169 O’Leary ST, Spina CI, Spielvogle H, et al. Development of PIVOT with MI: a motivational interviewing-based vaccine communication training for pediatric clinicians. Vaccine. 2023;41(10):1760–1767
170 Shay LA, Baldwin AS, Betts AC, et al. Parent-provider communication of HPV vaccine hesitancy. Pediatrics. 2018;141(6):e20172312
171 Taddio A, McMurtry CM, Logeman C, et al. Prevalence of pain and fear as barriers to vaccination in children – systematic review and meta-analysis. Vaccine. 2022;40(52):7526–7537
172 Thomas JB, David K. Taking fear and pain out of needles—for your child and you. Available at: https://www.healthychildren.org/English/safety-prevention/immunizations/Pages/managing-your-childs-pain-while-getting-a-shot.aspx. Accessed May 26, 2023
173 Cataldi JR, Kerns ME, O’Leary ST. Evidence-based strategies to increase vaccination uptake: a review. Curr Opin Pediatr. 2020;32(1):151–159
174 Brewer SE, Nederveld A, Simpson M. Engaging communities in preventing human papillomavirus-related cancers: two boot camp translations, Colorado, 2017-2018. Prev Chronic Dis. 2020;17:E02
Google ScholarPubMed
175 Brewer SE, Simpson MJ, Rice JD, Skenadore A, O’Leary ST. Engaging practices and communities in the development of interventions to promote HPV vaccine uptake: a protocol for implementing Boot Camp Translation in the private practice setting. BMJ Open. 2020;10(12):e041685
176 Williams JTB, O’Leary ST. Denver religious leaders’ vaccine attitudes, practices, and congregational experiences. J Relig Health. 2019;58(4):1356–1367
177 Fairlie T, Chu B, Thomas ES, et al. School-based interventions to increase student covid-19 vaccination coverage in public school populations with low coverage – Seattle, Washington, December 2021-June 2022. MMWR Morb Mortal Wkly Rep. 2023;72(11):283–287
178 The Community Guide. Vaccination. Available at: https://www.thecommunityguide.org/topic/vaccination. Accessed August 12, 2022
179 Glanz JM, Wagner NM, Narwaney KJ, et al. Web-based social media intervention to increase vaccine acceptance: a randomized controlled trial. Pediatrics. 2017;140(6):e20171117
180 O’Leary ST, Narwaney KJ, Wagner NM, Kraus CR, Omer SB, Glanz JM. Efficacy of a web-based intervention to increase uptake of maternal vaccines: an RCT. Am J Prev Med. 2019;57(4):e125–e133
181 Salmon DA, Limaye RJ, Dudley MZ, et al. MomsTalkShots: an individually tailored educational application for maternal and infant vaccines. Vaccine. 2019;37(43):6478–6485
182 Scott VP, Opel DJ, Reifler J, et al. Office-based educational handout for influenza vaccination: a randomized controlled trial. Pediatrics. 2019;144(2):e20182580
183 Glanz JM, Wagner NM, Narwaney KJ, et al. Web-based tailored messaging to increase vaccination: a randomized clinical trial. Pediatrics. 2020;146(5):e20200669
184 Fadda M, Galimberti E, Fiordelli M, Romanò L, Zanetti A, Schulz PJ. Effectiveness of a smartphone app to increase parents’ knowledge and empowerment in the MMR vaccination decision: a randomized controlled trial. Hum Vaccin Immunother. 2017;13(11):2512–2521
185 Kaufman J, Attwell K, Hauck Y, et al. Designing a multi-component intervention (P3-MumBubVax) to promote vaccination in antenatal care in Australia. Health Promot J Austr. 2021;32(3):391–398
186 Montagni I, Mabchour I, Tzourio C. Digital gamification to enhance vaccine knowledge and uptake: scoping review. JMIR Serious Games. 2020;8(2):e16983
187 O’Leary ST, Cataldi JR, Lindley MC, et al. Policies among US pediatricians for dismissing patients for delaying or refusing vaccination. JAMA. 2020;324(11):1105–1107
188 O’Leary ST, Allison MA, Fisher A, et al. Characteristics of physicians who dismiss families for refusing vaccines. Pediatrics. 2015;136(6):1103–1111
189 Giubilini A, Douglas T, Savulescu J. The moral obligation to be vaccinated: utilitarianism, contractualism, and collective easy rescue. Med Health Care Philos. 2018;21(4):547–560
190 Deem MJ, Navin MC, Lantos JD. Considering whether the dismissal of vaccine-refusing families is fair to other clinicians. JAMA Pediatr. 2018;172(6):514–516
191 Block SL. The pediatrician’s dilemma: refusing the refusers of infant vaccines. J Law Med Ethics. 2015;43(3):648–653
192 Lessin HR, Hackell JM. Real world vaccine ethics. J Pediatr. 2016;175:243–244
193 Marshall GS, O’Leary ST. Dismissal policies for vaccine refusal. JAMA Pediatr. 2018;172(11):1101
194 Diekema DS. Physician dismissal of families who refuse vaccination: an ethical assessment. J Law Med Ethics. 2015;43(3):654–660
195 Buttenheim AM, Cherng ST, Asch DA. Provider dismissal policies and clustering of vaccine-hesitant families: an agent-based modeling approach. Hum Vaccin Immunother. 2013;9(8):1819–1824
196 Chervenak FA, McCullough LB, Brent RL. Professional responsibility and early childhood vaccination. J Pediatr. 2016;169:305–309
197 Diekema DS; American Academy of Pediatrics Committee on Bioethics. Responding to parental refusals of immunization of children. Pediatrics. 2005;115(5):1428–1431
198 Williams JTB, O’Leary ST, Nussbaum AM. Caring for the vaccine-hesitant family: evidence-based alternatives to dismissal. J Pediatr. 2020;224:137–140
199 Navin MC, Wasserman JA, Opel DJ. Reasons to accept vaccine refusers in primary care. Pediatrics. 2020;146(6):e20201801
200 Management CoMLaR. How to end physician-patient relationship legally. Available at: https://publications.aap.org/aapnews/article/33/4/1/24309/How-to-end-physician-patient-relationship-legally?autologincheck=redirected. Accessed May 26, 2023
201 O’Leary ST, Brewer SE, Pyrzanowski J, et al. Timing of information-seeking about infant vaccines. J Pediatr. 2018;203:125–130.e1
Hits: 68
相关文章:
- 麻疹是最致命和最具传染性的传染病之一,也是最容易预防的疾病之一
- 不要被 RFK Jr. 对丹麦人的反驳所挫败铝研究
- 疫苗脱落确实存在——但并非你所想的那样
- 从改变疫苗观点的人们身上我们学到的七件事
- 疫苗是安全、有效的,不会导致自闭症
- 我为什么接种疫苗:儿童麻疹病例让妈妈成为倡导者
- “疫苗救不了我们”(又名“疫苗不起作用”):最赤裸裸的智力欺诈
- 预防和控制儿童流感的建议,2024–2025:政策声明
- 建议3 关注疫苗对儿童和青少年长期健康及福祉的益处
- 不同寻常的抵制,“危险的先例”:肯尼迪的 CDC 顾问第一次会议揭示了美国疫苗的未来
- 在 CDC 疫苗小组对硫柳汞的误导之前进行介绍
- RFK Jr 取消了 5 亿美元的 mRNA 疫苗研究资金
- 美国儿科学会 2025 年 8 月 19 日发布的推荐18 岁及以下儿童与青少年免疫接种程序
- AAP 发布循证免疫计划;呼吁付款人承担建议
- 免疫力窃贼:为什么麻疹比皮疹严重得多
Powered by YARPP.