Self-Proclaimed inventor of mRNA vaccines, Robert Malone, misrepresents an excellent vaccine study
要点:罗伯特·马龙 (Robert Malone) 是为使 mRNA 疫苗成为可能做出贡献的数百名科学家之一,他做了一些重要的早期实验,帮助证明了这一概念。然而,马龙在成为疫苗错误信息的重要来源的基础上脱颖而出,并希望或多或少地将 mRNA 疫苗作为一个概念的发明归功于他,尽管他在使我们目前的 mRNA 疫苗成为可能的中心思想中没有发挥作用,并继续倡导另一类 mRNA 疫苗,该疫苗已经因缺乏疗效而未能通过临床试验(并且它设法使用 mRNA 剂量甚至比辉瑞/BioNTech 和 Moderna/NIH 的疫苗更低,也会引起类似的令人不快的副作用)。令人费解的是,马龙详细地(错误地)描述了我们目前拥有的 mRNA 疫苗为什么不好——同时还声称自己发明了这个概念(这总是让我感到困惑——我不知道)。最近,他的一篇 substack 帖子引起了关注,该文章描述了一项改变了我们对 mRNA 疫苗工作原理的理解的研究。我们以前认为 mRNA 疫苗产生的 mRNA 和抗原会很快消失,因为这就是实验所表明的。Röltgen 及其同事最近表明,这在人类中可能并非如此,因为 mRNA 和刺突蛋白甚至可以在接种疫苗后 60 天在淋巴结(免疫系统的总部,因为缺乏更好的类比)中被检测到,并且刺突蛋白甚至短暂地出现在疫苗接种者的血液中(但我们以前见过这种情况).虽然这一发现听起来可能令人担忧,但它实际上有助于解释为什么对 mRNA 疫苗的免疫反应如此出色以及为什么它们效果如此之好。这些抗原在淋巴结中的持久性使抗体能够继续进化以覆盖新的变体并更好地与刺突蛋白结合,如果它迅速消失,该过程将停止。然而,更重要的是,这并没有改变我们迄今为止拥有的任何基本安全数据,这些数据非常清楚:疫苗是安全有效的——不是 100% 安全,也不是 100% 有效(没有什么是),但比 COVID-19 安全得多。永远记住:科学中事物如何运作的机制是我们告诉自己的故事,以理解我们的观察结果,这非常有价值——但最重要的是观察本身。我们没有观察到仅因 mRNA 疫苗中存在刺突蛋白而造成危害的证据,而且这些数据并没有改变接种疫苗是否值得的基本问题。Röltgen 及其同事的数据的力量在于,它有朝一日可能被用来帮助制造更好、更有效的疫苗——但它绝不会逆转或挑战我们已经拥有的安全数据,这些数据支持疫苗是安全有效的。事实上,它只是为了帮助我们理解为什么会这样。
罗伯特·马龙 (Robert Malone) 最近在他的 substack 上发表了一篇文章,该文章讨论了一篇我非常喜欢的非常优秀的论文,只是他歪曲了论文的许多部分及其发现,使事情听起来很可怕,而事实并非如此。
罗伯特·马龙是谁?

用于 mRNA 递送的脂质纳米颗粒开发中的关键历史事件的删节总结。马龙在 1989 年的重大发现中发挥了作用。他不负责 mRNA 的核苷修饰 (2005),这是目前可用于 COVID-19 的 mRNA 疫苗有效性的核心,也没有参与产生辉瑞/BioNTech 或 Moderna/NIH 疫苗的项目。图 1 来自 Hou, X., Zaks, T., Langer, R., & Dong, Y. (2021)。用于 mRNA 递送的脂质纳米颗粒。Nature Reviews 材料。doi:10.1038/s41578-021-00358-0
这可能是最好的开始问题,而且答案很复杂,尽管我确实保证会根据他们自己的基础来考虑马龙的论点的价值,而不是他作为一个人。我提到这一点只是因为我认为这个背景很重要。马龙经常称自己是 mRNA 疫苗的发明者,但坦率地说,据我所知,我认为“发明者”一词没有定义符合条件。此外,在继续之前,我认为澄清一下没有人发明 mRNA 非常重要。围绕生命起源的假说表明,RNA 是第一个产生生命的分子,这使得它至少有数十亿年的历史。碰巧的是,mRNA 本身作为一个研究主题有着非常复杂的历史。这里详细讨论了它的发现细节以及谁应该为这一发现而受到赞扬的问题。至于 mRNA 疫苗,那里的故事也很复杂。
那么,这些 COVID-19 mRNA 疫苗呢?mRNA 疫苗主要有几个部分。第一部分是序列。SARS-CoV-2 刺突蛋白的序列于 2020 年 1 月由一个中国团队上传,NIH 疫苗研究中心的一个团队随后推断出如何修改该序列以使刺突蛋白成为更好的抗原,Jason MacLellan 及其同事为此受到普遍赞誉(这种方法用于多种疫苗,包括辉瑞/BioNTech 的疫苗, Moderna/NIH 的、Novavax 的等)。该序列的另一个方面是使用修饰的核苷,阻止先天免疫系统识别 mRNA(如果发生这种情况,它会抑制由 mRNA 编码的刺突蛋白的产生,从而抑制对它产生良好免疫反应的任何能力)——这一成就通常归功于 Kariko 的努力, Weissman 及其合作者。另一个感兴趣的问题是脂质纳米颗粒。脂质纳米颗粒作为 mRNA 递送载体的概念可以追溯到 1978 年,早于 Vical 的工作,其中包括 Malone。Malone 确实拥有多项与核酸疫苗相关的专利,但至关重要的是,疫苗中使用的脂质纳米颗粒与 Malone 的专利不同。马龙在历史上的地位是数百名科学家之一,他们为使 mRNA 疫苗成为可能的关键工作做出了贡献,部分原因是作为一份提出核酸疫苗概念的出版物的中间作者(尽管我不清楚这是否是第一个这样做的出版物)。这并不是说他的工作不重要——他确实进行了一些关键的实验。然而,值得注意的是,这位自称 mRNA 疫苗发明者的出版物在 Pubmed 上索引了四篇关于核酸疫苗的出版物,其中一篇描述了原始研究(其余的是评论),而没有一篇描述进入人体试验的候选药物。相比之下,为了举个例子,与 Katalin Kariko 一起工作并从根本上使 mRNA 疫苗接种范式可行的 Drew Weissman (绝不是孤军奋战,而是让我沉迷于这种过于简化的尝试),有 65 篇关于 mRNA 疫苗的索引出版物(尽我所能 – 你可以看到输入的查询), 其中大部分是他自己的原创研究——但即使是他也没有到处宣称他是 mRNA 疫苗的发明者。这是因为这项工作涉及数百名科学家,他们中没有一个人可以声称自己是发明者。
尽管如此,如果没有第三方的某种详细调查,准确说明他在事物历史上的确切角色很可能是不可能的,根据《自然》杂志上的纠结历史文章:
Malone 辩称,Verma 和 Vical 达成了一项幕后交易,因此相关知识产权归 Vical 所有。马龙被列为几位发明家中的一位,但他不再像从索尔克颁发的任何专利中那样从随后的许可交易中个人获利。马龙的结论是:“他们靠我思想的产品致富。
维尔马和费尔格纳断然否认了马龙的指控。“这完全是胡说八道,”维尔玛告诉《自然》。他说,放弃专利申请的决定取决于 Salk 的技术转让办公室。(维尔马在性骚扰指控后于 2018 年从 Salk 辞职,他继续否认。

来自 Röltgen 等人的图形摘要,人类 SARS-CoV-2 感染和疫苗接种中的免疫印记、变体识别的广度和生发中心反应,Cell (2022),https://doi.org/10.1016/j.cell.2022.01.018
无论马龙在 mRNA 疫苗问题上的真正历史地位如何,没有什么能改变他积极传播有关疫苗的虚假信息的事实,他目前在他的子堆栈上歪曲的论文也不例外。让我们深入研究这项研究,并将它的发现与 Malone 声称的发现进行比较。
澎湃新闻
有问题的论文(标题中的超链接)是一项了不起的科学,涉及多个机构的许多合作者,其发现实际上在图形摘要中得到了很好的总结,您可以在右侧看到。首先,该论文的一个中心重点是感染引发的免疫反应,特别是抗体反应,与疫苗接种引发的免疫反应相比如何。在 Malone 的子堆栈文章中没有提到的是,对于几乎所有评估的疫苗,尤其是辉瑞/BioNTech 疫苗,疫苗接种产生的抗体反应对变体的覆盖面明显比感染更广。Alpha 和 Delta 感染在对 Alpha 和 Delta 的免疫力方面分别优于疫苗(对 Delta 的 Kappa 和 Epsilon 变体也有一些轻微的优势),但总体而言,疫苗对变体的识别明显更广泛。另一个关键发现是,在死于 COVID-19 的患者中,淋巴结显示缺乏称为生发中心的结构(稍后将详细介绍这意味着什么),而它们在 mRNA 疫苗的接受者中含量丰富。说实话,在我看来,这些是论文中最重要的发现,但大多数人可能最感兴趣的发现与 mRNA 和刺突蛋白在接种疫苗后都持续存在于淋巴结内的发现有关,这与之前的数据形成鲜明对比,表明情况并非如此。

基于核苷修饰的 mRNA 寿命没有明显差异。图 S3b 帕尔,卡勒姆 JC;和田,俊介;小竹,健次郎;龟田,重俊;松浦,中本聪;坂下,宗平;朴素英;杉山浩;匡毅;斋藤广秀 (2020)。N 1-甲基假尿苷取代增强了细胞中合成 mRNA 开关的性能。核酸研究, (), gkaa070–.doi:10.1093/nar/gkaa070
Malone 最初断言,看到刺突蛋白和 mRNA 如此持续地表达是非常令人惊讶的。我同意 mRNA 被发现能持续这么长时间是不寻常的。我曾经对核糖开关(细菌中调节基因表达的遗传元件,由 RNA 制成,可以感知某些代谢物的存在)进行了研究,在处理 RNA 时必须采取的预防措施非常广泛,以免降解它,以至于我实际上对 mRNA 疫苗作为一个概念是否有效持怀疑态度。这在很大程度上与 RNAs(降解 RNA 的酶)无处不在的事实有关,包括整个人体,可能是一种抗病毒防御机制。但 Malone 继续把事情弄得太远了,他断言这一定是由于核苷修饰阻止了 mRNA 被降解,并引用了这篇论文。这不是一个不可信的假设,但链接的论文并不支持这种说法。事实上,它直接反驳了它:
然后,我们检查了具有不同修饰的 EGFP mRNA 的细胞降解速率和转染效率,发现 mRNA 之间没有显着差异,表明增强并非源于这些参数(补充图 S3B、C)。
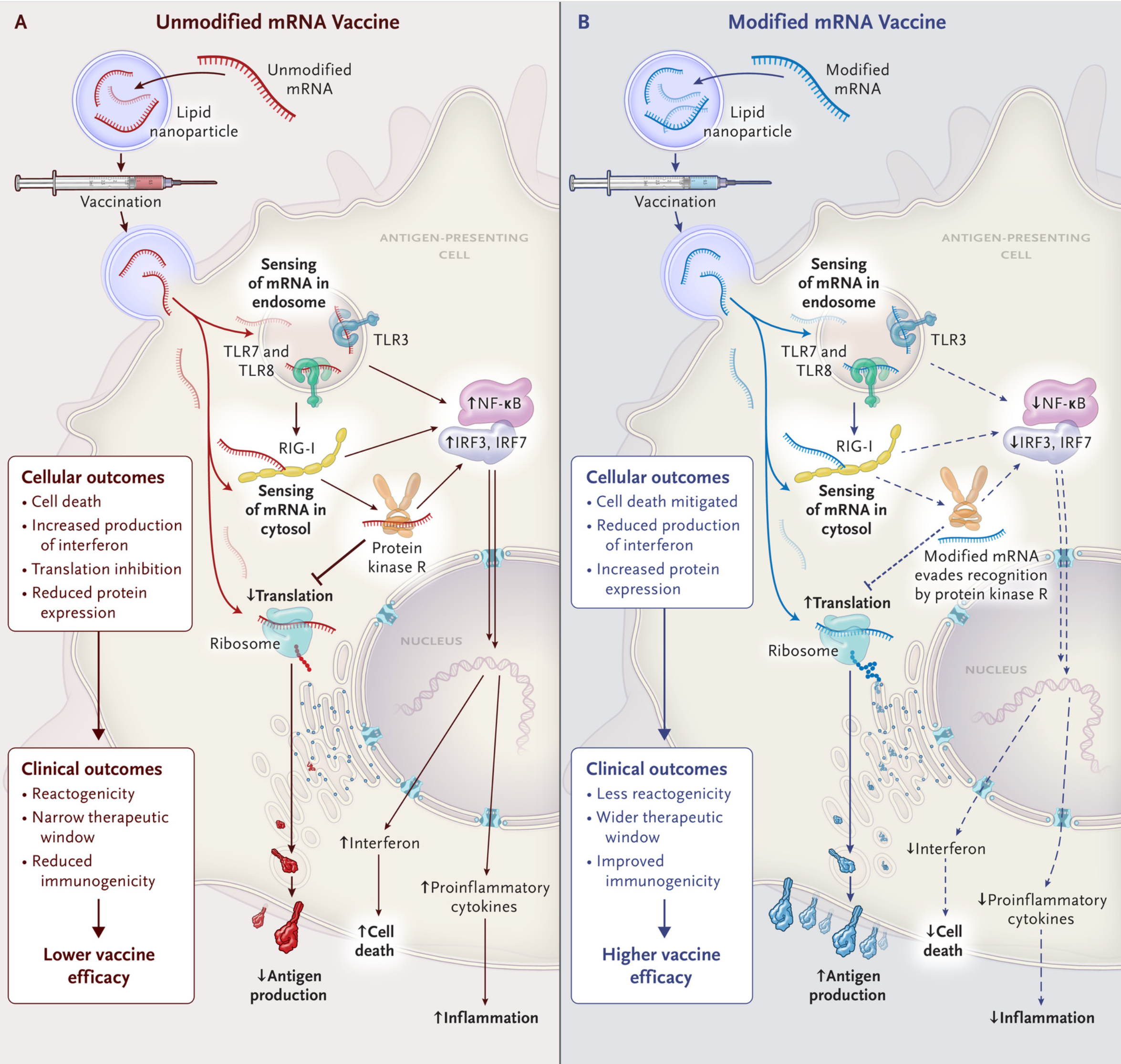
mRNA 疫苗中的核苷修饰是其功效和有效性的关键。N Engl J Med 2021 年;385:1436-1438
无论核苷修饰如何,mRNA 的降解速率都大致相同。该论文确实表明,核苷修饰的 mRNA 在诱导编码蛋白质的产生方面比未修饰的 RNA 更有效。在设计 mRNA 疫苗时,关于序列有几个关键考虑因素。因为细胞内的 mRNA 可以以分钟为单位进行生命周期,所以目标之一是使其尽可能长地持续,这是通过序列修饰实现的,这意味着 RNA 必须具有足够长的 poly-A 尾部(100-150 个碱基),为目标细胞类型适当选择非翻译区 (UTR),并且应避免与宿主 microRNA 互补,这可能会驱动 mRNA 的降解。根据记录,核苷修饰可能是当前 mRNA 疫苗有效性的关键,因为 CureVac 的疫苗使用未修饰的核苷,结果乏善可陈(尽管不可否认,这并不是 CureVac 的平台与辉瑞/BioNTech 和 Moderna/NIH 的平台之间的唯一区别)。具有讽刺意味的是,Malone 后来对 CureVac 的技术给予了全力支持,因为(我只能推断)它更接近他的专利所包含的工作。
让我们来了解一下刺突蛋白和 mRNA 的这种持久性的重要性,以及它对人类健康的可能影响。在讨论刺突蛋白时,Malone 提供了一段长篇大论,错误地声称:

B 系细胞的关键特性,通过图 10.9 来自 Murphy K, Weaver C. Janeway 的免疫生物学。第 9 版佛罗里达州博卡拉顿:CRC 出版社;2016
最初在免疫反应过程中,会出现由浆母细胞和短寿命浆细胞产生的抗体爆发。顾名思义,短寿命的浆细胞会死亡。这会导致抗体水平下降。少数细胞可能会继续变成长寿浆细胞。这些细胞主要在存活生态位的骨髓中填充,在那里它们获得免疫系统许多其他细胞的支持,但也被注意到它们在肠道等粘膜组织中存活数十年。记忆 B 细胞在遇到抗原时可以迅速被召回,分化为分泌抗体的细胞,包括长寿命浆细胞,以便在再次遇到时清除感染威胁。然而,与浆细胞不同的是,记忆 B 细胞可以适应以产生克隆,这些克隆覆盖了自上次相遇以来可能出现的新病毒变体。这形成了第二道免疫墙,与持续的抗体产生协同工作以保护宿主。
mRNA 疫苗的机制与任何所谓的“传统疫苗”都不同。
这是完全不正确的。mRNA 疫苗的机制实际上与任何减毒活疫苗(如 MMR)的机制极为相似。在这些疫苗的情况下,编码抗原的减毒活病毒会感染您的细胞并在其中分裂有限次,并导致您自己的细胞复制病毒抗原——就像 mRNA 疫苗一样。不同之处在于,mRNA 疫苗规避了许多与减毒活疫苗相关的棘手问题,例如可能恢复毒力、无法将其提供给免疫功能低下的人,以及其中一些疫苗可能存在水平传播。
刺突蛋白本身具有致病性
这是对刺突蛋白是 “有毒 ”的说法的重新包装,我之前在这里详细讨论过。与链接博客文章中讨论的其他工作一样,这项研究还发现,刺突蛋白可能短暂存在于疫苗接种者的血液中,然后在几天内迅速消失。这项研究补充说,在血液中,刺突蛋白被抗体覆盖(至少在第二次给药时是肯定的),这限制了它做任何我们可能关心的事情的能力(事实上,即使有刺突蛋白的超抗原假说,中和抗体实际上确实可以保护免受超抗原的侵害)。此外,mRNA 疫苗的刺突蛋白是融合前稳定的刺突蛋白,因此不能轻易融合细胞膜。这种质量被认为与 SARS-CoV-2 不同变体的致病性直接相关。
错误地声称针对刺突蛋白的抗体在预防感染或传播方面不是很好
这在猕猴模型中被明确证明是错误的,其中高水平的抗体实际上确实可以阻止感染,从而阻止传播,事实上,针对刺突蛋白的抗体是防止感染和传播的最有力证明的手段。还有大量数据表明,即使在 Delta 和 Omicron 占主导地位的时期,mRNA 疫苗在减少传播方面也有作用,这甚至出现在由于共享空间成员之间高度接触而具有传播高风险的家庭中。实际上,我们从对疫苗后感染的研究(例如这次)中对这个问题有很大的了解。事实上,马龙讨论的研究确实支持这一点,mRNA 疫苗引发的免疫反应并没有减弱。即使在接种疫苗 9 个月后,针对刺突蛋白的记忆 B 细胞仍继续增加。那么,为什么随着疫苗接种时间的进行,我们会看到更多的疫苗接种后感染呢?答案实际上就在抗体中。虽然抗体水平很高,但通过不完全清楚的机制,它们能够泄漏到 SARS-CoV-2 引发感染的上呼吸道,并通过与刺突蛋白结合并阻止与刺突和 ACE2 的相互作用来阻断感染。随着时间的推移,最初由疫苗反应引起的短寿命浆细胞会死亡,我们再次变得容易受到感染。然而,我们从疫苗接种中获得的记忆 B 细胞是为变异做好准备的,并且可以在 3-4 天内快速募集,以抵御和大幅限制感染,与免疫系统的其他关键参与者(如 T 细胞)协同作用。正因为如此,研究人员目前正在付出巨大努力来开发将在上呼吸道产生持久免疫力的粘膜疫苗,包括高级临床试验中的几种候选疫苗。然而,在此期间,非药物干预仍然是必要的,以帮助控制传播。一个非常有趣的版本称为“初生和刺突”,到目前为止只有临床前数据,但该数据非常清楚地表明,在防止 SARS-CoV-2 感染方面优于单独的肌肉注射 mRNA 疫苗接种,并且进一步表明,即使存在远亲刺突(在这种情况下来自 SARS-CoV-1),也可以拉入 mRNA 疫苗的免疫反应,以引发极其广泛的局部粘膜保护。最近还描述了另一种潜在的策略,即鼻内给药编码 S1(刺突蛋白的顶部)、N(核衣壳)和 RdRP(RNA 依赖性 RNA 聚合酶)的腺病毒载体,它也显示出优于单独肌肉注射策略的保护。不过,这种疫苗将更多地依赖于 T 细胞来保护和阻断传播,而不是 B 细胞和抗体,因为针对 N 和 RdRP 的抗体的价值尚未确定,而 T 细胞对它们的反应的价值是(例如,这里和这里)。在此期间,加强剂量可以通过增加长寿命浆细胞库来帮助提高基线抗体水平,并在适当的时候提供抗体爆发,例如在激增之前或中间,它们可以通过减少感染的机会来显着帮助遏制传播。
马龙随后再次歪曲了数据,声称作者指出 mRNA 疫苗的抗体反应更倾向于 IgG 而不是 IgM 和 IgA,这意味着没有产生,然后歪曲了这些类型抗体中每一种的作用。IgM 和 IgA 在粘膜保护中都起作用,但这并不是全部。首先,发挥粘膜保护作用的是绝大多数分泌型 IgA,而不是在血浆中循环的单体 IgA。增加血浆 IgA 水平不会增加粘膜中的 IgA——IgA 必须由相关粘膜组织固有层内的抗体分泌细胞产生。其次,IgM 是每个 B 细胞在其发育过程中产生的第一种抗体亚型,作为其发育的一部分,它必须经历向其他亚型(如 IgG)的类别转换。尽管如此,在疫苗接种者中观察到向 IgA 的类别转换(正如我所说,他们的抗体总是必须通过 IgM 阶段)。根据出版物:
IgM 和 IgA 反应的相对缺失表明疫苗制剂在驱动早期和广泛的 IgG 类别转换方面具有强大的作用,这可能是由于据报道的疫苗成分刺激的 T 辅助性 1 型极化 CD4 + T 细胞反应(Lederer等人,2020 年;Lindgren等人,2017 年;Pardi et al., 2018)。
辅助性 T 1 型极化 CD4+ T 细胞反应是通常与针对病毒(如 SARS-CoV-2!这种疫苗接种方法的目标)和细胞内细菌。
我们的开端并不乐观。
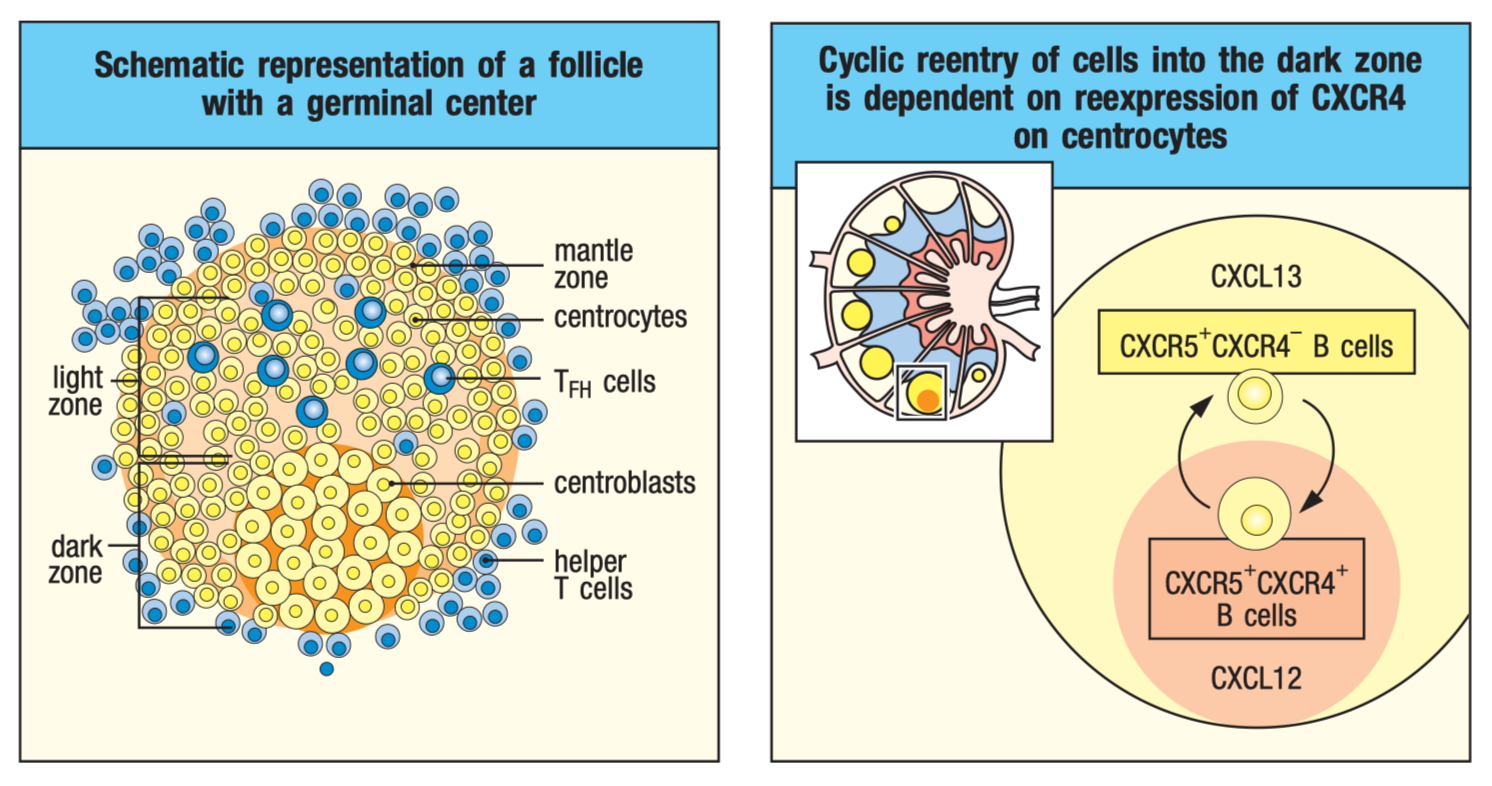
循环再进入模型描述了我们如何开发高亲和力抗体。摘要见正文。图 10.11 来自 Murphy K, Weaver C. Janeway 的免疫生物学。第 9 版佛罗里达州博卡拉顿:CRC 出版社;2016
马龙随后认为,临床试验应该从一开始就测量疫苗接种者血液中的刺突蛋白表达。我不认为这一定是一个无效的观点,但坦率地说,考虑到尽快接种疫苗的紧迫性,在要做的事情清单中增加额外的价值不明的检测似乎并不是对资源的最佳利用,尽管这是在临床前数据中使用荧光素酶编码的 mRNA 替代物进行的检查的,该数据表明来自荧光素酶的大部分信号在大约 9 天内消失.这是基于大鼠的数据,与人类相比,给予相当于大剂量的大鼠数据,它是一种不同的蛋白质,因此它可能不会直接翻译。可能是 spike 的某些东西本质上使它比荧光素酶持续时间更长,但很难确定。

莱德劳,BJ,埃勒贝迪,AH生发中心 B 细胞对 SARS-CoV-2 的反应。Nat Rev Immunol 22, 7–18 (2022)。https://doi.org/10.1038/s41577-021-00657-1
所以结果令人惊讶,但很糟糕吗?从免疫学上讲,它实际上可能非常非常好。为了解释原因,我提出了:循环再入模型。循环再进入模型解释了我们如何产生出色的抗体反应。简而言之,淋巴结内有一个称为生发中心的结构,由称为滤泡辅助细胞 (TFH) 的细胞建立。它充满了中心母细胞和中心细胞(B 细胞类型)、T 滤泡辅助细胞和滤泡树突状细胞。生发中心分为浅色区域和深色区域。在暗区,B 细胞将经历一个称为体细胞超突变的过程,其中它们快速突变编码其免疫球蛋白(抗体)的 DNA(完全随机),导致与靶抗原的结合亲和力发生随机变化。从那里,它们将迁移到光区,在那里他们将测试免疫球蛋白对抗原的亲和力,这些抗原被滤泡树突状细胞吸收。作者事实指出:
刺突抗原位于 GC 细胞周围的网状模式中,类似于滤泡树突状细胞过程的染色(图 7B)。
这表明这种刺突蛋白实际上被滤泡树突状细胞吸收并促进生发中心反应。结合最紧密的 B 细胞能够从 TFH 获得帮助。其中,它们可能会接收到分化为长寿命浆细胞、记忆 B 细胞的信号,或者被送回暗区进行另一轮体细胞超突变。被证明不擅长这一点的 B 细胞会因忽视而死亡。因此,这是我们进化出的一种巧妙的达尔文机制,可以产生出色的抗体,不言而喻,这个过程持续的时间越长,我们产生的高质量抗体就越多。但这里有一个关键点:为了能够测试免疫球蛋白对抗原的亲和力,您需要在生发中心有抗原。事实证明,即使在 30 周后,有些人的生发中心内也有抗原的证据。如上所述,一份出版物发现,即使在接种疫苗后 9 个月,刺突蛋白特异性的记忆 B 细胞区室仍保持稳定扩张,这表明它的持续时间甚至更长。在整个过程中,疫苗接种者正在产生针对甚至还不存在但有一天可能会出现的变体的抗体,以便我们可以武装起来并为它们做好准备。因此,即使在 60 天后,在淋巴结中发现刺突蛋白也不是我所担心的事情(如果刺突出现在肠上皮中,我可能会有点担心,但即便如此,我们也必须依靠药物警戒数据)。然而,mRNA 持续存在时间长的发现令人惊讶。尽管如此,mRNA 是核苷修饰的,不会发炎(尽管在淋巴结中这甚至可能不是一件坏事),而且它自己不能做太多事情,所以虽然我感到惊讶和印象深刻,但我也不认为这是一个安全问题。我能想象到的最糟糕的事情是淋巴结内、细胞外的 mRNA 可以被淋巴结中的某些细胞吸收(尽管这不太可能,因为裸露的 RNA 不会在没有纳米颗粒或病毒等递送载体的情况下自发地被拾取),制造更多的刺突蛋白, 并促进淋巴结中抗体的持续进化。该报的主要联系人斯科特·博伊德 (Scott Boyd) 也持相同观点,他在 Twitter 上明确指出。我想提醒所有读者,我们无法在实证科学中真正证明否定因素,所以我们能说的最好的话就是我们没有看到某种现象的证据(例如,给定的安全问题)。有关 COVID-19 和疫苗接种中生发中心反应的详细回顾,这篇文章非常好。
Finding some vaccine RNA in lymph nodes may help to explain why the viral spike protein is present there for longer times. We don';t have any evidence that this is a harmful event. 6/9
— Scott_Boyd_Lab_Stanford (@ScottBoydLab) February 10, 2022\n“,”width”:550,”height”:null,”resolvedBy”:”twitter”,”providerName”:”Twitter”}” data-block-type=”22″>
马龙还断章取义地引用了一段描述疫苗接种者血浆中刺突蛋白浓度高于重症 COVID-19 患者的段落。他还引用了一段话,指出 mRNA 疫苗接受者的抗体水平也与严重 COVID-19 患者的抗体水平一样高(由于 COVID-19 导致的 SARS-CoV-2 抗体水平与疾病严重程度相一致)。可以想象,这可能归因于个体体内产生的刺突蛋白剂量,它与一些巧妙的发现有关,即延迟干扰素和中和抗体反应与更差的结果相关。在重症患者中,延迟反应可能导致 SARS-CoV-2 在一段时间内基本不受阻碍地复制,直到其中的大坝破裂,并释放出大量 SARS-CoV-2 抗原,包括刺突。此时,免疫系统会争先恐后地试图以巨大的反应来解决感染问题。这也与严重和致命 COVID-19 患者的病毒感应途径和干扰素信号传导的遗传和获得性缺陷的发现一致。然而,正如论文作者所指出的,血液中的刺突蛋白是短暂的,与疫苗接种者不同,COVID-19 患者有……COVID-19 的。SARS-CoV-2 有大约 30 种额外的蛋白质试图确保病毒的进化成功并挫败免疫系统的作用——疫苗只有一种,如果没有其他蛋白质的功能,它本身就不能很好地帮助 SARS-CoV-2 SARS-CoV-2。在这种情况下,不存在迫切需要清除的感染。此外,负责吸收脂质纳米颗粒的主要细胞类型似乎是树突状细胞,众所周知,树突状细胞具有释放细胞外囊泡以进行抗原呈递的怪癖,这可能解释了刺突蛋白存在于血液中的原因。一项动物研究也有类似的发现,表明这些囊泡起到疫苗的作用。这很有趣,因为在少数人中,在 mRNA 疫苗接种后检测到针对刺突蛋白的粘膜抗体反应,这可能提供解释,但这只是我的猜测。
事情是这样的:在临床试验过程的每个阶段,疫苗的安全性都会受到监测。如果您声称刺突蛋白本身是有害的并且足以引起疾病,那么疾病应该在疫苗接种者身上表现出来。很明显不是,试验参与者也不例外。我认为对某些人来说,这似乎是一种应付的反应,但实际上并非如此。事实是,生物现象太复杂了,我们无法详细理解到底发生了什么——机制是我们写的故事,以使我们的观察有意义。但你知道这意味着什么吗?观察(或缺乏观察)是最重要的。现实情况是,在数十亿剂疫苗和 2 年的临床数据中,mRNA 疫苗没有明显的重大安全问题(除了心肌炎,它主要局限于某些人群,罕见,通常具有自限性但仍然很严重,并且仍然不会使疫苗的安全性低于 COVID-19;顺便说一句,马龙在 Joe Rogan 的节目和 Science Versus 上也对此提出了一些虚假声明有一集很棒的播客节目,解释了为什么他所说的是错误的或缺乏详细的上下文)。药物警戒数据将永远是我们了解疫苗安全性的最有力工具。我们可以提供很好的合理解释,说明为什么它看起来是这样或那样的,但归根结底,唯一重要的是我们是否能看到真正的安全问题,而我们不能。这留下了两种可能性:它不存在,或者我们太罕见而无法检测到,这两者都是对 mRNA 疫苗安全性的强烈认可。你可以想出一些机制来让任何事情听起来都合理(看看 Malone——他的 substack 帖子充满了听起来合理的机制,但它们在最轻微的审查下就会分崩离析),但实际结果数据总是、总是、永远是最重要的。
本文的标题中注明了印记,您可能已经听说过它被命名为更险恶且坦率地说不合适的名称“原始抗基因罪”。虽然我将在后续文章中详细讨论这个问题(如果不单独发表一篇文章太复杂了),但我认为将这个问题留给该报的首席联系人 Scott Boyd 来解释是合适的:
Imprinting in antibody responses to viruses isn't always a harmful or helpful thing; it just describes the way the immune system will preferentially respond in future. There are both negative and positive examples from imprinting effects in influenza antibody responses.
8/9
— Scott_Boyd_Lab_Stanford (@ScottBoydLab) February 10, 2022\n“,”width”:550,”height”:null,”resolvedBy”:”twitter”,”providerName”:”Twitter”}” data-block-type=”22″>
令人担忧的是,在动物试验表明 Omicron 特异性 mRNA 疫苗似乎并不比编码祖先刺突的 mRNA 疫苗具有优势之后,印记在话语中出现了很多,有些人认为这意味着疫苗无法有效引发强烈的抗 Omicron 反应。然而,现有的人类数据表明,事实并非如此。首先,多项人类研究表明,突破性感染增强了对 Omicron 以及与祖先病毒关系更密切的非 Omicron 变体的免疫反应的广度。其次,即使在接种第二剂辉瑞/BioNTech mRNA 疫苗后,Omicron 特异性反应也确实会出现,尽管它们确实需要更长的时间才能出现。随着时间的推移,针对刺突蛋白的抗体反应似乎转移到不同的区域,并且它变得更加集中在受体结合域 (RBD) 上,其中 Omicron 的刺突与祖先变体的刺突差异如此之大。第三剂祖先尖峰似乎进一步改变了它,以便能够覆盖 Omicron。但我们很快就会获得关于这个问题的明确临床试验数据,因此在此期间,所有人都要有耐心和加强剂。
Hits: 22
