Contents
Quality Risk Management
质量风险管理
Step 5
2005/11/9
目录
- 简介
- 范围
- 质量风险管理的原则
- 常规质量风险管理程序
- 4.1 职责
- 4.2 启动质量风险管理过程
- 4.3 风险评估
- 4.4 风险控制
- 4.5 风险沟通
- 4.6 风险评审
- 风险管理方法学
- 质量风险管理与业界及药政运行整合
- 定义
- 参考文献
附录I: 风险管理方法与工具
- I.1 基本风险管理简易方法
- I.2 故障模式效应分析(FMEA)
- I.3 故障模式影响与严重性分析(FMECA)
- I.4 故障树分析(FTA)
- I.5 危害分析关键控制点(HACCP)
- I.6 危害及可操作性分析(HAZOP)
- I.7 预先危险分析(PHA)
- I.8 风险排序及过滤
- I.9 辅助性统计工具
附录 II: 实施质量风险管理的潜在机会
- II.1 整合质量管理部分的质量风险管理
- II.2 药政操作部分的质量风险管理
- II.3 开发部分的质量风险管理
- II.4 厂房,设备和公用设施的质量风险管理
- II.5 物料管理部分的质量风险管理
- II.6 生产部分的质量风险管理
- II.7 实验室控制和稳定性研究部分的质量风险管理
- II.8 包装和标签部分的质量风险管理
质量风险管理
1. 导言
风险管理原则被有效地应用于许多商业和政府的领域,包括金融、保险、职业安全、公共健康、药物预警,以及这些行业的主管部门。如今,尽管在制药行业也有一些运用质量风险管理的例子,但其非常有限,且没有体现出风险管理能提供的全部贡献。另外,制药行业已经认识到质量体系的重要性,而且,质量风险管理对一个有效的质量体系来说,是一个有价值的组成部分这一点越来越明显。
通常将风险理解为,风险是由伤害发生的概率及伤害严重性结合而成。然而,在不同的风险涉众中达成对风险管理应用共识仍是困难的,因为每个风险涉众可能感觉到不同的潜在伤害,对每个所发生的伤害设置不同的概率以及伤害不同的严重性属性。对于药品来说,尽管有多种的风险涉众,包括患者、医疗从业人员,以及政府和业界,运用质量风险管理都应该以保护病人为基本出发点。
药物(医疗)产品制造和使用,包括它的组份,必然要承担一定程度的风险。其质量风险仅是全部风险中的一个。重要的是要了解到,产品质量应当贯穿产品的生命周期,这个属性对于药物(医疗)产品保持与临床研究时一致是非常重要的。通过前瞻意义上辨识与控制在研发与制造中的潜在质量问题,一个有效的质量风险管理方法能进一步给患者提供高质量药物(医疗)产品质量的保证。另外,如果出现质量问题,则采用质量风险管理可以改善决策。有效的质量风险管理可以促使做出更好,更基于可靠信息的决策,可以为业界药政部门提供更强大应对潜在风险的能力的保证,并且会对药政监督的水平和范围直接产生有利影响。
本文件的目的是提供一个质量风险管理的综合方法。其作为一个基础的或资源性的文件,其独立并支撑其它的ICH 质量文件,并对现有的质量实践、要求、标准以及制药行业指南与药政环境进行补充。其将明确提供质量风险管理的原理,以及一些工具,其可以确保在药政部门和业界在考虑到贯穿在整个产品生命周期的原料药和药物(医疗)产品质量时,做出更有效与更一致的基于风险的决策。其并未试图建立任何超越当前管理要求的新的要求。
使用一个正式的风险管理过程(使用公认的工具,和/或内部程序,例如标准操作程序)既不总是恰当的,也不总是必须的。采用非正式的风险管理过程(使用经验的工具,和/或内部程序)也是可以考虑接受。恰当运用质量风险管理可以促进,但并不能免除业界遵守药政要求的责任,也不能取代业界和药政部门之间适当的沟通。
2. 范围
本指南给出了质量风险管理的原理以及一些工具的例子,其可以应用于药品质量的不同方面。这些方面包括开发、制造、分销以及原料药、药物(医疗)产品、生物和生物技术产品(包括在药物(医疗)产品、生物和生物技术产品中使用到的原料、溶剂、赋形剂、包装和标签材料) 整个生命周期的检查和注册/评审过程。
3. 质量风险管理的原则
质量风险管理的两个基本原则为:
- 应该基于科学知识和最终与对患者的保护相关联对质量风险进行评价;以及
- 质量风险管理过程的力度、正式程度和文件化程度都应该与风险水平相适应。
4. 常规质量风险管理程序
质量风险管理指的是对贯穿于药物(医疗)产品生产周期中的风险进行评估、控制、沟通及评审的系统过程。图中概括了质量风险管理模式(图1)。也可以使用其他模式。所强调的构架中每个组成,可依不同情况而有所不同的,但一个完善的过程会更加详细地整合考虑到所有因素,其与具体的风险有相同的水平。
图1:典型的质量风险管理过程概述
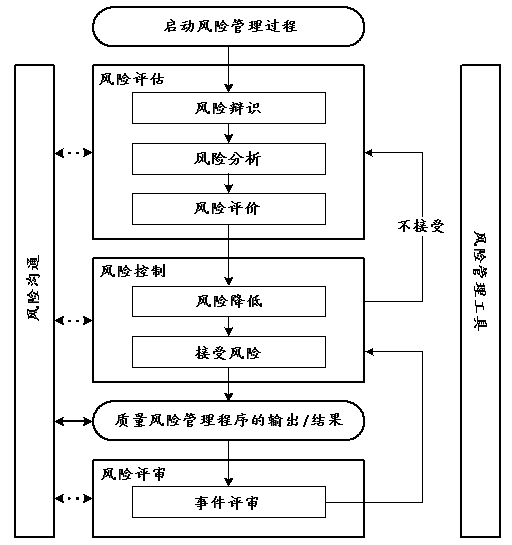
在上图中并未标明判断结点,因为判断可出现在这个过程中的任何一个点。这些判断将会退回到前一步,并寻求进一步的信息以调整风险模型,甚至根据支持这个判断的信息来终止风险管理过程。注:在流程图中的“不接受”不仅仅是依据法定、立法或药政要求,同样也需要返回风险评估过程。
4.1 职责
风险管理活动通常,但并不总是,需要多学科的团队参与。当形成一个团队时,应当要包括适当领域的专家(例如,质量部门、商业开发、工程、药政、生产运行、销售和市场、法律和临床),及精通质量风险管理过程的个人。
决策者应当:
- 负责在其组织内各职能部门间协调质量风险管理;以及,
- 确保明确,开展与评审了质量风险管理过程,并有适当的资源。
4.2 启动质量风险管理过程
质量风险管理包括那些用于协调、促进和改善做出与风险相关的基于科学的决策系统过程。可能用于启动和策划一个质量风险管理过程的步骤可能包括以下几点:
- 明确问题和/或风险问题,包括辨识潜在风险相关假设;
- 收集与风险评估相关的潜在危险、伤害或影响人体健康的背景信息和资料和/或数据;
- 辩识领导与必要的资源;
- 指定风险管理程序的时限、交付日期与决策水平。
4.3 风险评估
风险评估:其包括辨识危险因素与暴露在这些危险因素(定义于后)相关风险的分析和评估。质量风险评估开始于一个明确的问题或风险问题。当被讨论的风险被明确定义后,则将会很容易确定适当的风险管理工具(见第5 节中的例子)和需要用于风险问题说明的资料类型。在风险评估时,作为明确定义风险的辅助工具,通常如下这三个基本问题是非常有用的:
- 什么可能出错?
- 会出错的可能性(概率)是什么?
- 结果(严重性)是什么?
风险辨识:其是指参照风险问题或问题描述,系统地运用信息来辨识危险因素。这些信息可能包括历史数据、理论分析、意见以及风险涉众的考虑。风险辨识关注“什么可能出错?”这个问题,包括辨识可能的结果。这为进一步的质量风险管理过程奠定了基础。
风险分析:其是对风险所关联已经辨识了的危险因素进行估计。它是对发生事件可能性与及灾害严重性进行定量或定性过程。在一些风险管理工具中,探测伤害的能力(可检测性)同样是在估计风险中的因素。
风险评价:其是比较已经辨识和分析的风险与给定的风险标准进行比较。风险评价考虑到了所有这三个基本问题的证据强度。
在进行一个有效的风险评估时,数据集的完美性很重要,因为它决定了输出的质量。显示假设及合理资源不确定性将会加强输出的可靠性,并且/或有助于辨识其限度。不确定性是由于关于过程不完整的知识以及其期望的或非期望的变异性综合造成。典型的不确定来源包括制药科学知识差距、对过程理解差距、伤害来源(如一个过程的失效模式,变异行来源)以及发现问题概率。
风险评估的输出既是一个对风险定量估计也是一个对风险范围的定性描述。当风险被定量地表达,则运用数值表达它的概率。另外,风险还可以运用如“高”、“中”或“低”等定性描述词来表达,对其应该尽可能详细地确定。一些时候,使用“风险记分”来进一步确定描述风险的排列。在定量风险评估中,对一个风险估计能提供一个特定结果的可能性,给出一系列产生风险状况。因此,定量风险评估对于在某个时间的特定后果非常有用。另外,一些风险管理工具采用了相对的风险度量将多种级别的严重性和概率合并到一个完整的相对风险估计中。在一个记分过程的中间步骤有时候可以使用定量风险评估。
4.4 风险控制
风险控制:其包括做出的降低和/或接受风险的决定。风险控制的目的是降低风险到一个可接受的水平。用于风险控制所作工作量应该与风险的显著性相称。决策者可能会采用不同的过程,包括收益成本分析,来了解最佳的风险控制水平。
风险控制可能会集中在下列问题:
- 是否风险超过了一个可接受的水平?
- 什么方法可以用来降低或消除风险?
- 效益、风险和资源之间的恰当的平衡点是什么?
- 控制已经所辨识的风险是否引入新的风险?
风险降低:其是着眼于当风险超过了某个特定(可接受)水平(见图1)后缓和或避免质量风险的过程。风险降低可能包括用于减缓伤害的严重性和概率所采取的行动。改善危险因素和质量风险可检测性的过程也可能作为一个风险控制策略中的一个部分。通过实施风险降低措施,新的风险可能被引入到系统中或者显著增加其它已经存在的风险。因此,在实施风险降低过程后,可能会适当地返回到风险评估中对风险中任何可能的改变进行辩识和评价。
接受风险:其是一个接受风险的决定。风险接受可以是一个接受剩余风险的正式决定或者是当剩余风险不具体时的被动接受。对于一些类型的伤害,甚至最好的质量风险实践也未必能全部消除风险。这些情况下,可以认为已应用了恰当的质量风险管理策略,并且质量风险已降低到一个特定(可接受)的水平。这个(特定)可接受的水平将会取决于许多参数,并且具体情况具体判断定。
4.5 风险沟通
风险沟通:是在决策者和其它人员之间分享有关风险和风险管理的信息。各方之间可以在任何风险管理过程阶段进行沟通(见图1 的点划线箭头)。质量风险管理过程的输出/结果应当进行适当的沟通和存档(见图1 的实线箭头)。沟通有可能包括这些相关方,例如,药政与业界、业界与患者、在一个公司、业界或药政当局内部等。所包括的信息应该与质量风险的存在性、性质、形式、概率、严重性、可接受性、控制、处理、可检测性或其它有关方面。沟通不需要对每个风险接受都进行。如果在业界和药政当局之间,就可能受影响进行质量风险管理决策沟通,则这些沟通可能通过现有的规章或指南中所说明的渠道来进行。
4.6 风险评审
风险管理应当是质量管理过程中的一个进行部分。应当实施一个评审或对事件进行监控的机制。
对风险管理过程输出/结果进行评审应当考虑采用新的知识和经验。一旦开始了某个质量风险管理过程,则该过程应该一直应用于可能影响初始质量风险管理决策的事件,而不管那些事件是已被计划的(如产品评审、检查、审计、变更控制结果)或未计划的(如从失败调查的根本原因、检查、召回)。评审频率应该取决于风险水平。风险评审可能包括对风险接受决策重新考虑(4.4 节)。
5. 风险管理方法学
质量风险管理支持科学和实际方法来进行决策。在现有关于风险概率,严重性和一些事件的可检测性评估知识的基础上,其提供文件的,透明的和可重复的方法来实现质量风险管理程序的步骤。
传统上,对于质量的风险的评估和管理是基于多种非正式的方式(经验的,和/或,内部程序),例如,现象汇总、趋势和其它资料。此类方法继续提供有用的信息,这些信息可以支持诸如处理投诉、质量缺陷、偏差与资源分配。
此外,制药业界与药政可以使用公认的风险管理工具,和/或,内部程序(例如,标准操作程序)来评估和管理风险。以下并非是这些工具的一个详尽的列表(详细在附件1 和第8 章):
- 基本风险管理简易方法(流程图,核对单等);
- 故障模式效应分析(FMEA);
- 故障模式影响与严重性分析(FMECA);
- 故障树分析(FTA);
- 危害分析关键控制点(HACCP);
- 危害及可操作性分析(HAZOP);
- 预先危险分析(PHA);
- 风险排行与过滤;
- 辅助性统计工具。
在原料药和药物(医疗)产品质量的特定领域运用这些工具可能是恰当的。质量风险管理方法以及辅助统计工具可以联合使用(如,概率性风险评估)。联合使用提供了灵活性,而这种灵活性可以促进质量风险管理原则的应用。
质量风险管理的严格程度与和形式应当反映可利用的知识和所关注问题的复杂性,和/或严重性相当。
6. 质量风险管理与业界及药政运行整合
质量风险管理是一个过程,当将其整合到质量体系中时(见附录II)可以支持基于科学和实践的决策。正如在简介中所简述的,恰当地运用质量风险管理并不能免除业界遵守药政的要求。然而,有效的质量风险管理可以促使做出更好和更有远见的决策,它可以为管理者提供业界更多的应对潜在风险能力的保证并且可能会影响直接监管的范围和水平。另外,质量风险管理可以促使资源能被所有部门更好地运用。
对业界以及药政人员进行质量风险管理的培训可以更好地了解决策过程,并且对质量风险管理的结果建立信心。
质量风险管理应该与现有的运作和相应文件系统恰当整合。附录II 提供了一些用到质量风险管理过程状况的例子,其可对不同的药品运作提供信息。所提供的这些例子只是出于说明的目的,其不应该被认为是一个权威性的或详尽的列表。而且它们也没有试图建立任何新的超越当前管理文件中列出的要求的期望。
业界与药政运作的例子(见附录II):
- 质量管理。
业界运作与活动的例子(见附录II):
- 开发;
- 设施、设备与公共设施;
- 物料管理;
- 生产;
- 实验控制和稳定性试验;
- 包装与贴标签。
药政运作的例子(见附录II):
- 检查活动与评估活动。
当药政决策将会持续在某个区域基础上应用时,对质量风险管理原则的一般了解和应用可以在相同的信息基础上促进管理者之间的相互信心并且促使他们做出更一致的决策。这个合作对于整合和支持质量风险管理实践的政策和指南的开发非常重要。
7. 定义
决策者:
有能力和权力做出恰当的并及时的质量风险决策的人。
可检测性:
发现或确定危险存在,出现或事实的能力。
伤害:
对健康的损害,包括可能由于产品质量或有效性损失引起的损害。
危险:
潜在的伤害来源(ISO/IEC 指南51)。
产品生命周期:
从最初的开发到上市,直到产品的停止这个产品生命的所有阶段。
质量:
对于一个产品,系统或过程实现需求的内在性质程度(见ICH Q6A definition specifically for “quality” of drug substance and drug (medicinal) products)。
质量风险管理:
用于评估,控制,沟通和评审药物(医疗)产品贯穿整个产品生命周期质量风险的一个系统化过程。
质量体系:
实施质量方针,保证符合质量目标所有方面的总合。
要求:
明示或隐含的需求或患者或其代理的期望(例如:保健专家,药政或立法人员)。在本文件中,“要求”不仅仅指法定的,立法或药政的要求,也包括其需求或期望。
风险:
伤害发生的概率以及伤害的严重性的结合(ISO/EC 指南51)。
风险接受:
接受风险的决定(ISO 指南73)。
风险分析:
对风险与已经辨识的危险因素的估计。
风险评估:
在一个风险管理过程中用于支持所做的风险决策的组织信息的系统过程。其包含对危险因素辨识,对暴露在这些危险因素相关风险的分析,评价。
风险沟通:
在决策者和其它风险涉众之间分享有关风险以及风险管理的信息。
风险控制:
实施风险管理决策的行动(ISO 指南73)。
风险评价:
用一个定性或定量尺度对已经估计风险与给定的风险标准进行比较以确定风险显著性。
风险辨识:
系统地运用信息来辨识风险问题或问题描述的伤害(危险因素)潜在来源。
风险管理:
系统化应用质量管理方针,程序以及对风险评估,控制,沟通以及评审任务中的实践。
风险降低:
用于减少伤害发生的概率以及伤害的严重性所采取的行动。
风险评审:
考虑(如果可能)运用关于风险新的知识和经验来评审或监测风险管理过程的输出/结果。
严重性:
对于某个危险因素可能结果的度量。
风险涉众:
任何能影响,被影响到或认识到自己会被风险所影响的个人,团体或组织。决策者也许也会是风险涉众。本指南的目的,主要的风险涉众是患者,卫生执业者,药政以及业界。
趋势:
一个统计学术语,指一个变量变动的方向或比率。
8. 参考文献
- ICH Q8 Pharmaceutical Development.
- ISO/IEC Guide 73: 2002 – Risk Management – Vocabulary – Guidelines for use in Standards.
- ISO/IEC Guide 51: 1999 – Safety Aspects – Guideline for their inclusion in standards.
- Process Mapping by the American Productivity & Quality Center, 2002, ISBN 1928593739.
- IEC 61025 – Fault Tree Analysis (FTA).
- IEC 60812 Analysis Techniques for system reliability – Procedures for failure mode and effects analysis (FMEA).
- Failure Mode and Effect Analysis, FMEA from Theory to Execution, 2nd Edition 2003, D. H. Stamatis, ISBN 0873895983.
- Guidelines for Failure Modes and Effects Analysis (FMEA) for Medical Devices, 2003 Dyadem Press, ISBN 0849319102.
- The Basics of FMEA, Robin McDermott, Raymond J. Mikulak, Michael R. Beauregard 1996, ISBN 0527763209.
- WHO Technical Report Series No 908, 2003, Annex 7 Application of Hazard Analysis and Critical Control Point (HACCP) methodology to pharmaceuticals.
- IEC 61882 – Hazard Operability Analysis (HAZOP).
- ISO 14971: 2000 – Application of Risk Management to Medical Devices.
- ISO 7870: 1993 – Control Charts.
- ISO 7871: 1997 – Cumulative Sum Charts.
- ISO 7966: 1993 – Acceptance Control Charts.
- ISO 8258: 1991 – Shewhart Control Charts.
- What is Total Quality Control?; The Japanese Way, Kaoru Ishikawa (Translated by David J. Liu), 1985, ISBN 0139524339.
附录I: 风险管理方法与工具
本附录的目的在于提供一些业界和药政用于质量风险管理的基本工具的概述和参考一个总体轮廓。这些参考是作为一个辅助以获得某一特定工具的更多知识和细节。其并不是一个完整的列表。重要的是知道并不是任何一个或一套工具都可以应用于每一个质量风险管理程序的具体情况。
I.1 基本风险管理简易方法
一些简单的技术常用来组织资料以及简单决策制构成风险管理。这些简单技术包括:
- 流程图;
- 核对单;
- 过程图;
- 因果图(也称为石川图或鱼骨图)。
I.2 故障模式效应分析(FMEA)
故障模式效应分析(见IEC 60812)提供了一个评价过程潜在故障模式以及在输出和/或产品性能上的可能效应。一旦建立了故障模式,可以采用风险降低可以用于消除,包容,降低或控制潜在故障。故障模式效应分析依赖于对产品与过程的了解。故障模式效应分析有系统地将复杂过程分析方法分解为易操作的几个步骤。其对于汇总故障重要模式,引起这些故障的因素以及这些故障的可能的效应,是一个强有力的工具。
潜在应用领域
故障模式效应分析可以用来列出需优先考虑的风险并且监督风险控制活动的有效性。
故障模式效应分析可以用于设备与设施,并且可能用于分析一个制造运作,以及对产品和过程的影响。其辨识在一个脆弱系统中要素/操作。故障模式效应分析的输出/结果可以作为设计,或进一步分析或作为部署资源的指导。
I.3 故障模式影响与严重性分析(FMECA)
故障模式效应分析可能会延伸用来整合成为一个对结果的严重程度的调查,它们各自发生的概率以及它们的可检测性,并且可能成为一个故障模式影响与严重性分析(FMECA;见IEC 60812)。为了进行这样一个分析,应该建立产品或过程规范。故障模式影响与严重性分析可以辨识在哪里应该有另外的预防措施以使风险最小化。
潜在应用领域
故障模式影响与严重性分析在制药业界里的应用最可能是用于与制造过程相关的故障以及风险;然而,它并不局限于这方面的应用。故障模式影响与严重性分析的输出是对于每个故障模式给出一个相对风险的“分值”,其被用于在风险基础上对这些模式进行排序。
I.4 故障树分析(FTA)
故障树分析工具(见IEC 61026)是一个用来假设一个产品或过程功能性故障的方法。该工一次评价一个系统(或子系统)的故障,但可通过辨识因果链来合并引起故障的多种原因。它的结果是以故障类型树的形式以图表现出来。在该树的每个级,故障模式的结合是以逻辑算符(“与”门,“或”门等)来描述的。故障树分析依赖于专家对过程的了解以辨识原因因素。
潜在应用领域
故障树分析可以用于建立达到故障根本原因的途径。故障树分析可以用来调查投诉或偏差以便全面地理解它们的根本原因,并且确保所预期改进将会完全解决该问题,并且不会导致别的问题发生(如,解决了一个问题但引起了另不同的问题)。故障树分析对于评价多个因素如何影响一个给定的问题来说是一个有效工具。故障树分析输出结果包括了一个可视的故障模式描述。它对于风险评估以及开发监督程序都非常有用。
I.5 危害分析关键控制点(HACCP)
危害分析关键控制点是确保产品质量,可靠性及安全性的(见WTO WHO Technical Report Series No 908, 2003 Annex 7)系统的,前瞻的以及预防性的工具。它是一个结构性的方法,其通过采用技术和科学原则去分析,评价,预防和控制由于产品的设计,开发,生产和使用带来的风险或不利结果及危险因素。
危害分析关键控制点由下列七个步骤组成:
(1) 对过程的每一步进行危险分析并辨识预防措施;
(2) 确定关键控制点;
(3) 建立关键限度;
(4) 建立一个监测关键控制点的监控体系;
(5) 建立当监测显示关键控制点并不在控制状态时应该采取的纠正措施;
(6) 建立证实危害分析关键控制点体系在有效运转的系统;
(7) 建立一个保持记录的系统。
潜在应用领域
危害分析关键控制点可用于对与物理,化学和生物危险因素(包括微生物污染)有关风险的辨识及管理。当产品和过程被充分理解来支持关键控制点辨识时,则危害分析关键控制点是最有用的。危害分析关键控制点分析的结果是一个促进对生产过程中的关键点进行监控的风险管理工具。危害分析关键控制点分析输出的是风险管理资料,其有益于关键点的监控,不仅仅在制造工艺中,而且也在其它生命周期的阶段。
I.6 危害及可操作性分析(HAZOP)
危害及可操作性分析(见IEC 61882)是基于这样一个理论基础,假定风险事件是与设计或操作意图之间的偏差造成。它是采用所谓的“引导词”来辨识危险因素的系统头脑风暴技术。“引导词”(如,否,更多,除了,部分等)被用在相关参数(如污染,温度)用来帮助辨识与正常使用或设计意图之间的潜在的偏差。它通常起用一组具有覆盖过程或产品设计及其应用等专门技术的人员。
潜在应用领域
危害及可操作性分析可以应用于原料药和制剂产品制造过程,包括外部生产以及配方,同样上游的供应业界,设备和设施上。在制药界,它还被主要用于评价过程安全性的危险因素。与危害分析关键控制点类似, 危害及可操作性分析分析的输出也是风险管理的关键操作列表。它可以促进制造过程关键点的有规律的监测。
I.7 预先危险分析(PHA)
预先危险分析是一种基于应用以前的经验,或危险因素知识或故障,来边式未来的危险因素,危险处境与可能导致伤害的事件,并对给定的活动,设施,产品或系统估计其发生概率的工具。该工具由以下组成:1)辨识风险事件发生的可能性,2)对于可能导致的健康伤害或损害程度的定性评价,3)用合并严重性和事故的可能性对危险因素进行相对排行,及4)辨识可能的补救措施。
潜在应用领域
预先危险分析在可以使用已经有技术,而无需使用更深入的技术的情况下对已有系统进行分析或对危险因素进行排序时,使用预先危险分析是很有用的。它可被应用于产品,过程与设施设计等方面,也可被用于评估通用类型产品,产品分类和具体的成品特殊产品的危险因素类型。当几乎没有设计或操作规程方面的信息时, 预先危险分析经常会被用于项目开发的早期阶段,因此,它经常作为进行进一步研究的铺垫。典型做法是,使用本章节中所描述的其它风险管理工具对用预先危险分析所确定的伤害进行进一步的评估。
I.8 风险排序及过滤
风险排序及过滤是一个用于对风险进行比较和排序的工具。对于复杂系统的风险排序典型地要求对每个风险的多个不同因素进行定性和定量评价。该工具涉及到将一个基本的风险问题分解成所需要的多个组成以抓住风险所涉及的因素。这些因素被整合成一个单独的相关风险值,则该数值可以用于对风险进行排序。“过滤器”,是以风险值的加权因素或截止的形式,可以用来衡量或使风险排序与管理或政策目标相符合。
潜在的应用领域
风险排序及过滤可能用于管理者或业界优先排序出用来做检查/审计的制造地点。当对于风险的组合以及下面的处理结果不同,并难以用单个工具进行比较时,风险排序方法尤其有效。当管理需要对相同的组织框架内部对风险进行定性和定量地评估时,风险排序也同样有效。
I.9 辅助性统计工具
统计工具可支持和促进质量风险管理。它们可以进行有效的数据评估并有助于确定数据集的显著性,并且推动决策更可靠。下面给出了在制药业界里通常会用到的一些基本的统计工具的列表:
- 控制图,例如:
– 验收控制图(见ISO 7966);
– 带警戒限的均值控制图(见ISO 7873);
– 累积控制图(ISO 7871);
– 常规控制图(见ISO 8258);
– 加权移动平均。 - 实验设计(DOE);
- 直方图;
- 排列图;
- 工序能力分析。
附录 II: 实施质量风险管理的潜在机会
本附录旨在于使业界和药政当局辨识潜在运用质量风险管理原则与工具。然而,对于特定质量管理工具的选择完全取决于特定的事件与环境。
所举的这些例子是出于说明的目的并且仅是建议可能采用质量风险管理。本附录并不试图建立任何超越现有的管理要求的新的期待。
II.1 整合质量管理部分的质量风险管理
文件
对于当前的管理要求的应用及解释进行评审;
决定对和/或开发SOP 内容,指南等需要等。
培训及教育
在员工的教育,经验及工作习惯基础上辨识初始的和/或正在进行的培训,并且对先前的培训进行周期性的评估(如,起有效性);
辨识人员的培训,经验,资格以及实际能力以进行一个可靠的操作并且不会对产品质量产生负面影响。
质量缺陷
对所怀疑的质量缺陷,投诉,趋势,偏差,调查,OOS 结果等提供辨识,评价以及沟通所怀疑的质量缺陷的潜在质量影响,投诉,趋势,偏差,调查以及超标数据结果等的基础;
促使风险沟通和确定适当的措施以说明显著的产品缺陷,与管理机构联合(如召回)。
审计/ 检查
为了定义审计的频率和范围,内部的和外部的都应该考虑如下因素:
- 现有的法规要求;
- 公司或设备全部的依从状态及历史;
- 一个公司的质量风险管理措施结果;
- 现场的复杂性;
- 生产工艺的复杂性;
- 产品的复杂性及治疗显著性;
- 质量缺陷的数量及显著性(如召回);
- 先前审计/检查的结果;
- 建筑,设备,工艺,关键人员的重大变动;
- 对于某产品制造经验(如频率,体积,批数量);
- 官方控制实验室的检测结果。
定期评审
在产品质量评审之内,为了选择,评估和解释趋势数据结果;
解释监测数据(如,为了支持一个再验证的需要,取样更改的评估)。
变更管理/ 变更控制
在药品开发和生产过程中的知识与信息基础上进行变更管理;
对变更造成可能的最终产品的影响进行评价;
对厂房,设备,物料,制造工艺或执行的技术转移的变更对产品质量的影响进行评价;
确定在变更之前要采取的措施,如另外的检测,(再)定性,(再)验证,与管理者沟通。
持续改进
贯穿产品生命周期的全部过程的公共设施持续改进。
II.2 药政操作部分的质量风险管理
检查与评估活动
促进资源分配包括,例如,检查计划,频率和强度(见附录II.1 中的“审计”部分);
评估其有效性,例如,质量缺陷,可能的召回以及检查发现;
确定适当性以及检查后的管理类型;
有系统地评估由业界递交的信息,包括药品开发信息;
评估所计划的变更或更改造成的影响;
辨识哪些风险是应当要让检查官和评审官共享的,以更好地理解如何控制风险和/或进行某次检查的需要(比如:参数放行,工艺过程分析技术(PAT))。
II.3 开发部分的质量风险管理
设计产品质量以及其制造工艺以便一贯地传递产品预期的性能(见ICH Q8);
加强对产品的更宽范围的物料性质(如,质粒大小分布,含水量,流动性),工艺操作以及工艺参数等的了解;
对原材料,溶剂,活性药物中间体(API)-起始原料,API 本身的,赋形剂或包材的关键性质进行估计;
建立适当的规格标准,辨识关键的工艺参数以及建立制造控制(如,运用从药品开发研究得到的关于质量属性的临床显著性,以及在生产工艺中控制它们的能力的信息);
为了减少质量性质的变异:
- 减少产品及物料的缺陷;
- 减少生产缺陷;
评估与放大和技术转移有关的额外的研究的需要(如生物等效性,稳定性);
使用“设计空间”的概念(见ICH Q8)。
II.4 厂房,设备和公用设施的质量风险管理
厂房/ 设备的设计
当设计如建筑和厂房时,为了确定合适的地方,例如,
- 物流和人流;
- 使污染最小化;
- 害虫控制措施;
- 避免混淆;
- 开放相对于密闭设备;
- 洁净室相对于隔离技术;
- 专用或隔离的设施/设备。
为了确定与产品接触的合适的设备和包装的物料(如不锈钢级别,垫圈,润滑剂的选择);
确定合适的公用设施(如,蒸汽,气体,能源,压缩空气,加热,空调系统(HVAC),水);
对于关联的设备确定合适的预防性维修(如所需要的必须的备用部件清单)。
设施的卫生状况
保护产品免受环境伤害,包括化学的,微生物的,物理伤害(如,确定合适的衣服和长衣,卫生相关的);
保护环境(如人员,潜在的交叉污染)免受到所生产的产品造成的相关伤害。
厂房/设备/设施的确认
确定厂房,建筑,生产设备以及/或实验室仪器(包括适当的校正方法)的确认的范围和广度。
设备清洁以及环境控制
在目标使用的基础上区分影响和决策(如,多相对于单个,批相对于连续生产);
确定可接受的清洁验证限度。
校正/预防性维修
设立合适的校正及维修时间表。
计算机系统以及计算机控制设备
选择计算机硬件和软件的设计方案(如,模块,结构,故障耐受性);
确定验证的广度,如
- 辨识关键操作参数;
- 要求与设计的选择;
- 代码评审;
- 检测和测试方法的广度;
- 电子记录及信号的可信度。
II.5 物料管理部分的质量风险管理
对供应商和合同厂家进行评估和评价
对供应商和合同厂家提供一个全面的评估(如审计,供应商质量协议)。
起始物料
对与起始物料变动相关的差异以及可能的质量风险进行估计(如,时长,合成路线)。
物料使用
确定隔离使用物料是否合适(如,为了进一步内部加工);
确定重处理,返工,使用回收物料的合适性。
贮藏,后勤以及分装条件
对安排的适当性以确保保持适当的以及运输条件(如,温度,湿度,容器设计);
测定在不同于ICH 其它指南规定的储存和运输条件对产品质量的影响(例如,冷链管理);
维持基本设施(如,确保正确运输条件的空间,临时贮藏,危险物料和控制物料的处理,海关报关);
提供适当信息以便确保药品有效性(例如,供应链的风险排行)。
II.6 生产部分的质量风险管理
验证
采用最差状况方法来确定验证,规格以及验证活动(如分析方法,工艺,设备和清洁方法)的范围和程度;
测定跟踪措施(如,取样,监控以及再验证)的广度;
区别关键的和非关键的工艺步骤以便于设计验证研究。
工序间取样检测
评价中间工艺控制实验的频率和广度(如,证明在有效控制条件下减少的检测);
对工艺分析技术(PAT)及参数和实时释放的联合使用进行估计和证明。
生产策划
测定适当的生产策划(例如,专用的,战役现行的生产工艺顺序)。
II.7 实验室控制和稳定性研究部分的质量风险管理
超标数据结果
在调查超标数据结果期间,辨识潜在的根本原因以及改正措施。
复验期/失效期
评价中间体,赋形剂和起始原料适当的贮藏及检测的合适性。
II.8 包装和标签部分的质量风险管理
包装的设计
设计外包装以保护已经内包装的产品(如,为了确保产品可靠性,标签易读性)。
容器密闭系统的选择
确定容器密闭系统的关键性参数。
标签控制
对可能涉及到不同产品标签,包括同一标签的不同版本的混合的基础上,确定标签控制程序。
Hits: 11
- 新原料药和制剂的稳定性试验
- 稳定性试验: 新原料药和制剂的光稳定性试验
- 稳定性试验:新剂型的要求
- 新原料药和制剂稳定性试验的括号法和矩阵法设计
- 稳定性数据的评价
- 分析方法验证:文本及方法学
- 新原料药中的杂质
- 新药制剂中的杂质
- 元素杂质指南
- 关于在ICH区域内评估并推荐采用药典相关要求的指导原则
- 关于ICH区域内药典附录的评价及建议-注射剂装量检查法
- 关于ICH区域内药典附录的评价及建议-不溶性微粒检查法
- 关于ICH区域内药典附录的评价及建议-非无菌产品的微生物检查:微生物计数法
- 关于ICH区域内药典附录的评价及建议-非无菌产品的微生物检查:控制菌检查法
- 关于ICH区域内药典附录的评价及建议-非无菌产品的微生物检查:原料药及其制剂的判定标准
- 关于ICH区域内药典附录的评价及建议 -崩解时限检查法
- 关于ICH区域内药典附录的评价及建议 -溶出度检查法
- 关于ICH区域内药典附录的评价及建议 —无菌检查法
- 关于ICH区域内药典附录的评价及建议 -片剂脆碎度检查法
- 关于ICH区域内药典附录的评价及建议 —聚丙烯酰胺凝胶电泳法通则
- 关于ICH区域内药典附录的评价及建议 —毛细管电泳法
- 关于ICH区域内药典附录的评价及建议 —筛分法
- 关于ICH区域内药典附录的评价及建议 —粉末的散装密度和振实密度测定法
- 来源于人或动物细胞系的生物技术产品的病毒安全性评价
- 生物技术产品的质量:rDNA衍生蛋白质产品生产细胞的表达构建体分析
- 质量标准 新原料药和制剂的检测以及可接受标准:化学物质
- 质量风险管理
- 药品研发
- 药物致癌试验的必要性
- 人用药物的遗传毒性试验和数据分析指导原则
- 毒代动力学指导原则:毒性研究中全身暴露的评价
- 动物慢性毒性试验的周期(啮齿类和非啮齿类)
- 药代动力学:重复给药的组织分布研究指导原则
- 药物生殖毒性和雄性生育力毒性的检测
- 生物技术药品的临床前安全性试验
- 人用药延迟心室复极化(QT间期延长)潜在作用的非临床评价指导原则
- 人用药物的安全性药理学研究
- 人用药品的免疫毒性研究
- 抗癌药物的非临床评价
- 药物的光安全性评价
- 对非危及生命的疾病的长期治疗药物进行临床安全性评估的人群暴露程度
- 临床安全性数据管理:快速报告的定义和标准
- 药物警戒计划
- 研发安全性更新报告
- 临床研究报告的结构与内容
- 新药注册所需的量-效关系资料
- 引入海外临床数据时要考虑的种族因素
- 老年人群的临床研究
- 临床试验的一般考虑
- 临床试验统计原则
- 儿童用药品的临床调查
- 新抗高血压药的临床评价原则
- 基因组生物标记物、药物基因组学、遗传药理学、基因组数据和样本编码分类的定义
