Contents
Pancreatic Cancer Treatment (PDQ®)–Health Professional Version
关于胰腺癌的一般信息
本总结提供了有关胰腺外分泌癌治疗的信息。
发病率和死亡率
2025 年美国胰腺癌新发病例和死亡人数估计:[1]
- 新增病例:67,440 例。
- 死亡人数:51,980 人。
在过去的几十年里,胰腺癌的发病率显着增加。在美国,它是男性癌症死亡的第四大原因,也是女性癌症死亡的第三大原因。[1] 尽管胰腺死亡率高 癌症,其病因知之甚少。
风险因素
胰腺癌发展的危险因素包括:[2,3]
- 胰腺癌家族史。
- 吸烟。
- 肥胖。
- 慢性胰腺炎。
- 某些遗传性疾病(例如与 BRCA1、BRCA2、PALB2 和 ATM 基因相关的疾病)。
解剖学
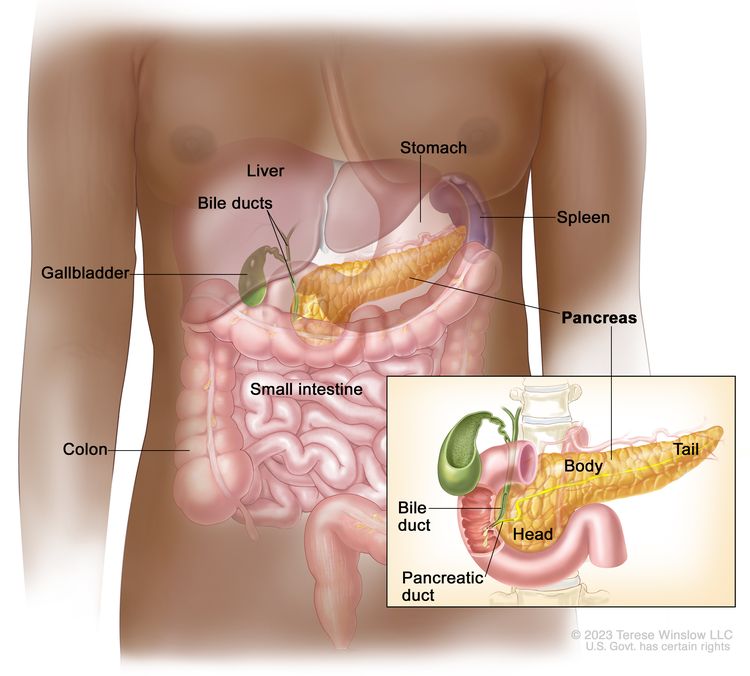
胰腺癌通常通过胰腺内的受累部位来识别。对于胰腺的头部、身体、尾部或钩突的肿块,手术方法不同。
临床特征
胰腺癌的症状取决于胰腺内肿瘤的部位和肿瘤受累的程度。
在胰腺癌的早期阶段,没有太多明显的症状。随着癌症的发展,症状可能包括:
- 黄疸。
- 浅色大便或深色尿液。
- 上腹部或中腹部和背部疼痛。
- 体重减轻的原因不明。
- 食欲不振。
- 疲劳。
诊断和分期评估
胰腺癌难以检测和诊断,原因如下:
- 胰腺癌的早期阶段没有明显的体征或症状。
- 胰腺癌的体征与许多其他疾病的体征类似,例如胰腺炎或溃疡。
- 胰腺被腹部的其他器官遮挡,很难在影像学检查中清晰地看到。
为了适当治疗胰腺癌,评估是否可以切除癌症至关重要。
成像
影像学检查可能有助于诊断胰腺癌并识别 不适合切除的疾病。影像学检查可能包括:[4]
- 螺旋计算机断层扫描。
- 磁共振成像扫描。
- 超声内镜检查。
- 微创技术,例如腹腔镜检查和腹腔镜超声检查,可用于减少剖腹手术的使用。[5,6]
腹膜细胞学检查
在一项包含 228 例患者的病例系列研究中,腹膜细胞学阳性对确定不可切除性的阳性预测值为 94%,特异性为 98%,敏感性为 25%。[7]
肿瘤标志物
胰腺癌不存在肿瘤特异性标志物。血清癌抗原 (CA) 19-9 等标志物的特异性较低。大多数胰腺癌患者在诊断时 CA 19-9 水平升高。根治性治疗期间或之后 CA 19-9 水平升高可识别肿瘤进行性生长的患者。[8][证据等级 C2]然而,CA 19-9 水平正常并不能排除复发。
预后和生存
影响预后的主要因素是:
- 肿瘤是否定位并可以完全切除。
- 肿瘤是否已扩散到淋巴结或其他部位。
胰腺外分泌癌很少能治愈,总生存率 (OS) 低于 6%。[9] 胰腺癌的并发症发生率和死亡率较高,治疗决策很复杂。应考虑组建一个全面的多学科团队进行管理。
当肿瘤真正定位于胰腺时,治愈率最高;然而,这一阶段的疾病占病例的不到 20%。对于无淋巴结转移且未超出胰腺囊外的局限性疾病和小癌症 (<2 cm) 患者,完全手术切除与 18% 至 24% 的精算 5 年生存率相关。[10][证据等级 C1]
手术切除是根治性治疗的主要方法,可为小而局部的胰腺肿瘤患者提供生存获益,但应仅与全身性治疗一起考虑。患有不可切除、转移性或复发性疾病的患者不太可能从手术切除中获益。
任何阶段的胰腺癌患者都是临床试验的候选人,因为对化疗的反应不佳, 放射疗法和常规手术。
有关正在进行的胰腺癌临床试验的信息,请访问 NCI 网站。
姑息治疗
症状的缓解可以通过常规治疗(全身化疗)来实现。
可在不影响 OS 的情况下改善生活质量的姑息性措施包括:[11,12]
- 手术或放射学胆道减压术。
- 缓解胃出口梗阻。
- 疼痛控制。
- 心理护理,以解决与胰腺癌诊断和治疗相关的潜在致残心理事件。[13]]
引用
- 美国癌症协会:2025 年癌症事实和数据。美国癌症协会,2025 年。在线提供退出免责声明.最后访问日期为 2025 年 1 月 16 日。
- Tersmette AC、Petersen GM、Offerhaus GJ 等:家族性胰腺癌患者一级亲属患胰腺癌的风险增加。临床癌症研究 7 (3):738-44,2001 年。[PUBMED 摘要]
- Nöthlings U、Wilkens LR、Murphy SP 等:肉类和脂肪摄入量是胰腺癌的危险因素:多种族队列研究。J Natl 癌症研究所 97 (19):1458-65,2005。[PUBMED 摘要]
- Riker A、Libutti SK、Bartlett DL:胰腺癌早期检测、诊断和分期的进展。外科肿瘤学 6 (3):157-69,1997。[PUBMED 摘要]
- John TG、Greig JD、Carter DC 等:胰头和壶腹周围区域癌。腹腔镜和腹腔镜超声检查的肿瘤分期。安外科杂志 221 (2):156-64,1995。[PUBMED 摘要]
- Minnard EA、Conlon KC、Hoos A 等:腹腔镜超声增强了胰腺癌分期的标准腹腔镜检查。安外科杂志 228 (2):182-7,1998。[PUBMED 摘要]
- Merchant NB、Conlon KC、Saigo P 等:腹膜细胞学阳性可预测胰腺癌的不可切除性。J Am Coll 外科杂志 188(4):421-6,1999。[PUBMED 摘要]
- Willett CG、Daly WJ、Warshaw AL:CA 19-9 是胰腺癌对新辅助放化疗的反应指数。美国外科杂志 172 (4):350-2,1996 年。[PUBMED 摘要]
- Siegel R、Naishadham D、Jemal A:癌症统计,2013 年。CA 癌症临床杂志 63 (1):11-30,2013。[PUBMED 摘要]
- Yeo CJ、Abrams RA、Grochow LB 等:胰十二指肠切除术治疗胰腺癌:术后辅助放化疗可提高生存率。前瞻性的单一机构体验。安外科杂志 225 (5):621-33;讨论 633-6,1997 年。[PUBMED 摘要]
- Sohn TA、Lillemoe KD、Cameron JL 等:1990 年代不可切除壶腹周围腺癌的手术姑息治疗。J Am Coll 外科杂志188(6):658-66;讨论 666-9,1999 年。[PUBMED 摘要]
- Baron TH:用于治疗胃肠道癌性梗阻的可膨胀金属支架。N Engl J Med 344 (22):1681-7,2001 年。[PUBMED 摘要]
- Passik SD,Breitbart WS:胰腺癌患者的抑郁症。诊断和治疗问题。癌症 78(3 增刊):615-26,1996 年。[PUBMED 摘要]
胰腺癌的细胞分类
胰腺癌包括以下癌症:
恶性
- 导管细胞癌(占所有病例的 90%)。
- 腺泡细胞癌。
- 腺鳞癌。
- 囊腺癌(浆液性和粘液性)。
- 巨细胞癌。
- 与囊性粘液性肿瘤或导管内状粘液性肿瘤相关的浸润性腺癌。
- 混合型(导管-内分泌或腺泡-内分泌)。
- 粘液癌。
- 胰母细胞瘤。
- 状囊性肿瘤(Frantz 瘤)。这种肿瘤的恶性潜力较低,仅通过手术即可治愈。[1,2]
- 状粘液癌。
- 印戒癌。
- 小细胞癌。
- 未分类。
- 未分化癌。
交界性恶性肿瘤
- 导管内状粘液瘤伴异型增生。[3]
- 粘液性囊性肿瘤伴异型增生。
- 假状实体瘤。
引用
- Sanchez JA、Newman KD、Eichelberger MR 等:胰腺囊性肿瘤。一种越来越公认的临床病理实体。拱形外科杂志125(11):1502-5,1990。[PUBMED 摘要]
- Warshaw AL、Compton CC、Lewandrowski K 等:胰腺囊性肿瘤。对 67 名患者进行了新的临床、放射学和病理观察。安外科杂志 212 (4):432-43;讨论 444-5,1990 年。[PUBMED 摘要]
- Sohn TA、Yeo CJ、Cameron JL 等:胰腺导管内状粘液性肿瘤:一种越来越公认的临床病理实体。安外科杂志 234(3):313-21;讨论 321-2,2001 年。[PUBMED 摘要]
胰腺癌的分期信息
胰腺外分泌癌的分期系统不断发展。临床分期以可切除性为指导,可切除性受手术判断的强烈影响。手术可切除性的共识指南(例如,美国国家综合癌症网络、MD 安德森癌症中心、美国肝胰胆协会和国际肝胰胆协会)继续完善,但传统上根据以下肿瘤特征进行分层:
- 可切除:无血管受累的肿瘤。
- 临界可切除:累及脉管系统、累及局部结构或其他 R1 切除高风险证据的肿瘤。
- 局部晚期:具有局部浸润性(主要是血管受累)的肿瘤,无法进行手术干预。
- 转移性:癌症已从原发性胰腺肿瘤扩散到其他器官。
美国癌症联合委员会 (AJCC) 已通过 TNM(肿瘤、淋巴结、转移)分类指定分期。[1]
AJCC 阶段分组和 TNM 定义
| 阶段 | TNM | 描述 | 插图 |
|---|---|---|---|
| T = 原发性肿瘤;N = 区域淋巴结;M = 远处转移。 | |||
| 一个经 AJCC 许可转载:胰腺外分泌。在:Amin MB、Edge SB、Greene FL 等人,编辑:AJCC 癌症分期手册。第 8 版。纽约州纽约市:施普林格出版社,2017 年,第 337-47 页。 | |||
| 0 | Tis、N0、M0 | Tis = 原位癌。这包括高级别胰腺上皮内瘤变 (PanIn-3)、伴有高度异型增生的导管内状粘液性肿瘤、伴有高度异型增生的导管内肾小管状肿瘤和伴有高度异型增生的粘液性囊性肿瘤。 | 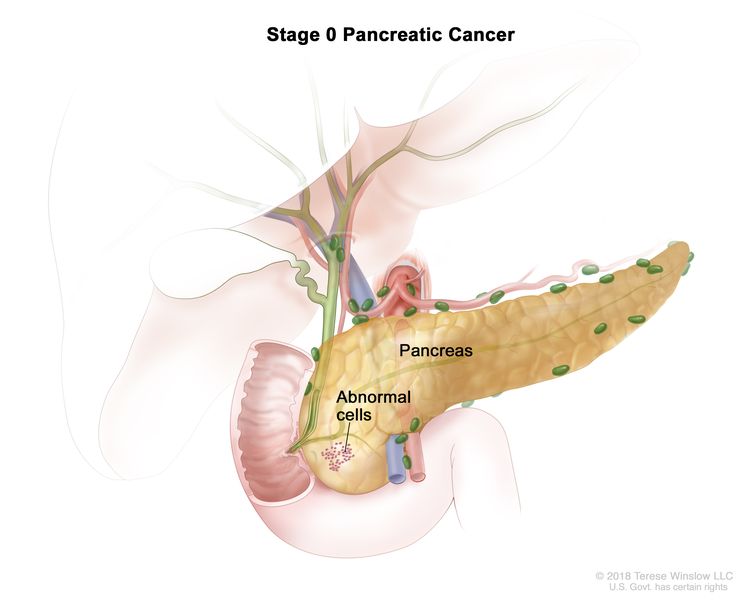 |
| N0 = 无区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| 阶段 | TNM | 描述 | 插图 |
|---|---|---|---|
| T = 原发性肿瘤;N = 区域淋巴结;M = 远处转移。 | |||
| 一个经 AJCC 许可转载:胰腺外分泌。在:Amin MB、Edge SB、Greene FL 等人,编辑:AJCC 癌症分期手册。第 8 版。纽约州纽约市:施普林格出版社,2017 年,第 337-47 页。 | |||
| IA (国际) | T1、N0、M0 | T1 = 肿瘤最大尺寸 ≤2 cm。 | 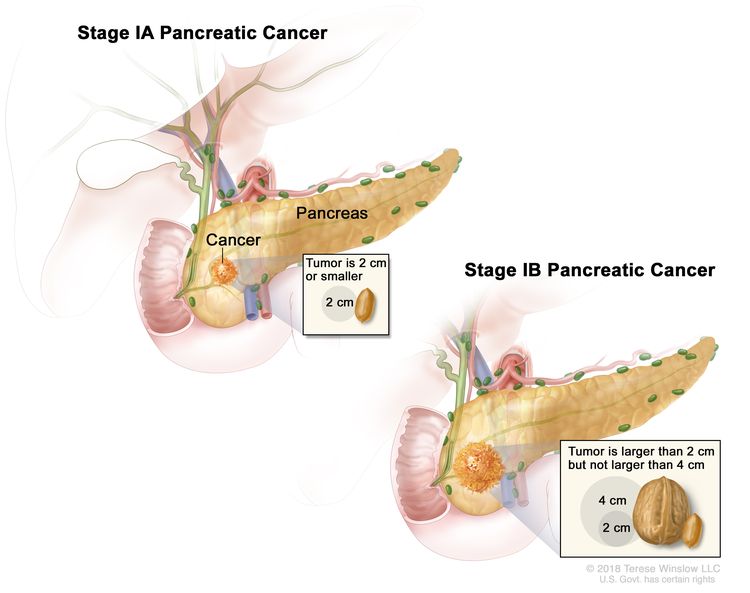 |
| –T1a = 肿瘤最大尺寸 ≤0.5 cm。 | |||
| –T1b = 肿瘤最大尺寸 >0.5 cm 和 <1 cm。 | |||
| –T1c = 肿瘤最大尺寸 1-2 cm。 | |||
| N0 = 无区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| 国际文凭 | T2、N0、M0 | T2 = 肿瘤 >2 cm 和最大尺寸 ≤4 cm。 | |
| N0 = 无区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| 阶段 | TNM | 描述 | 插图 |
|---|---|---|---|
| T = 原发性肿瘤;N = 区域淋巴结;M = 远处转移。 | |||
| 一个经 AJCC 许可转载:胰腺外分泌。在:Amin MB、Edge SB、Greene FL 等人,编辑:AJCC 癌症分期手册。第 8 版。纽约州纽约市:施普林格出版社,2017 年,第 337-47 页。 | |||
| IIA | T3、N0、M0 | T3 = 肿瘤最大尺寸 >4 cm。 | 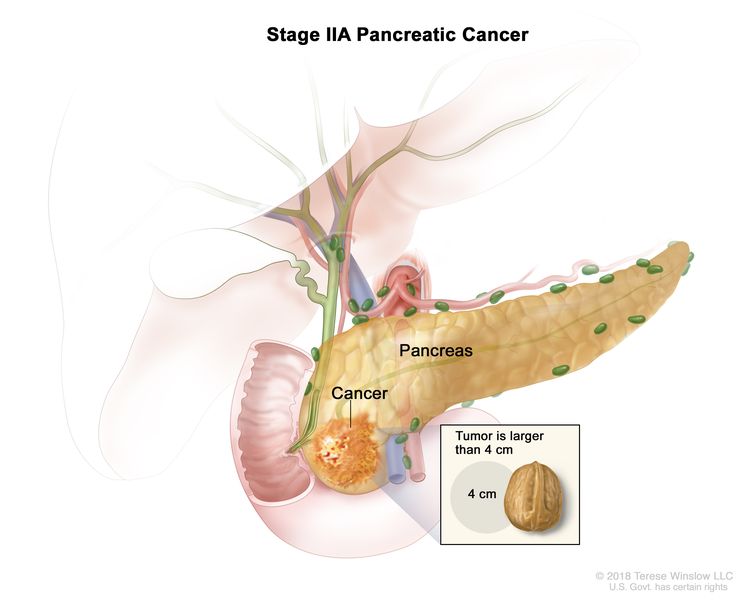 |
| N0 = 无区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| IIB | T1、N1、M0 | T1 = 肿瘤最大尺寸 ≤2 cm。 | 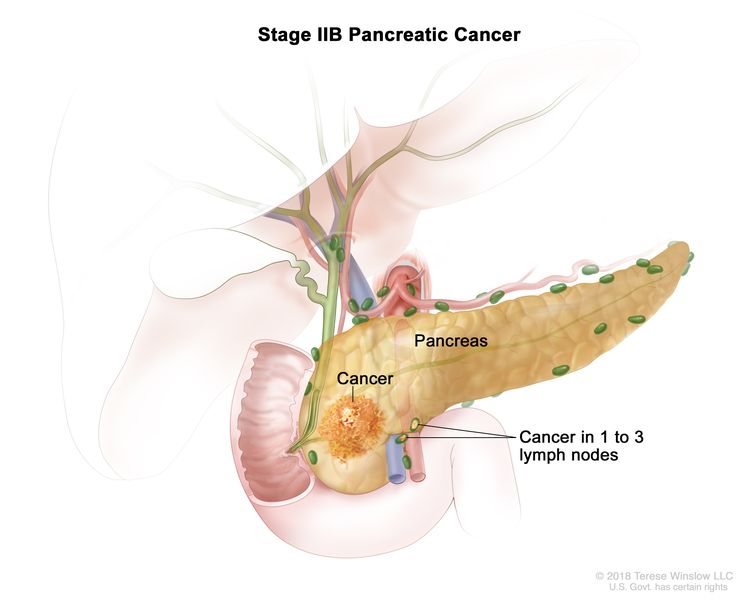 |
| –T1a = 肿瘤最大尺寸 ≤0.5 cm。 | |||
| –T1b = 肿瘤最大尺寸 >0.5 cm 和 <1 cm。 | |||
| –T1c = 肿瘤最大尺寸 1-2 cm。 | |||
| N1 = 1 至 3 个区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| T2、N1、M0 | T2 = 肿瘤 >2 cm 和最大尺寸 ≤4 cm。 | ||
| N1 = 1 至 3 个区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| T3、N1、M0 | T3 = 肿瘤最大尺寸 >4 cm。 | ||
| N1 = 1 至 3 个区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| 阶段 | TNM | 描述 | 插图 |
|---|---|---|---|
| T = 原发性肿瘤;N = 区域淋巴结;M = 远处转移。 | |||
| 一个经 AJCC 许可转载:胰腺外分泌。在:Amin MB、Edge SB、Greene FL 等人,编辑:AJCC 癌症分期手册。第 8 版。纽约州纽约市:施普林格出版社,2017 年,第 337-47 页。 | |||
| 第三 | T1、N2、M0 | T1 = 肿瘤最大尺寸 ≤2 cm。 | 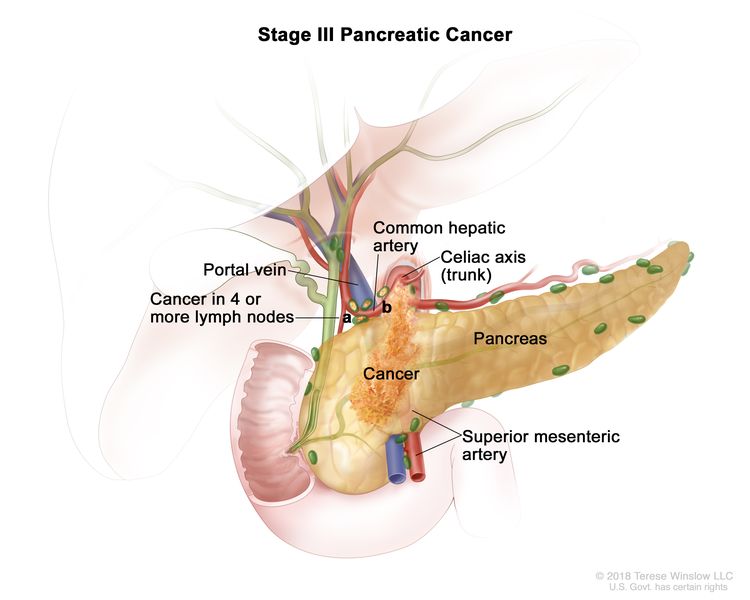 |
| –T1a = 肿瘤最大尺寸 ≤0.5 cm。 | |||
| –T1b = 肿瘤最大尺寸 >0.5 cm 和 <1 cm。 | |||
| –T1c = 肿瘤最大尺寸 1-2 cm。 | |||
| N2 = 4 个或更多区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| T2、N2、M0 | T2 = 肿瘤 >2 cm 和最大尺寸 ≤4 cm。 | ||
| N2 = 4 个或更多区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| T3、N2、M0 | T3 = 肿瘤最大尺寸 >4 cm。 | ||
| N2 = 4 个或更多区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| T4、任意 N、M0 | T4 = 肿瘤累及腹腔轴、肠系膜上动脉和/或肝总动脉,无论大小如何。 | ||
| NX = 无法评估区域淋巴结。 | |||
| N0 = 无区域淋巴结转移。 | |||
| N1 = 1 至 3 个区域淋巴结转移。 | |||
| N2 = 4 个或更多区域淋巴结转移。 | |||
| M0 = 无远处转移。 | |||
| 阶段 | TNM | 描述 | 插图 |
|---|---|---|---|
| T = 原发性肿瘤;N = 区域淋巴结;M = 远处转移。 | |||
| 一个经 AJCC 许可转载:胰腺外分泌。在:Amin MB、Edge SB、Greene FL 等人,编辑:AJCC 癌症分期手册。第 8 版。纽约州纽约市:施普林格出版社,2017 年,第 337-47 页。 | |||
| 四 | 任意 T、任意 N、M1 | TX = 无法评估原发性肿瘤。 | 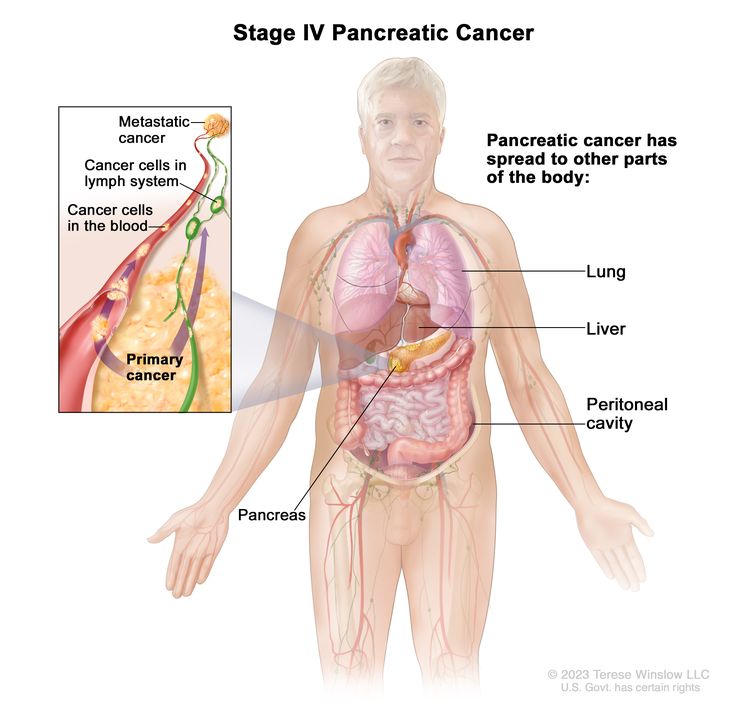 |
| T0 = 无原发性肿瘤的证据。 | |||
| Tis = 原位癌。这包括高级别胰腺上皮内瘤变 (PanIn-3)、伴有高度异型增生的导管内状粘液性肿瘤、伴有高度异型增生的导管内肾小管状肿瘤和伴有高度异型增生的粘液性囊性肿瘤。 | |||
| T1 = 肿瘤最大尺寸 ≤2 cm。 | |||
| –T1a = 肿瘤最大尺寸 ≤0.5 cm。 | |||
| –T1b = 肿瘤最大尺寸 >0.5 cm 和 <1 cm。 | |||
| –T1c = 肿瘤最大尺寸 1-2 cm。 | |||
| T2 = 肿瘤 >2 cm 和最大尺寸 ≤4 cm。 | |||
| T3 = 肿瘤最大尺寸 >4 cm。 | |||
| T4 = 肿瘤累及腹腔轴、肠系膜上动脉和/或肝总动脉,无论大小如何。 | |||
| NX = 无法评估区域淋巴结。 | |||
| N0 = 无区域淋巴结转移。 | |||
| N1 = 1 至 3 个区域淋巴结转移。 | |||
| N2 = 4 个或更多区域淋巴结转移。 | |||
| M1 = 远处转移。 | |||
引用
- Kakar S、Pawlik TM、Allen PJ:胰腺外分泌。在:Amin MB、Edge SB、Greene FL 等人,编辑:AJCC 癌症分期手册。第 8 版。斯普林格;2017 年,第 337-47 页。
胰腺癌的治疗选择概述
在可行的情况下,手术切除仍然是胰腺癌患者的主要治疗方式。有时,切除可以导致长期生存,并提供有效的姑息治疗。[1-3][证据级别 C1]治疗是 通常以可切除性为指导,但这可能因手术判断和经验而异。应考虑转诊至高容量中心。[4]
术后化疗可提高总生存期,但放化疗的作用仍存在争议。
胰腺癌的并发症包括:
- 吸收不良:通常由外分泌功能不全引起的吸收不良会导致营养不良。胰酶替代疗法可以帮助缓解这个问题。
- 疼痛: 腹腔轴和胸膜内神经阻滞可以为一些患者提供高效和持久的疼痛控制。有关更多信息,请参阅癌症疼痛。
任何阶段的胰腺外分泌癌患者的生存率都很差。临床试验适用于任何疾病阶段的患者,在选择姑息治疗方法之前应考虑临床试验。
有关正在进行的胰腺癌临床试验的信息,请访问 NCI 网站。
| 临床分期 | 治疗方案 |
|---|---|
| 可切除或临界可切除的胰腺癌 | 新辅助治疗 |
| 手术 | |
| 术后化疗 | |
| 术后放化疗 | |
| 术前化疗和/或放疗(临床评估中) | |
| 替代放射技术(临床评估中) | |
| 局部晚期胰腺癌 | 化疗联合或不联合靶向治疗 |
| 放化疗 | |
| 手术 | |
| 姑息性手术 | |
| 评估新型药物联合化疗或放化疗治疗不可切除肿瘤患者的临床试验 | |
| 术中放射治疗和/或放射源植入(临床评估中) | |
| 转移性或复发性胰腺癌 | 化疗联合或不联合靶向治疗 |
| 评估新型抗癌药物单独使用或与化疗联合使用的临床试验 |
对于任何疾病阶段的患者,都可以考虑姑息治疗。有关更多信息,请参阅姑息疗法部分。
卡培他滨和氟尿嘧啶剂量
DPYD 基因编码一种分解代谢嘧啶和氟嘧啶的酶,如卡培他滨和氟尿嘧啶。估计 1% 至 2% 的人群在 DPYD 中存在种系致病性变异,这导致 DPD 蛋白功能降低以及嘧啶和氟嘧啶在体内积累。[5,6]接受氟嘧啶类药物治疗的 DPYD*2A 变异型患者可能会出现严重的、危及生命的毒性,有时是致命的。已经确定了许多其他 DPYD 变体,具有一系列临床效果。[5-7]根据患者的 DPYD 基因型和功能正常的 DPYD 等位基因的数量,可能建议避免使用氟嘧啶类药物或减少 50% 的剂量。[8-10]DPYD 基因检测费用不到 200 美元,但由于缺乏国家指南,保险范围各不相同。[11] 此外,检测可能会延迟治疗 2 周,这在紧急情况下是不可取的。这个有争议的问题需要进一步评估。[12]
引用
- Yeo CJ、Cameron JL、Lillemoe KD 等:胰十二指肠切除术治疗胰头癌。201 名患者。安外科杂志 221 (6):721-31;讨论 731-3,1995 年。[PUBMED 摘要]
- Conlon KC、Klimstra DS、Brennan MF:胰腺导管腺癌根治性切除术后的长期生存率。5 年幸存者的临床病理分析。安外科杂志 223 (3):273-9,1996 年。[PUBMED 摘要]
- Yeo CJ、Abrams RA、Grochow LB 等:胰十二指肠切除术治疗胰腺癌:术后辅助放化疗可提高生存率。前瞻性的单一机构体验。安外科杂志 225 (5):621-33;讨论 633-6,1997 年。[PUBMED 摘要]
- Lidsky ME、Sun Z、Nussbaum DP 等人:加倍努力:提高前往高容量中心的胰腺癌患者的生存率。安外科杂志 266 (2):333-338,2017。[PUBMED 摘要]
- Sharma BB、Rai K、Blunt H 等:接受氟嘧啶化疗患者的致病性 DPYD 变异和治疗相关死亡率:系统评价和荟萃分析。肿瘤学家 26 (12):1008-1016,2021 年。[PUBMED 摘要]
- Lam SW、Guchelaar HJ、Boven E:药物遗传学在卡培他滨疗效和毒性中的作用。癌症治疗修订版 50:9-22,2016。[PUBMED 摘要]
- Shakeel F、Fang F、Kwon JW 等:携带 DPYD 变异等位基因的患者在氟嘧啶化疗期间发生严重毒性和相关治疗改变的风险增加。药物基因组学 22 (3): 145-155, 2021。[PUBMED 摘要]
- Amstutz U、Henricks LM、Offer SM 等:二氢嘧啶脱氢酶基因型和氟嘧啶剂量的临床药物遗传学实施联盟 (CPIC) 指南:2017 年更新。临床药理学技术103(2):210-216,2018。[PUBMED 摘要]
- Henricks LM、Lunenburg CATC、de Man FM 等:癌症患者氟嘧啶治疗的 DPYD 基因型指导剂量个体化:前瞻性安全性分析。柳叶刀肿瘤学 19(11):1459-1467,2018。[PUBMED 摘要]
- Lau-Min KS、Varughese LA、Nelson MN 等:预防性药物遗传学检测以指导胃肠道恶性肿瘤患者的化疗剂量:实施障碍的定性研究。BMC 癌症 22 (1):47,2022。[PUBMED 摘要]
- Brooks GA、Tapp S、Daly AT 等:结肠癌基于氟嘧啶的辅助化疗前 DPYD 基因分型的成本效益。临床结直肠癌 21 (3):e189-e195,2022。[PUBMED 摘要]
- Baker SD、Bates SE、Brooks GA 等人:DPYD 测试:是时候将患者安全放在首位了。临床肿瘤学杂志41(15):2701-2705,2023。[PUBMED 摘要]
可切除或临界可切除胰腺癌的治疗
可切除或临界可切除胰腺癌的治疗方案
可切除或临界可切除胰腺癌的治疗方案包括:
对于任何疾病阶段的患者,都可以考虑姑息治疗。有关更多信息,请参阅姑息疗法部分。
新辅助治疗
新辅助治疗是指在手术前给予化疗联合或不联合放化疗。新辅助治疗的作用已在回顾性研究 (监测、流行病学和最终结果 [SEER] 计划数据库和美国国家癌症数据库) 中进行评估,并被多个共识指南推荐用于临界可切除胰腺癌患者的管理。在几项正在进行的试验中,它正在可切除或临界可切除的胰腺癌患者中进行评估。[9-11]
证据(新辅助化疗联合或不联合放化疗):
- II 期、多中心、随机A021501试验 (NCT02839343) 在 2017 年至 2019 年期间招募了来自国家临床试验网络合作组机构的 126 名临界可切除胰腺癌患者。患者被分配接受 8 个 2 周周期的改良 FOLFIRINOX(奥沙利铂、亚叶酸、伊立替康和 5-FU)(n = 65)或 7 个 2 周周期的改良 FOLFIRINOX,然后接受立体定向放疗(33 Gy-40 Gy,分 5 次)或大分割图像引导放疗(25 Gy,分 5 次)(n = 55)。无疾病进展的患者随后接受手术,然后接受 4 个 2 周周期的辅助FOLFOX6 (奥沙利铂、亚叶酸和 5-FU)。[12]
- 多中心 III 期 PREOPANC 研究包括 2013 年至 2017 年间诊断为可切除或临界可切除胰腺癌的 246 例患者。16 个荷兰中心的患者被随机分配接受诊断性腹腔镜检查、新辅助放化疗、手术切除和 4 个周期的辅助吉西他滨或前期手术和 6 个周期的辅助吉西他滨。新辅助放化疗包括以下内容:第 1 周期(21 天),吉西他滨 1,000 mg/m2第 1 天和第 8 天;第 2 周期(28 天)在第 1、8 和 15 天使用吉西他滨,同时对肿瘤和疑似相关淋巴结进行 15 次大分割放疗 (36 Gy);和第 3 周期(21 天),第 1 天和第 8 天使用吉西他滨。[13]]
最佳新辅助治疗方案尚不清楚,其他化疗方案正在以下试验中进行评估:ALLIANCE (NCT04340141)、PREOPANC-3 (NCT04927780)、PANACHE-01-PRODIGE (NCT02959879) 和 NorPACT-01 (NCT02919787)。
手术
完全切除可产生 18% 至 24% 的 5 年生存率,但由于局部和远处肿瘤复发的发生率很高,最终控制仍然很差。因此,也推荐全身治疗。[14-16][证据等级 C1]
大约 20% 的胰腺癌患者适合局部手术切除,手术死亡率约为 1%-16%。[17-21]利用医疗保险索赔数据库的信息,一项对 7,000 年至 1992 年间接受胰十二指肠切除术的患者进行的全国队列研究显示,低容量医院(每年 <1 例胰十二指肠切除术)与高容量医院(每年 >5 例)的院内死亡率更高(分别为 16% 和 4%;P < .01)。[17]]
术后化疗
从历史上看,多项随机试验已确定,与单纯手术相比,吉西他滨单药辅助治疗 [22] 或 5-FU 单药辅助治疗 [3] 可改善手术切除后 6 个月的 OS。最近的研究着眼于可能进一步改善手术切除后结局的新型联合方案。
对于体能状态良好的患者,应考虑辅助 FOLFIRINOX 化疗或吉西他滨和卡培他滨的联合治疗。然而,对于老年患者或体能状态边缘的患者,可以考虑辅助吉西他滨或 5-FU 单药治疗。在亚洲,S-1(替加氟、吉美拉西和奥特拉西钾)是基于吉西他滨的治疗的合适替代药物。
证据(术后化疗):
- FOLFIRINOX: 在随机、开放标签、III 期 PRODIGE-24 试验 (NCT01526135) 中,493 例 R0/R1 切除患者以 1:1 的比例随机分配接受六个周期的吉西他滨(1,000 mg/m)2在 28 天周期的第 1、8 和 15 天)或 12 个周期的 FOLFIRINOX(奥沙利铂 85 mg/m)2、亚叶酸 400 毫克/米2、伊立替康 150 毫克/米2和 5-FU 2,400 mg/m2每 2 周超过 46 小时)。[23,24][证据等级 A1]
- 中位随访 69.7 个月,FOLFIRINOX 组的中位无病生存期 (DFS) 为 21.4 个月 (95% CI,17.5-26.7),吉西他滨组为 12.8 个月 (95% CI,11.6-15.2) (HR,0.66;95% CI,0.54-0.82;P < .001)。
- FOLFIRINOX 组的中位 OS 为 53.5 个月 (95% CI,43.5-58.4),吉西他滨组为 35.5 个月 (95% CI,30.1-40.3) (HR,0.68;95% CI,0.54-0.85;P = .001)。FOLFIRINOX 组的 5 年 OS 率为 43.2%,吉西他滨组为 31.4%。
- 联合治疗的毒性更高;接受 FOLFIRINOX 治疗的患者中有 75.9% 出现 3 级或 4 级毒性,而接受吉西他滨治疗的患者为 52.9%,中性粒细胞减少率相似(尽管接受 FOLFIRINOX 治疗的患者中有 62.2% 接受粒细胞集落刺激因子)。接受 FOLFIRINOX 治疗的患者中有 33% 提前停止治疗,而单独接受吉西他滨治疗的患者为 21%。
- 吉西他滨和卡培他滨: 欧洲胰腺癌研究 (ESPAC-4 [NCT00058201]) 试验随机分配 732 例胰腺癌切除术患者接受 6 个周期的吉西他滨单独治疗(1,000 mg/m2每周给药 3 周,每 4 周给药一次)或口服卡培他滨(1,660 mg/m2给药 21 天,然后休息 7 天 [一个周期])。[25][证据等级 A1]
- 中位随访 43.2 个月,吉西他滨/卡培他滨组患者的中位 OS 为 28.0 个月 (95% CI,23.5-31.5),而吉西他滨单药组为 25.5 个月 (95% CI,22.7-27.9;心率,0.82;P = .032)。吉西他滨/卡培他滨治疗使估计的 5 年 OS 率从单独使用吉西他滨的 16.3% 改善到吉西他滨/卡培他滨的 28.8%。
- 治疗组之间 3/4 级毒性的总体发生率无显著差异。与单独使用吉西他滨相比,卡培他滨与 3/4 级腹泻 (5% vs. 2%) 、中性粒细胞减少症 (38% vs. 24%) 和手足综合征 (7% vs. 0%) 的发生率较高相关。
- 对治疗组的生活质量没有显著影响。
- 基于这些发现,吉西他滨和卡培他滨的辅助联合治疗是胰腺癌切除术后的标准治疗。
- S-1:日本胰腺癌辅助研究组 (JASPAC-01) 研究是一项在日本进行的 III 期、多中心、非劣效性试验,随机分配 385 名患者接受吉西他滨(1,000 mg/m2每周一次,持续 3 周,每 4 周一次),持续 6 个周期或 S-1(替加氟、吉美拉嘧啶和奥特拉西钾)(每天口服两次,持续 4 周,然后休息 2 周)。[26][证据等级 A1]
- 在完成所有方案治疗的疗效中期分析中,满足预先设定的早期停药标准。在早期中期分析中,HR死亡率为 0.57 (95% CI,0.44-0.72;非劣效性 P < .001;P 表示优胜性 < .001)。这些结果与吉西他滨组 24.4% 和 S-1 组 44.1% 的 5 年 OS 率相关。
- 吉西他滨组更频繁地观察到 3 级或 4 级白细胞减少症、中性粒细胞减少症和肝转氨酶炎,S-1 组更频繁地出现口腔炎和腹泻。
- 在日本患者中,S-1 辅助化疗可以成为切除胰腺患者的新护理标准。需要更多的研究来验证其他种族和民族患者的这些结果。
- S-1 的药代动力学和药效学在东西方患者群体之间可能不同,因为 3/4 级胃肠道毒性,尤其是腹泻,在西方患者人群中更常见。S-1 目前尚未获得美国食品药品监督管理局 (FDA) 的美国批准。
- 吉西他滨: Charité Onkologie (CONKO)-001 是一项多中心 III 期试验,纳入 368 名已切除的胰腺癌患者,这些患者被随机分配接受六个周期的吉西他滨辅助治疗与观察。[22][证据级别 B1]与之前的试验相比,主要终点是 DFS。
- 吉西他滨或 5-FU: ESPAC-3 试验 (NCT00058201) 将 1,088 例接受完全肉眼切除术的患者随机分配到 6 个月的 5-FU (425 mg/m2)和亚叶酸 (20 mg/m2)每 28 天或 6 个月服用吉西他滨(1,000 mg/m)第 1 至 5 天2) 每 28 天第 1 天、第 8 天和第 15 天。[3][证据等级 A1]
- 5-FU 加亚叶酸治疗患者的中位 OS 为 23.0 个月 (95% CI,21.1-25.0),23.6 个月 (95% CI, 21.4-26.4) 对于接受吉西他滨治疗的患者 (HR, 0.94;95% CI, 0.81–1.08;P = .39)。
术后放化疗
术后治疗(化疗联合或不联合放化疗)在这种疾病管理中的作用仍然存在争议,因为许多可用的随机临床试验数据在统计学上把握度不足,并且提供了相互矛盾的结果。[4-8]
证据(术后放化疗):
几项 III 期试验检查了基于辅助 5-FU 的放化疗的术后潜在 OS 获益:
- 胃肠道研究组 (GITSG):GITSG 于 1985 年进行的一项小型随机试验比较了单独手术与放化疗手术。[4][证据级别 A1];[5][证据等级 B4]
- 研究人员报告说,与单独切除相比,术后推注 5-FU 和剂量为 40 Gy 的区域分程放疗,中位和长期生存率有显著但适度的改善。
- 欧洲癌症研究与治疗组织 (European Organisation for the Research and Treatment of Cancer, EORTC):EORTC 试图重现 GITSG 试验的结果,但未能证实辅助放化疗比单独切除有显著益处;[6][证据等级 A1] 然而,该试验治疗了胰腺癌和壶腹周围癌患者 (预后可能更好)。
- 对原发性胰腺肿瘤患者的亚组分析表明,与单独手术 (分别为 12.6 个月、 23% 和 10%) 相比,辅助治疗组的中位、 2 年和 5 年 OS 有改善的趋势 (分别为 17.1 个月、 37% 和 20%);中位生存期 P = .09)。
- 对随后的 ESPAC-1 试验的更新分析仅检查了胰腺切除术后接受严格随机化的患者。患者被分配到四组中的一组 (观察、推注 5-FU 化疗、推注 5-FU 放化疗或放化疗后额外化疗)。[7,8,28][证据等级 A1]
- 在中位随访 47 个月时报告了 2 × 2 析因设计,仅观察到接受术后 5-FU 化疗的患者的中位生存获益。然而,这些结果难以解释,因为方案不依从率高,并且缺乏对 2 × 2 设计中四组中每组的单独分析。
- 美国胃肠道间组:美国胃肠道间组报告了一项随机 III 期试验(放射治疗肿瘤组 [RTOG]-9704)的结果,该试验包括 451 名切除的胰腺癌患者,他们被分配接受术后输注 5-FU 加输注 5-FU 和同步放疗或辅助吉西他滨加输注 5-FU 和同步放疗。[29][证据级别 A1]主要终点是所有患者的 OS 和胰头肿瘤患者的 OS。
- RTOG-9704 的 5 年更新报告称,胰头瘤患者 (n = 388) 使用吉西他滨的中位生存期为 20.5 个月,5 年 OS 率为 22%,而 5-FU 的中位生存期为 17.1 个月,5 年 OS 率为 18%(HR,0.84;95% CI,0.67-1.05;P = .12)。[30]
- 单变量分析显示 OS 无差异。然而,在多变量分析中,吉西他滨组的胰头肿瘤患者 OS 有改善的趋势 (P = .08)。远处复发仍然是首次失败的主要部位 (78%)。
EORTC/美国胃肠道组间 RTOG-0848 III 期辅助试验评估了吉西他滨联合或不联合厄洛替尼完整疗程后放化疗的影响,该试验已结束,结果待定。
仍需进行更多试验,以确定对这种疾病更有效的全身治疗。
目前的临床试验
使用我们的高级临床试验搜索来查找 NCI 支持的癌症临床试验,这些临床试验目前正在招募患者。可以根据试验地点、治疗类型、药物名称和其他标准缩小搜索范围。还提供有关临床试验的一般信息。
引用
- Dalton RR、Sarr MG、van Heerden JA 等:胰体癌和胰尾癌:根治性切除合理吗?外科111(5):489-94,1992。[PUBMED 摘要]
- Brennan MF、Moccia RD、Klimstra D:胰体和胰尾腺癌的管理。安外科杂志 223 (5):506-11;讨论 511-2,1996 年。[PUBMED 摘要]
- Neoptolemos JP、Stocken DD、Bassi C 等:胰腺癌切除术后氟尿嘧啶加亚叶酸与吉西他滨的辅助化疗:一项随机对照试验。美国医学会杂志 304 (10):1073-81,2010。[PUBMED 摘要]
- 胰腺癌根治性切除术后有效辅助放化疗的进一步证据。胃肠道肿瘤研究组。癌症 59 (12):2006-10,1987。[PUBMED 摘要]
- Kalser MH,Ellenberg SS:胰腺癌。根治性切除术后的辅助放疗和化疗。拱形外科杂志120(8):899-903,1985。[PUBMED 摘要]
- Klinkenbijl JH、Jeekel J、Sahmoud T 等:胰腺癌和壶腹周围区根治性切除术后的辅助放疗和 5-氟尿嘧啶:EORTC 胃肠道癌症合作组的 III 期试验。安外科杂志 230 (6):776-82;讨论 782-4,1999 年。[PUBMED 摘要]
- Neoptolemos JP、Dunn JA、Stocken DD 等:可切除胰腺癌的辅助放化疗和化疗:一项随机对照试验。柳叶刀 358 (9293):1576-85,2001 年。[PUBMED 摘要]
- Neoptolemos JP、Stocken DD、Friess H 等:胰腺癌切除术后放化疗和化疗的随机试验。N Engl J Med 350 (12):1200-10,2004 年。[PUBMED 摘要]
- Stessin AM、Meyer JE、Sherr DL:新辅助放疗与可切除胰腺癌患者生存率的提高相关:来自监测、流行病学和最终结果 (SEER) 登记处的数据分析。国际放射肿瘤生物学杂志72(4):1128-33,2008。[PUBMED 摘要]
- Versteijne E、Vogel JA、Besselink MG 等:在可切除或临界可切除胰腺癌患者中比较前期手术与新辅助治疗的荟萃分析。Br J 外科杂志 105 (8):946-958,2018 年。[PUBMED 摘要]
- Mokdad AA、Minter RM、Zhu H 等:可切除胰腺癌的新辅助治疗后切除术与前期切除术:倾向评分匹配分析。临床肿瘤学杂志 35(5):515-522,2017。[PUBMED 摘要]
- Katz MHG、Shi Q、Meyers J 等:术前 mFOLFIRINOX 与 mFOLFIRINOX 加大分割放疗对临界可切除胰腺腺癌的疗效:A021501 2 期随机临床试验。美国医学会肿瘤学杂志 8 (9):1263-1270,2022 年。[PUBMED 摘要]
- Versteijne E、van Dam JL、Suker M 等:可切除和临界可切除胰腺癌的新辅助放化疗与前期手术:荷兰随机 PREOPANC 试验的长期结果。临床肿瘤学杂志 40 (11):1220-1230,2022。[PUBMED 摘要]
- Cameron JL、Crist DW、Sitzmann JV 等:胰腺癌胰十二指肠切除术后生存率的影响因素。美国外科杂志 161(1):120-4;讨论 124-5,1991 年。[PUBMED 摘要]
- Yeo CJ、Cameron JL、Lillemoe KD 等:胰十二指肠切除术治疗胰头癌。201 名患者。安外科杂志 221 (6):721-31;讨论 731-3,1995 年。[PUBMED 摘要]
- Yeo CJ、Abrams RA、Grochow LB 等:胰十二指肠切除术治疗胰腺癌:术后辅助放化疗可提高生存率。前瞻性的单一机构体验。安外科杂志 225 (5):621-33;讨论 633-6,1997 年。[PUBMED 摘要]
- Birkmeyer JD、Finlayson SR、Tosteson AN 等:医院容量对胰十二指肠切除术住院死亡率的影响。外科125(3):250-6,1999。[PUBMED 摘要]
- Cameron JL、Pitt HA、Yeo CJ 等:连续 145 例胰十二指肠切除术无死亡率。安外科杂志 217 (5):430-5;讨论 435-8,1993 年。[PUBMED 摘要]
- Spanknebel K,Conlon KC:胰腺癌手术治疗的进展。癌症杂志 7 (4):312-23,2001 年 7 月至 8 月。[PUBMED 摘要]
- Balcom JH、Rattner DW、Warshaw AL 等:733 例胰腺切除术的十年经验:适应症变化、患者老年和住院时间缩短。拱形外科杂志136(4):391-8,2001。[PUBMED 摘要]
- Sohn TA、Yeo CJ、Cameron JL 等:胰腺 616 患者切除的腺癌:结果、结果和预后指标。J Gastrointest Surg 4 (6):567-79,2000 年 11 月至 12 月。[PUBMED 摘要]
- Oettle H、Post S、Neuhaus P 等:吉西他滨辅助化疗与胰腺癌根治性切除术患者的观察:一项随机对照试验。美国医学会 297 (3):267-77,2007。[PUBMED 摘要]
- Conroy T、Hammel P、Hebbar M 等人:FOLFIRINOX 或吉西他滨作为胰腺癌的辅助治疗。N Engl J Med 379 (25):2395-2406,2018 年。[PUBMED 摘要]
- Conroy T、Castan F、Lopez A 等人:FOLFIRINOX 与吉西他滨作为胰腺癌辅助治疗的五年结果:一项随机临床试验。美国医学会肿瘤学杂志 8 (11):1571-1578,2022 年。[PUBMED 摘要]
- Neoptolemos JP、Palmer DH、Ghaneh P 等:吉西他滨和卡培他滨辅助治疗吉西他滨单药治疗胰腺癌切除术 (ESPAC-4) 的比较:一项多中心、开放标签、随机、3 期试验。柳叶刀 389 (10073):1011-1024,2017 年。[PUBMED 摘要]
- Uesaka K、Boku N、Fukutomi A 等:S-1 与吉西他滨辅助化疗治疗已切除的胰腺癌:一项 3 期、开放标签、随机、非劣效性试验 (JASPAC 01)。柳叶刀 388 (10041):248-57,2016 年。[PUBMED 摘要]
- Oettle H、Neuhaus P、Hochhaus A 等:吉西他滨辅助化疗和胰腺癌切除患者的长期结果:CONKO-001 随机试验。美国医学会 310 (14):1473-81,2013 年。[PUBMED 摘要]
- Choti MA:胰腺癌的辅助治疗——争论仍在继续。N Engl J Med 350 (12):1249-51,2004 年。[PUBMED 摘要]
- Regine WF、Winter KA、Abrams RA 等:胰腺癌切除术后基于氟尿嘧啶的放化疗前后氟尿嘧啶与吉西他滨化疗:一项随机对照试验。美国医学会 299 (9):1019-26,2008 年。[PUBMED 摘要]
- Regine WF、Winter KA、Abrams R 等:胰腺癌切除术后基于氟尿嘧啶的放化疗联合吉西他滨或氟尿嘧啶化疗:美国组间/RTOG 9704 III 期试验的 5 年分析。安外科肿瘤学18(5):1319-26,2011。[PUBMED 摘要]
局部晚期胰腺癌的治疗
局部晚期胰腺癌的治疗选择
虽然局部晚期胰腺癌和转移性胰腺癌都是无法治愈的,但它们的自然病程可能不同。一项尸检系列表明,30% 的局部晚期疾病患者在没有远处转移证据的情况下死亡。[1][证据级别 A1]因此,研究人员一直在努力确定是否有必要对局部晚期疾病患者进行放化疗。
局部晚期胰腺癌的治疗方案包括:
对于任何疾病阶段的患者,都可以考虑姑息治疗。有关更多信息,请参阅姑息疗法部分。
化疗联合或不联合靶向治疗
化疗是局部晚期胰腺癌患者的主要治疗方式,使用与治疗转移性疾病患者相同的方案。
证据(化疗):
- FOLFIRINOX 与吉西他滨:一项多中心 II/III 期试验包括 342 例转移性胰腺癌患者,东部肿瘤合作组 (ECOG) 体能状态评分为 0 或 1。[6][证据级别 A1]患者被随机分配接受 FOLFIRINOX (奥沙利铂 [85 mg/m2],伊立替康 [180 mg/m]2],亚叶酸 [400 mg/m]2] 和氟尿嘧啶 [5-FU;400 mg/m2] 推注,然后 2,400 mg/m2每 2 周连续输注 46 小时)或吉西他滨(1,000 mg/m)2每周一次,持续 8 周中的 7 周,然后每周一次,持续 4 周中的 3 周)。
- FOLFIRINOX 组的中位总生存期 (OS) 为 11.1 个月,而吉西他滨组为 6.8 个月(风险比 [HR]死亡, 0.57;95% 置信区间 [CI],0.45-0.73;P < .001)。
- FOLFIRINOX 组的中位无进展生存期 (PFS) 为 6.4 个月,吉西他滨组为 3.3 个月(HR疾病进展, 0.47;95% CI,0.37–0.59;P < .001)。
- FOLFIRINOX 比吉西他滨毒性更大;该组中 5.4% 的患者患有发热性中性粒细胞减少症。在 6 个月时,FOLFIRINOX 组 31% 的患者生活质量明显下降,而吉西他滨组为 66%(HR,0.47;95% CI,0.30-0.70;P < .001)。
- 基于这项试验,FOLFIRINOX 被认为是晚期胰腺癌患者的标准治疗选择。
- 吉西他滨和白蛋白结合型紫杉醇与吉西他滨:一项多中心、国际、III 期试验 (NCT00844649) 包括 861 名转移性胰腺癌患者。患者的 Karnofsky 体能状态至少为 70,并且之前未接受过转移性疾病化疗。[7][证据级别 A1]接受吉西他滨辅助或任何其他化疗的患者被排除在外。患者被随机分配接受吉西他滨(1,000 mg/m2)和白蛋白结合型紫杉醇(125 mg/m2体表面积)每周一次,持续 3 次,持续 4 周或吉西他滨单药治疗(1,000 mg/m)2每周一次,持续 8 周中的 7 周,然后每周一次,持续 4 周中的 3 周)。
- 白蛋白结合型紫杉醇/吉西他滨组的中位 OS 为 8.5 个月,而吉西他滨组为 6.7 个月(HR死亡, 0.72;95% CI,0.62–0.83;P < .001)。
- 白蛋白结合型紫杉醇/吉西他滨组的中位 PFS 为 5.5 个月,吉西他滨组为 3.7 个月(HR疾病进展, 0.69;95% CI,0.58–0.82;P < .001)。
- 白蛋白结合型紫杉醇/吉西他滨的毒性比吉西他滨大。白蛋白结合型紫杉醇/吉西他滨组最常见的 3 级毒性是中性粒细胞减少症 (38%) 、疲劳 (17%) 和神经病变 (17%);发热性中性粒细胞减少症发生在 3% 的患者中。在吉西他滨单药组中,最常见的 3 级毒性是中性粒细胞减少症 (27%) 、疲劳 (1%) 和神经病变 (1%);中性粒细胞减少性发热发生在 1% 的患者中。
- 在白蛋白结合型紫杉醇/吉西他滨组中,从 3 级神经病变到 1 级或消退的中位时间为 29 天。在 3 级周围神经病变患者中,44% 的患者能够在 3 级事件发作后的中位 23 天内以减少的剂量恢复治疗。
- 基于该试验,白蛋白结合型紫杉醇/吉西他滨是晚期胰腺癌患者的标准治疗选择。
- 没有测量该方案的生活质量数据,本研究没有讨论白蛋白结合型紫杉醇/吉西他滨与 FOLFIRINOX 的疗效。
- 吉西他滨与 5-FU:吉西他滨已在胰腺 癌症,是一种有用的姑息剂。[8-10]吉西他滨的 III 期试验 与 5-FU 作为晚期或转移性患者的一线治疗相比 胰腺腺癌报告生存率显着改善 在接受吉西他滨治疗的患者中(1 年生存率为 18% 吉西他滨与 2% 的 5-FU 相比;P = .003)。[9][证据等级 A1]
- 单独使用吉西他滨与吉西他滨和厄洛替尼:加拿大国家癌症研究所进行了一项 III 期试验 (CAN-NCIC-PA3 [NCT00026338]),比较了单独使用吉西他滨与吉西他滨和厄洛替尼联合治疗 (100 mg/d) 治疗晚期或转移性胰腺癌患者。[11][证据等级 A1]
- 与单独使用吉西他滨相比,加入厄洛替尼与吉西他滨联合使用时略微延长了生存期(HR,0.81;95% CI,0.69-0.99;P = .038)。
- 接受厄洛替尼治疗的患者的中位生存期和 1 年生存率分别为 6.2 个月和 23%。接受安慰剂的患者的中位生存期和 1 年生存率分别为 5.9 个月和 17%。
- 铂类似物或氟嘧啶与吉西他滨单药治疗:许多 III 期研究评估了铂类似物(顺铂或奥沙利铂)或氟嘧啶与吉西他滨单药联合治疗方案。[12,13]
- 这些 III 期试验均未显示支持联合化疗用于转移性胰腺癌一线治疗的统计学显著优势。
- 5-FU、亚叶酸和奥沙利铂(OFF 方案)与最佳支持治疗 (BSC) 相比:以吉西他滨为基础的方案进展后二线化疗可能是有益的。Charité Onkologie (CONKO)-003 研究人员将需要二线化疗的患者随机分配到 OFF 方案或 BSC 组。[14,15][证据级别 C1]OFF 方案包括亚叶酸 (200 mg/m2),然后是 5-FU (2,000 mg/m)2[24 小时连续输注] 第 1、8、15 和 22 天)和奥沙利铂 (85 mg/m2在第 8 天和第 22 天)。休息 3 周后,下一个周期从第 43 天开始。由于应计率低,该试验提前终止,只有 46 例患者被随机分配到 OFF 方案或 BSC。
- OFF 治疗方案的中位生存期为 4.82 个月 (95% CI,4.29-5.35),单独使用 BSC 的中位生存期为 2.30 个月 (95% CI,1.76-2.83) (HR,0.45;95% CI,0.24-0.83)。
- 吉西他滨/OFF 序列的中位 OS 为 9.09 个月,吉西他滨/BSC 的中位 OS 为 7.90 个月。
- 研究的提前结束和患者数量非常少使 P 值具有误导性。因此,OFF 方案的二线化疗可能与生存率的提高错误相关。
放化疗
放化疗在局部晚期胰腺癌中的作用仍然存在争议。表 7 总结了局部晚期胰腺癌放化疗的 III 期随机研究。
| 试验 | 方案 | 放化疗 | 单独辐射 | 单独化疗 | P 值 |
|---|---|---|---|---|---|
| 5-FU = 氟尿嘧啶;ECOG = 东部肿瘤合作组;FFCD = Fédération Francophone de Cancérologie Digestive;GEM = 吉西他滨;GITSG = 胃肠道肿瘤研究组;Gy = 灰度(电离辐射的吸收辐射单位);P 值 = 概率值;XRT = 放射疗法。 | |||||
| 2000 年之前 | |||||
| GITSG [16] | 单独放疗与 5-FU/60 Gy XRT 相比 | 40 周 | 20 周 | <.01 | |
| 心电图 [17] | 辐射与 5-FU、丝裂霉素 C/59 Gy XRT | 8.4 个月 | 7.1 个月 | .16 | |
| 2000 年后 | |||||
| FFCD [18] | GEM 与 GEM、顺铂、60 Gy XRT | 8.6 个月 | 13 个月 | .03 | |
| 心电图 [19] | GEM 与 GEM/50.4 Gy XRT | 11.1 个月 | 9.2 个月 | .017 | |
证据(放化疗):
三项试验评估了联合治疗与单独放疗的比较。[16-18]这些试验在设计或分析方面存在重大缺陷。最初,实践标准是根据前两项研究的数据进行放化疗。然而,随着第三项研究的发表,标准做法转变为在没有转移的情况下化疗后放化疗。
- LAP07 (NCT00634725):LAP07 研究是一项国际性随机 III 期研究,基于 Groupe Coopérateur Multidisciplinaire en Oncologie (GERCOR) 研究的结果。2008 年至 2011 年间,共有 449 名患者入组,通过两步随机化过程进行随机分配。第一步,患者被随机分配到吉西他滨诱导组 (n = 223) 或吉西他滨加厄洛替尼组 (n = 219),持续四个周期。对于第二步,将肿瘤受控的患者第二次随机分配 (n = 269) 接受化疗 (n = 136) 或放化疗 (n = 133)。开出 54 Gy 的总剂量,每天 30 次,同时以 800 mg/m 的剂量卡培他滨2放疗日每日 2 次。[20][证据等级 A1]
- 主要终点是 OS。经过中期分析,该研究因无效而提前终止。
- 中位随访时间为 36.7 个月,从第一次随机分组日期开始的中位 OS 在 16.5 个月时的化疗 (95% CI, 14.5-18.5) 和 15.2 个月时的放化疗 (95% CI, 13.9-17.3;P = .83)。
- 接受吉西他滨的患者第一次随机分组后的中位 OS 为 13.6 个月 (95% CI,12.3-15.3),为 11.9 个月 (95% CI,10.4-13.5;P = .09) 对于接受吉西他滨加厄洛替尼的患者。
LAP07 研究代表了关于放化疗在基于吉西他滨的诱导化疗中的作用的最稳健、前瞻性、随机的 III 期数据,该化疗显示没有 OS 获益。然而,这项研究是在 FOLFIRINOX 化疗出现之前开始的,FOLFIRINOX 化疗已被广泛采用于当地晚期环境中。放化疗在更积极的化疗方案(包括吉西他滨/紫杉醇和 FOLFIRINOX)中的作用尚未得到评估。
- 胃肠道肿瘤研究组 (GITSG) GITSG-9273 试验:在 2000 年之前,几项 III 期试验评估了联合治疗与单独放疗。在将吉西他滨用于局部晚期或转移性胰腺癌患者之前,GITSG 的研究人员将 106 名局部晚期胰腺癌患者随机分配接受单独外照射放射治疗 (EBRT) (60 Gy) 或同时接受 EBRT (40 Gy 或 60 Gy) 加推注 5-FU。[16][证据等级 A1]
- 当发现放化疗组疗效更好时,该研究提前停止。单独接受 EBRT 的患者 1 年生存率为 11%,而接受 40 Gy 放化疗的患者为 38%,接受 60 Gy 放化疗的患者为 36%。
- 在联合模式组再招募 88 名患者后,60 Gy EBRT 加 5-FU 有提高生存率的趋势,但与 40 Gy 组相比,进展时间和 OS 的差异无统计学意义。[21]
- ECOG E-8282 试验:ECOG 的研究人员将 114 名患者随机分配接受单独放射治疗 (59.4 Gy) 或同时输注 5-FU (1,000 mg/m2/d 在第 2-5 天和第 28-31 天)加丝裂霉素(10 mg/m2在第 2 天)。[17]]
- 该试验报告两组之间的 OS 没有差异。
- Fédération Francophone de Cancérologie Digest-Société Française de Radiothérapie Oncologie (FFCD-SFRO) 试验:由于很明显单独放疗是一种不适当的治疗方法,研究人员评估了联合方法与单独化疗的比较。FFCD-SFRO 的研究人员将 119 名患者随机分配到诱导放化疗组(60 Gy,分 2 Gy,300 mg/m2第 1-5 天连续输注 5-FU 的 /d,持续 6 周和 20 mg/m2/d 顺铂在第 1 周和第 5 周的第 1-5 天)或诱导吉西他滨(1,000 mg/m)2每周一次,持续 7 周)。对两组均给予吉西他滨维持治疗,直至因疾病进展或因毒性而停止治疗。[22][证据等级 A1]
- 吉西他滨组的中位生存期更高 (13 vs. 8.6 个月;P = .03)。
- 非血液学 3 至 4 级毒性(主要是胃肠道)在放化疗组中明显更常见 (44% vs. 18%;P = .004),并且更少的患者完成了至少 75% 的诱导治疗 (42% vs. 73%)。
- 尽管如此,在接受至少 75% 计划治疗的患者的方案分析中,生存获益仍然存在。值得注意的是,放化疗组维持吉西他滨的剂量强度显着降低,因为 3 至 4 级血液学毒性的发生率更高 (71% vs. 27%;P = .0001)。
- 作为这项研究的结果,给予诱导放化疗已经失去了支持。
- 心电图:FFCD-SFRO 研究的结果与 ECOG 的一项研究结果相矛盾,在该研究中,研究人员将 74 名患者随机分配到单独吉西他滨组或吉西他滨放疗后吉西他滨组。[19] 值得注意的是,由于应计不佳,该研究提前结束。
- 主要终点是生存率,化疗为 9.2 个月 (95% CI,7.9-11.4),联合治疗为 11.1 个月 (95% CI,7.6-15.5) (分层对数秩检验单侧 P = .017)。
- 放化疗组的 4 级和 5 级毒性大于化疗组 (41% vs. 9%)。
- GERCOR:鉴于放化疗的毒性增加和大部分局部晚期胰腺癌患者发生转移性疾病的早期发展,研究人员正在寻求一种选择局部疾病患者进行放化疗的策略。通过这种策略,选定的患者在化疗数月后局部或全身没有进展性疾病。[23][证据等级 C1]
- 对 181 例参加前瞻性 II 期和 III 期 GERCOR 研究的患者的回顾性分析显示,29% 的患者在基于吉西他滨的化疗 3 个月后出现转移性疾病。
- 对于其余 71%,接受放化疗的患者的中位 OS 显著长于接受额外化疗的患者(15.0 个月对 11.7 个月;P = .0009)。
手术
局部晚期胰腺癌患者的肿瘤由于局部血管撞击或肿瘤浸润而在技术上无法切除。然而,随着化疗和放化疗的结合,一些患者可能成为根治性胰腺切除术的候选者。
姑息性手术
很大一部分 (约三分之一) 的胰腺癌患者表现为局部晚期疾病。患者可能受益于通过内镜、手术或放射学手段缓解胆道梗阻。[24]
目前的临床试验
使用我们的高级临床试验搜索来查找 NCI 支持的癌症临床试验,这些临床试验目前正在招募患者。可以根据试验地点、治疗类型、药物名称和其他标准缩小搜索范围。还提供有关临床试验的一般信息。
引用
- Iacobuzio-Donahue CA、Fu B、Yachida S 等:原发癌的 DPC4 基因状态与胰腺癌患者的失败模式相关。临床肿瘤学杂志 27 (11):1806-13,2009 年。[PUBMED 摘要]
- van den Bosch RP、van der Schelling GP、Klinkenbijl JH 等:手术和内假体在晚期胰腺癌阻塞性黄疸姑息中的应用指南。安外科杂志 219 (1):18-24,1994。[PUBMED 摘要]
- Baron TH:用于治疗胃肠道癌性梗阻的可膨胀金属支架。N Engl J Med 344 (22):1681-7,2001 年。[PUBMED 摘要]
- Tepper JE、Noyes D、Krall JM 等:胰腺癌的术中放射治疗:RTOG-8505 的报告。放射治疗肿瘤学组。国际放射肿瘤生物学杂志21(5):1145-9,1991。[PUBMED 摘要]
- Reni M、Panucci MG、Ferreri AJ 等:可切除胰腺癌术中电子束照射对局部控制和生存的影响。国际放射肿瘤生物学杂志 50 (3):651-8,2001。[PUBMED 摘要]
- Conroy T、Desseigne F、Ychou M 等人:FOLFIRINOX 与吉西他滨治疗转移性胰腺癌。N Engl J Med 364 (19):1817-25,2011 年。[PUBMED 摘要]
- Von Hoff DD、Ervin T、Arena FP 等:白蛋白结合型紫杉醇加吉西他滨提高胰腺癌的生存率。N Engl J Med 369 (18):1691-703,2013 年。[PUBMED 摘要]
- Rothenberg ML、Moore MJ、Cripps MC 等:吉西他滨在 5-FU 难治性胰腺癌患者中的 II 期试验。安·昂科尔 7 (4):347-53,1996 年。[PUBMED 摘要]
- Burris HA、Moore MJ、Andersen J 等:吉西他滨作为晚期胰腺癌患者一线治疗的生存率和临床获益的改善:一项随机试验。临床肿瘤学杂志 15 (6):2403-13,1997。[PUBMED 摘要]
- Storniolo AM、Enas NH、Brown CA 等:吉西他滨患者的研究性新药治疗方案:3000 多名胰腺癌患者的结果。癌症 85 (6):1261-8,1999 年。[PUBMED 摘要]
- Moore MJ、Goldstein D、Hamm J 等:厄洛替尼联合吉西他滨与单独吉西他滨治疗晚期胰腺癌患者的比较:加拿大国家癌症研究所临床试验组的 III 期试验。J Clin Oncol 25 (15):1960-6,2007 年。[PUBMED 摘要]
- Poplin E、Feng Y、Berlin J 等:吉西他滨和奥沙利铂与吉西他滨(固定剂量率输注)与吉西他滨(30 分钟输注)在胰腺癌 E6201 患者中的 III 期随机研究:东部肿瘤合作组的一项试验。临床肿瘤学杂志 27 (23):3778-85,2009 年。[PUBMED 摘要]
- Colucci G、Labianca R、Di Costanzo F 等:吉西他滨联合顺铂与吉西他滨单药作为晚期胰腺癌患者一线治疗的随机 III 期试验:GIP-1 研究。临床肿瘤学杂志 28 (10):1645-51,2010。[PUBMED 摘要]
- Pelzer U、Kubica K、Stieler J 等人:吉西他滨难治性胰腺癌患者的随机试验。CONKO 003 研究的最终结果。[摘要]J Clin Oncol 26(增刊 15):A-4508,2008 年。
- Pelzer U、Schwaner I、Stieler J 等人:二线晚期胰腺癌患者的最佳支持治疗 (BSC) 与奥沙利铂、亚叶酸和 5-氟尿嘧啶 (OFF) 加 BSC:来自德国 CONKO 研究组的 III 期研究。欧洲癌症杂志 47 (11):1676-81,2011 年。[PUBMED 摘要]
- 单独放疗和联合 5-氟尿嘧啶治疗局部不可切除胰腺癌的多机构比较试验。胃肠道肿瘤研究组。安外科杂志 189 (2):205-8,1979 年。[PUBMED 摘要]
- Cohen SJ、Dobelbower R、Lipsitz S 等人:局部晚期胰腺癌患者单独放疗或联合 5-氟尿嘧啶和丝裂霉素-C 的随机 III 期研究:东部肿瘤合作组研究 E8282。国际放射肿瘤生物学杂志62(5):1345-50,2005。[PUBMED 摘要]
- Chauffert B、Mornex F、Bonnetain F 等人:在局部晚期非转移性胰腺癌患者中比较初始放化疗(间歇性顺铂和输注 5-FU)后吉西他滨与单独使用吉西他滨的 III 期试验:一项 FFCD-SFRO 研究。[摘要]J Clin Oncol 24(增刊 18):A-4008,180 年代,2006 年。
- Loehrer PJ、Feng Y、Cardenes H 等人:局部晚期胰腺癌患者单独使用吉西他滨与吉西他滨加放疗:一项东部肿瘤合作组试验。临床肿瘤学杂志 29 (31):4105-12,2011 年。[PUBMED 摘要]
- Hammel P、Huguet F、van Laethem JL 等:放化疗与化疗对吉西他滨联合或不联合厄洛替尼 4 个月后控制的局部晚期胰腺癌患者生存率的影响:LAP07 随机临床试验。美国医学会 315 (17):1844-53,2016 年。[PUBMED 摘要]
- Moertel CG、Frytak S、Hahn RG 等:局部不可切除胰腺癌的治疗:单独高剂量(6000 拉德)放疗、中等剂量放疗(4000 拉德 + 5-氟尿嘧啶)和高剂量放疗 + 5-氟尿嘧啶的随机比较:胃肠道肿瘤研究组。癌症 48 (8):1705-10,1981 年。[PUBMED 摘要]
- Chauffert B、Mornex F、Bonnetain F 等:比较强化诱导放化疗(60 Gy、输注 5-FU 和间歇性顺铂)联合吉西他滨维持治疗与单独吉西他滨治疗局部晚期不可切除胰腺癌的 III 期试验。2000-01 年 FFCD/SFRO 研究的明确结果。安·昂科尔 19 (9):1592-9,2008 年。[PUBMED 摘要]
- Huguet F、André T、Hammel P 等:GERCOR II 期和 III 期研究中局部晚期胰腺癌化疗后放化疗的影响。临床肿瘤学杂志 25 (3):326-31,2007 年。[PUBMED 摘要]
- Sohn TA、Lillemoe KD、Cameron JL 等:1990 年代不可切除壶腹周围腺癌的手术姑息治疗。J Am Coll 外科杂志188(6):658-66;讨论 666-9,1999 年。[PUBMED 摘要]
转移性或复发性胰腺癌的治疗
转移性或复发性胰腺癌的治疗选择
转移性或复发性胰腺癌的治疗方案包括:
- 化疗联合或不联合靶向治疗。
- 评估新抗癌药物单独或与化疗联合使用的临床试验。
对于任何疾病阶段的患者,都可以考虑姑息治疗。有关更多信息,请参阅姑息疗法部分。
化疗联合或不联合靶向治疗
由于姑息性化疗方案的客观缓解率低且疗效有限,所有新诊断的患者都应考虑参加临床试验。与单药吉西他滨相比,多药化疗组合已被证明可以延长结局。[1-3]
证据(单药化疗):
证据(多药化疗):
- FOLFIRINOX (亚叶酸、5-FU、伊立替康和奥沙利铂) 与吉西他滨:一项多中心 II/III 期试验包括 342 例转移性胰腺癌患者,Eastern Cooperative Oncology Group 体能状态评分为 0 或 1。[4][证据级别 A1]患者被随机分配接受 FOLFIRINOX (奥沙利铂 [85 mg/m2],伊立替康 [180 mg/m]2],亚叶酸 [400 mg/m]2] 和 5-FU [400 mg/m2] 推注,然后 2,400 mg/m2每 2 周连续输注 46 小时)或吉西他滨(1,000 mg/m)2每周一次,持续 8 周中的 7 周,然后每周一次,持续 4 周中的 3 周)。
- FOLFIRINOX 组的中位总生存期 (OS) 为 11.1 个月,而吉西他滨组为 6.8 个月(风险比 [HR]死亡, 0.57;95% 置信区间 [CI],0.45-0.73;P < .001)。
- FOLFIRINOX 组的中位无进展生存期 (PFS) 为 6.4 个月,吉西他滨组为 3.3 个月(疾病进展的 HR 为 0.47;95% CI,0.37-0.59;P < .001)。
- FOLFIRINOX 比吉西他滨毒性更大;该组中 5.4% 的患者患有发热性中性粒细胞减少症。在 6 个月时,FOLFIRINOX 组 31% 的患者生活质量明显下降,而吉西他滨组为 66%(HR,0.47;95% CI,0.30-0.70;P < .001)。
- 基于这项试验,FOLFIRINOX 被认为是晚期胰腺癌患者的标准治疗选择。
- NALIRIFOX (5-FU、伊立替康 sucrosofate [也称为纳米脂质体伊立替康] 和奥沙利铂)与吉西他滨和白蛋白结合型紫杉醇的对比:多中心、开放标签、III 期 NAPOLI 3 研究 (NCT04083235) 包括 770 名确诊胰腺导管腺癌的患者,这些患者以前未接受过转移性疾病治疗。患者以 1:1 的比例随机分配接受 NALIRIFOX(伊立替康 sucrosofate [50 mg/m]2],奥沙利铂 [60 mg/m2],亚叶酸 [400 mg/m]2] 和 5-FU [2,400 mg/m]2] 在持续 28 天的周期的第 1 天和第 15 天静脉输注超过 46 小时)或白蛋白结合型紫杉醇(125 mg/m2)和吉西他滨(1,000 毫克/米)2在持续 28 天的周期的第 1、8 和 15 天静脉内给药)。NALIRIFOX 与吉西他滨/白蛋白结合型紫杉醇的主要终点是 OS 从随机分组到因任何原因死亡。次要终点包括 PFS 和 RECIST 1.1 版的总体缓解率。[5]
- NALIRIFOX 组的中位 OS 为 11.1 个月 (95% CI,10.0-12.1),白蛋白结合型紫杉醇/吉西他滨组为 9.2 个月 (95% CI,8.3-10.6) (HR,0.83;95% CI,0.7-0.99;P = .036)。中位随访时间为 16.1 个月。[5][证据等级 A1]
- NALIRIFOX 组的中位 PFS 为 7.4 个月,白蛋白结合型紫杉醇/吉西他滨组为 5.6 个月 (HR,0.69;95% CI,0.58-0.83;P < .0001)。
- NALIRIFOX 组的总体反应率为 42%,白蛋白结合型紫杉醇/吉西他滨组为 36% (P = .11)。NALIRIFOX 组的中位缓解持续时间为 7.3 个月,白蛋白结合型紫杉醇/吉西他滨组为 5 个月 (HR,0.67;95% CI,0.48-0.93)。
- NALIRIFOX 组有 369 名患者 (>99%) 发生任何不良事件,白蛋白结合型紫杉醇/吉西他滨组有 376 名患者 (99%) 发生任何不良事件。NALIRIFOX 组最常见的 3 至 4 级毒性是腹泻 (20%) 、低钾血症 (15%) 、中性粒细胞减少症 (14%) 和恶心 (12%)。白蛋白结合型紫杉醇/吉西他滨组最常见的 3 至 4 级毒性是中性粒细胞减少症 (25%) 和贫血 (17%)。值得注意的是,NALIRIFOX 组的血液学毒性 (即中性粒细胞减少、贫血、血小板减少症) 低于白蛋白结合型紫杉醇/吉西他滨组。NALIRIFOX 组 3% 的患者出现周围神经病变,而吉西他滨/白蛋白结合型紫杉醇组为 6% 的患者。
基于这项试验,NALIRIFOX 是晚期胰腺癌患者的标准一线治疗选择。
- 吉西他滨和白蛋白结合型紫杉醇与吉西他滨:一项多中心、国际、III 期试验 (NCT00844649) 包括 861 名转移性胰腺癌患者。患者的 Karnofsky 体能状态至少为 70,并且之前未接受过转移性疾病化疗。[6][证据级别 A1]接受吉西他滨辅助或任何其他化疗的患者被排除在外。患者被随机分配接受吉西他滨(1,000 mg/m2)和白蛋白结合型紫杉醇(125 mg/m2体表面积)每周一次,持续 3 次,持续 4 周或吉西他滨单药治疗(1,000 mg/m)2每周一次,持续 8 周中的 7 周,然后每周一次,持续 4 周中的 3 周)。
- 白蛋白结合型紫杉醇/吉西他滨组的中位 OS 为 8.5 个月,而吉西他滨组为 6.7 个月(HR死亡, 0.72;95% CI,0.62–0.83;P < .001)。
- 白蛋白结合型紫杉醇/吉西他滨组的中位 PFS 为 5.5 个月,吉西他滨组为 3.7 个月(HR疾病进展, 0.69;95% CI,0.58–0.82;P < .001)。
- 白蛋白结合型紫杉醇/吉西他滨的毒性比吉西他滨大。白蛋白结合型紫杉醇/吉西他滨组最常见的 3 级毒性是中性粒细胞减少症 (38%) 、疲劳 (17%) 和神经病变 (17%);发热性中性粒细胞减少症发生在 3% 的患者中。在吉西他滨单药组中,最常见的 3 级毒性是中性粒细胞减少症 (27%) 、疲劳 (1%) 和神经病变 (1%);中性粒细胞减少性发热发生在 1% 的患者中。
- 在白蛋白结合型紫杉醇/吉西他滨组中,从 3 级神经病变到 1 级神经病变或消退的中位时间为 29 天。在 3 级周围神经病变患者中,44% 的患者能够在 3 级事件发作后的中位 23 天内以减少的剂量恢复治疗。
- 基于这项试验,白蛋白结合型紫杉醇加吉西他滨是晚期胰腺癌患者的标准治疗选择。
- 没有测量该方案的生活质量数据,本研究没有讨论白蛋白结合型紫杉醇/吉西他滨与 FOLFIRINOX 的疗效。
- 单独使用吉西他滨与吉西他滨和厄洛替尼:加拿大国家癌症研究所进行了一项 III 期试验 (CAN-NCIC-PA3 [NCT00026338]),比较了单独使用吉西他滨与吉西他滨和厄洛替尼联合治疗 (100 mg/d) 治疗晚期或转移性胰腺癌患者。[7][证据等级 A1]
- 加用厄洛替尼与单独吉西他滨联合使用时,适度延长了生存期(HR,0.81;95% CI,0.69-0.99;P = .038)。
- 厄洛替尼组患者的相应中位生存率为 6.2 个月,安慰剂组为 5.9 个月。厄洛替尼组患者的 1 年生存率为 23%,安慰剂组为 17%。
证据(二线化疗):
- 伊立替康 sucrosofate 联合或不联合 5-FU 和亚叶酸: NAPOLI-1 试验 (NCT01494506) 评估了伊立替康 sucrosofate 在既往接受过基于吉西他滨的治疗的转移性胰腺癌患者中的作用。[8] 伊立替康 sucrosofate 是伊立替康的包封制剂,旨在增加伊立替康及其活性代谢物的瘤内水平。在这项研究中,共有 417 名患者被随机分配接受伊立替康 sucrosofate 单药治疗(120 mg/m2每 3 周一次;n = 151)、5-FU 和亚叶酸 (n = 149) 或伊立替康 sucrosofate (80 mg/m)2每 2 周加 5-FU)和亚叶酸 (n = 117)。[8][证据等级 B1]
- 接受伊立替康舒克索韦特联合 5-FU 的患者中位 OS 为 6.1 个月 (95% CI,4.8-8.9),接受 5-FU 和亚叶酸的患者中位 OS 为 4.2 个月 (95% CI,3.6-4.9) (P = .012)。接受伊立替康舒克索福特单药治疗的患者中位 OS 为 4.9 个月 (95% CI,4.2-5.6),而接受 5-FU 和亚叶酸的患者为 4.2 个月 (95% CI,3.6-4.9) (未分层 HR,0.99;P = .94)。在多变量分析中,伊立替康 sucrosofate 加 5-FU 和亚叶酸与改善 OS 相关 (HR,0.58;95% CI,0.42-0.81)。
- 接受伊立替康 sucrosofate 加 5-FU 和亚叶酸的患者最常发生 3 级或 4 级不良事件,包括中性粒细胞减少症 (27%) 、腹泻 (13%) 、呕吐 (11%) 和疲劳 (14%)。
- 尽管方案之间的生存率和毒性存在差异,但治疗组之间的生活质量没有显著差异。
- 使用伊立替康 sucrosofate 而不是未包封的伊立替康的益处尚未确定,因为本研究对照组的方案是 5-FU/亚叶酸。此外,在一线治疗中使用 FOLFIRINOX 后使用伊立替康 sucrosofate 的价值尚不清楚。
- 5-FU、亚叶酸和奥沙利铂(OFF 方案)与最佳支持治疗 (BSC) 相比:以吉西他滨为基础的方案进展后二线化疗可能是有益的。Charité Onkologie (CONKO)-003 研究人员将需要二线化疗的患者随机分配到 OFF 方案或 BSC。[2];[3][证据级别 C1]OFF 方案包括亚叶酸 (200 mg/m2),然后是 5-FU (2,000 mg/m)2[24 小时连续输注] 第 1、8、15 和 22 天)和奥沙利铂 (85 mg/m2在第 8 天和第 22 天)。休息 3 周后,下一个周期从第 43 天开始。由于应计率低,该试验提前终止,只有 46 例患者被随机分配到 OFF 方案或 BSC。
- OFF 治疗方案的中位生存期为 4.82 个月 (95% CI,4.29-5.35),单独使用 BSC 的中位生存期为 2.30 个月 (95% CI,1.76-2.83) (HR,0.45;95% CI,0.24-0.83)。
- 吉西他滨/OFF 序列的中位 OS 为 9.09 个月,吉西他滨/BSC 的中位 OS 为 7.90 个月。
- 研究的提前结束和患者数量非常少使 P 值具有误导性。因此,OFF 方案的二线化疗可能与生存率的提高错误相关。
- FOLFOX (亚叶酸、5-FU 和奥沙利铂) 与吉西他滨化疗后 5-FU/亚叶酸的比较: 前瞻性、多中心 PANCREOX 试验包括 108 名既往接受过一线吉西他滨化疗的晚期胰腺癌患者。患者被随机分配接受 5-FU/亚叶酸而不使用奥沙利铂 (n = 54) 或奥沙利铂 (n = 54),作为改良的 FOLFOX-6 (mFOLFOX-6) 给药。[9][证据级别 C1] 该研究的目标应计为 128 名患者,提前结束 因为应计缓慢。
- 中位随访 8.8 个月后,mFOLFOX-6 组的中位 PFS 为 3.1 个月,输注 5-FU 组为 2.9 个月 (HR,1.00;95% CI,0.66-1.53,P = .989)。
- 两组的总体缓解率和生活质量无显著差异。
- mFOLFOX-6 组 3 级或 4 级不良事件的总体发生率为 63%,5-FU/亚叶酸组为 11%。然而,mFOLFOX-6 组因不良事件退出研究的患者多于 5-FU/亚叶酸组患者 (20% vs. 2%)。
- 基于这项研究,在一线基于吉西他滨的化疗后的晚期胰腺癌患者中,与输注 5-FU/亚叶酸相比,添加 mFOLFOX-6 方案中的奥沙利铂没有益处。这些结果可能表明,基于奥沙利铂的转移性胰腺癌方案可能在一线治疗中产生最大的益处。
- FOLFIRINOX 失败或不耐受后吉西他滨/紫杉醇与吉西他滨的比较:前瞻性、开放标签、III 期 GEMPAX 研究 (NCT03943667) 包括 211 例转移性胰腺癌患者,这些患者在完成一线 FOLFIRINOX 治疗(包括 FOLFIRINOX 治疗作为辅助治疗)期间或之后 3 个月内进展或不耐受这种治疗。患者被随机分配到以下治疗组之一:[10]
- 吉西他滨/紫杉醇:吉西他滨(1,000 mg/m2)和溶剂型紫杉醇 (80 mg/m2) 在 28 天周期的第 1、8 和 15 天。
- 单独使用吉西他滨:吉西他滨(1,000 毫克/米2) 在 29 天周期的第 1、8 和 15 天。
观察到以下结果:
- 接受吉西他滨/紫杉醇治疗的患者 (中位随访 13.4 个月后 6.4 个月) 或单独接受吉西他滨治疗 (随访 13.8 个月后 5.9 个月) 的 OS 无显著差异 (HR, 0.87;95% CI, 0.63–1.20;P = .4095)。然而,以下接受吉西他滨/紫杉醇治疗的患者亚组的 OS 有所改善:(1) 65 岁或以下的患者 (HR, 0.66;95% CI, 0.44-0.99),以及 (2) CA 19-9 水平为基线时正常上限或更高 59 倍的患者 (HR, 0.64;95% CI, 0.42-0.97)。[10][证据等级 B1]
- 吉西他滨/紫杉醇组的 PFS 为 3.1 个月,吉西他滨单药组为 2.0 个月 (HR,0.64;95% CI,0.47-0.89,P = .0067)。 吉西他滨/紫杉醇组的客观缓解率为 17.1%,吉西他滨单独治疗组为 4.2% (P = .008)。
- 吉西他滨/紫杉醇组 32.1% 的患者和吉西他滨单药组 46.5% 的患者接受了三线治疗。
- 吉西他滨/紫杉醇组 3 级或以上治疗相关不良事件的总体发生率为 58%,吉西他滨单药组为 27.1%。在吉西他滨/紫杉醇组中,13% 的患者发生了严重的治疗相关不良事件,而吉西他滨单药组为 7.1%。与吉西他滨单药治疗组相比,吉西他滨/紫杉醇组患者最常见的 3 级或以上治疗相关不良事件是贫血(15.2% 对 4.3%)、血小板减少症(19.6% 对 4.3%)、中性粒细胞减少症(15.9% 对 15.7%)、周围神经病变(12.3% 对 0%)和虚弱(10.1% 对 2.9%)。有 1 例与吉西他滨/紫杉醇治疗相关的 5 级不良事件,归因于急性呼吸窘迫。
- 基于这项研究,与单独使用吉西他滨相比,二线吉西他滨/紫杉醇没有观察到 OS 获益。然而,某些亚组 (65 岁或以下的患者和基线时 CA 19-9 水平高的患者) 有 OS 获益。吉西他滨/紫杉醇组的 PFS 和客观缓解率显著升高。因此,考虑到治疗相关不良事件的发生率较高,可以考虑对合适的患者使用吉西他滨/紫杉醇进行联合治疗。
种系 BRCA1/BRCA2 变异患者的特殊注意事项
BRCA1 或 BRCA2 的种系变异见于 4%-8% 的胰腺癌患者。[11,12]BRCA1/BRCA2 编码同源修复途径和 DNA 双链断裂修复中的蛋白质,因此可能对进一步的 DNA 损伤更敏感。具有 BRCA1/BRCA2 变体的胰腺肿瘤对铂类治疗的反应有所改善。[13] 聚 (ADP-核糖) 聚合酶 (PARP) 抑制被认为通过抑制单链断裂修复与 BRCA1/BRCA2 变体协同作用。几种 PARP 抑制剂已被批准用于治疗 BRCA1/BRCA2 突变的晚期卵巢癌和乳腺癌患者,并且正在积极研究用于治疗 BRCA1/BRCA2 突变的胰腺癌患者。
奥拉帕尼
奥拉帕尼(一种 PARP 抑制剂)维持治疗可考虑用于对一线含铂治疗反应超过 4 个月的种系 BRCA1/BRCA2 变异型和转移性胰腺癌患者。
证据(奥拉帕尼):
- POLO 试验 (NCT02184195):一项多中心、III 期、随机、双盲、安慰剂对照试验,包括 154 名具有种系 BRCA1 或 BRCA2 变异的转移性胰腺癌患者,这些患者在一线铂类化疗 16 周后疾病未进展。[14][证据级别 B1]患者以 3:2 的比例接受奥拉帕尼 (300 mg,每日 2 次) 或安慰剂组,并评估 PFS。
- 在筛查的 3,315 名患者中,247 名患者被鉴定出具有种系 BRCA 变异。
- 奥拉帕尼组的中位 PFS 为 7.4 个月,安慰剂组为 3.8 个月 (HR,0.53;95% CI,0.35\u20120.82;P = .004)
- 奥拉帕尼组的中位 OS 为 18.9 个月,安慰剂组为 18.1 个月 (HR,0.91;95% CI,0.56\u20121.46;P = .68)。
- 与安慰剂 (23%) 相比,奥拉帕尼 (40%) 的 3 级或 4 级治疗相关不良事件更多。
目前的临床试验
使用我们的高级临床试验搜索来查找 NCI 支持的癌症临床试验,这些临床试验目前正在招募患者。可以根据试验地点、治疗类型、药物名称和其他标准缩小搜索范围。还提供有关临床试验的一般信息。
引用
- Burris HA、Moore MJ、Andersen J 等:吉西他滨作为晚期胰腺癌患者一线治疗的生存率和临床获益的改善:一项随机试验。临床肿瘤学杂志 15 (6):2403-13,1997。[PUBMED 摘要]
- Pelzer U、Kubica K、Stieler J 等人:吉西他滨难治性胰腺癌患者的随机试验。CONKO 003 研究的最终结果。[摘要]J Clin Oncol 26(增刊 15):A-4508,2008 年。
- Pelzer U、Schwaner I、Stieler J 等人:二线晚期胰腺癌患者的最佳支持治疗 (BSC) 与奥沙利铂、亚叶酸和 5-氟尿嘧啶 (OFF) 加 BSC:来自德国 CONKO 研究组的 III 期研究。欧洲癌症杂志 47 (11):1676-81,2011 年。[PUBMED 摘要]
- Conroy T、Desseigne F、Ychou M 等人:FOLFIRINOX 与吉西他滨治疗转移性胰腺癌。N Engl J Med 364 (19):1817-25,2011 年。[PUBMED 摘要]
- Wainberg ZA、Melisi D、Macarulla T 等:NALIRIFOX 与白蛋白结合型紫杉醇和吉西他滨在转移性胰腺导管腺癌 (NAPOLI 3) 初治患者中的比较:一项随机、开放标签、3 期试验。柳叶刀402 (10409):1272-1281,2023。[PUBMED 摘要]
- Von Hoff DD、Ervin T、Arena FP 等:白蛋白结合型紫杉醇加吉西他滨提高胰腺癌的生存率。N Engl J Med 369 (18):1691-703,2013 年。[PUBMED 摘要]
- Moore MJ、Goldstein D、Hamm J 等:厄洛替尼联合吉西他滨与单独吉西他滨治疗晚期胰腺癌患者的比较:加拿大国家癌症研究所临床试验组的 III 期试验。J Clin Oncol 25 (15):1960-6,2007 年。[PUBMED 摘要]
- Wang-Gillam A、Li CP、Bodoky G 等:既往基于吉西他滨的治疗后使用氟尿嘧啶和亚叶酸的纳米脂质体伊立替康治疗转移性胰腺癌 (NAPOLI-1):一项全球性、随机、开放标签的 3 期试验。柳叶刀 387 (10018):545-57,2016 年。[PUBMED 摘要]
- Gill S、Ko YJ、Cripps C 等人:PANCREOX:氟尿嘧啶/亚叶酸联合或不联合奥沙利铂治疗接受吉西他滨化疗患者的二线晚期胰腺癌的随机 III 期研究。临床肿瘤学杂志 34 (32):3914-3920,2016 年。[PUBMED 摘要]
- De la Fouchardière C、Malka D、Cropet C 等:转移性胰腺癌中 5-氟尿嘧啶、奥沙利铂和伊立替康治疗后吉西他滨和紫杉醇与单独使用吉西他滨的比较:一项随机 III 期 PRODIGE 65-UCGI 36-GEMPAX UNICANCER 研究。临床肿瘤学杂志 42 (9):1055-1066,2024。[PUBMED 摘要]
- Holter S、Borgida A、Dodd A 等:胰腺癌患者大型临床队列中的种系 BRCA 突变。临床肿瘤学杂志 33 (28):3124-9,2015 年。[PUBMED 摘要]
- 癌症基因组图谱研究网络。电子地址:andrew_aguirre@dfci.harvard.edu,癌症基因组图谱研究网络:胰腺导管腺癌的综合基因组表征。癌细胞 32 (2):185-203.e13,2017 年。[PUBMED 摘要]
- Golan T、Kanji ZS、Epelbaum R 等:BRCA 突变携带者胰腺癌的总生存期和临床特征。Br J 癌症 111 (6):1132-8,2014。[PUBMED 摘要]
- Golan T、Hammel P、Reni M 等人:种系 BRCA 突变转移性胰腺癌的维持奥拉帕尼。N Engl J Med 381(4):317-327,2019 年。[PUBMED 摘要]
姑息治疗
胰腺癌患者的姑息治疗选择包括:
引用
- Sohn TA、Lillemoe KD、Cameron JL 等:1990 年代不可切除壶腹周围腺癌的手术姑息治疗。J Am Coll 外科杂志188(6):658-66;讨论 666-9,1999 年。[PUBMED 摘要]
- Baron TH:用于治疗胃肠道癌性梗阻的可膨胀金属支架。N Engl J Med 344 (22):1681-7,2001 年。[PUBMED 摘要]
- Polati E、Finco G、Gottin L 等人:胰腺癌患者神经溶解性腹腔神经丛阻滞的前瞻性随机双盲试验。Br J 外科杂志 85 (2):199-201,1998。[PUBMED 摘要]
本摘要的最新更新(2025 年 2 月 12 日)
PDQ 癌症信息摘要会定期审查,并在获得新信息时进行更新。本节介绍截至上述日期对此摘要所做的最新更改。
更新了 2025 年估计的新病例和死亡人数的统计数据(引用美国癌症协会作为参考文献 1)。
关于随机、开放标签、III 期 PRODIGE-24 试验结果的修订文本,该试验随机分配 493 例 R0/R1 切除术患者接受 6 个周期的吉西他滨或 12 个周期的 FOLFIRINOX(奥沙利铂、亚叶酸、伊立替康和氟尿嘧啶)(引用 Conroy 等人作为参考文献 24)。
本摘要由 PDQ 成人治疗编辑委员会编写和维护,该委员会是 编辑独立于 NCI。本摘要反映了对 文献,不代表 NCI 或 NIH 的政策声明。更多 有关摘要政策和 PDQ 编辑委员会角色的信息 维护 PDQ 摘要可在关于此 PDQ 摘要和卫生专业人员的 PDQ® 癌症信息页面上找到。
关于此 PDQ 摘要
本摘要的目的
本面向卫生专业人员的 PDQ 癌症信息摘要提供了有关成人胰腺癌治疗的全面、同行评审、循证信息。它旨在作为一种资源,告知和协助临床医生照顾他们的患者。它没有为做出医疗保健决策提供正式的指南或建议。
审稿人和更新
本摘要由 PDQ 成人治疗编辑委员会定期审查,并在必要时进行更新,该委员会在编辑上独立于美国国家癌症研究所 (NCI)。本摘要反映了对文献的独立审查,不代表 NCI 或美国国立卫生研究院 (NIH) 的政策声明。
委员会成员每个月都会审查最近发布的文章,以确定文章是否应该:
- 在会议上讨论,
- 被引用并带有文本,或
- 替换或更新已引用的现有文章。
对摘要的更改是通过共识流程进行的,在该流程中,董事会成员评估已发表文章中证据的强度,并确定文章应如何包含在摘要中。
胰腺癌治疗的主要评价者是:
- Amit Chowdhry,医学博士,博士(罗切斯特大学医学中心)
- Leon Pappas,医学博士,博士(Dana-Farber 癌症研究所)
有关摘要内容的任何意见或问题应通过 NCI 网站的 Email Us(向我们发送电子邮件)提交给 Cancer.gov。请勿就摘要问题或意见联系个别董事会成员。董事会成员不会回复个人询问。
证据级别
本摘要中的一些参考文献引用附有证据级别名称。这些名称旨在帮助读者评估支持使用特定干预措施或方法的证据强度。PDQ 成人治疗编辑委员会在制定其证据等级名称时使用正式的证据排名系统。
使用此摘要的权限
PDQ 是注册商标。虽然 PDQ 文件的内容可以作为文本自由使用,但除非完整呈现并定期更新,否则不能将其识别为 NCI PDQ 癌症信息摘要。但是,作者可以写这样一句话:“NCI 关于乳腺癌预防的 PDQ 癌症信息摘要简洁地陈述了风险:[包括摘要的摘录]”。
此 PDQ 摘要的首选引用是:
PDQ® 成人治疗编辑委员会。PDQ 胰腺癌治疗。马里兰州贝塞斯达:美国国家癌症研究所。更新 <MM/DD/YYYY>。网址:https://www.cancer.gov/types/pancreatic/hp/pancreatic-treatment-pdq。访问 <MM/DD/YYYY>。[PMID:26389394]
本摘要中的图片经作者、艺术家和/或出版商许可使用,仅用于 PDQ 摘要。在 PDQ 信息上下文之外使用图像的许可必须从所有者处获得,并且不能由美国国家癌症研究所授予。有关使用本摘要中的插图以及许多其他癌症相关图像的信息,可在 Visuals Online 中找到,该集合包含 2,000 多张科学图像。
免責聲明
根据现有证据的强度,治疗方案可能被描述为 “标准” 或 “正在临床评估中”。这些分类不应用作确定保险赔偿的基础。有关保险范围的更多信息,请访问管理癌症护理页面上的 Cancer.gov。
联系我们
有关联系我们或获得 Cancer.gov 网站帮助的更多信息,请访问我们的联系我们寻求帮助页面。问题也可以通过网站的 Email Us(向我们发送电子邮件)提交给 Cancer.gov。
Hits: 57
