No, Really, mRNA Vaccines Are Not Going To Affect Your DNA
简短版本: mRNA 疫苗不可能改变您的 DNA。它基本上会违反我们对细胞生物学的所有了解。

Lodish H, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H, Amon A, Martin K. 分子细胞生物学。第 8 版。纽约:W.H. Freeman;2016. 图 5-1
这个数字很有用,因为你可以清楚地看到我们关心的两个区室:细胞核,它容纳了几乎所有的 DNA(讨论了例外),以及胞质溶胶,它是翻译发生的地方。
最近,我收到了很多关于我们如何真正确保 mRNA 疫苗不会影响我们的 DNA 的问题。在我之前关于这个主题的帖子中,我写道:

Lodish H, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H, Amon A, Martin K. 分子细胞生物学。第 8 版。纽约:W.H. Freeman;2016. 图 13-37B 展示了 mRNA 从细胞核输出。
另一个令人担忧的问题是 mRNA 可以以某种方式改变宿主的基因组。这实际上会非常酷,并且对基因治疗来说很重要(我终于可以给自己一个我一直想要的巨型蝙蝠翅膀了),但事实并非如此。这通常是不可能的,除非还存在从 RNA 模板产生 DNA 的逆转录酶,这就是逆转录病毒的工作原理。任何 mRNA 候选疫苗都没有这种风险。mRNA 疫苗完全在细胞的胞质溶胶内起作用——它们不会靠近所有 DNA 所在的细胞核。这实际上是基于 RNA 的疫苗相对于 DNA 疫苗的一个主要优势。
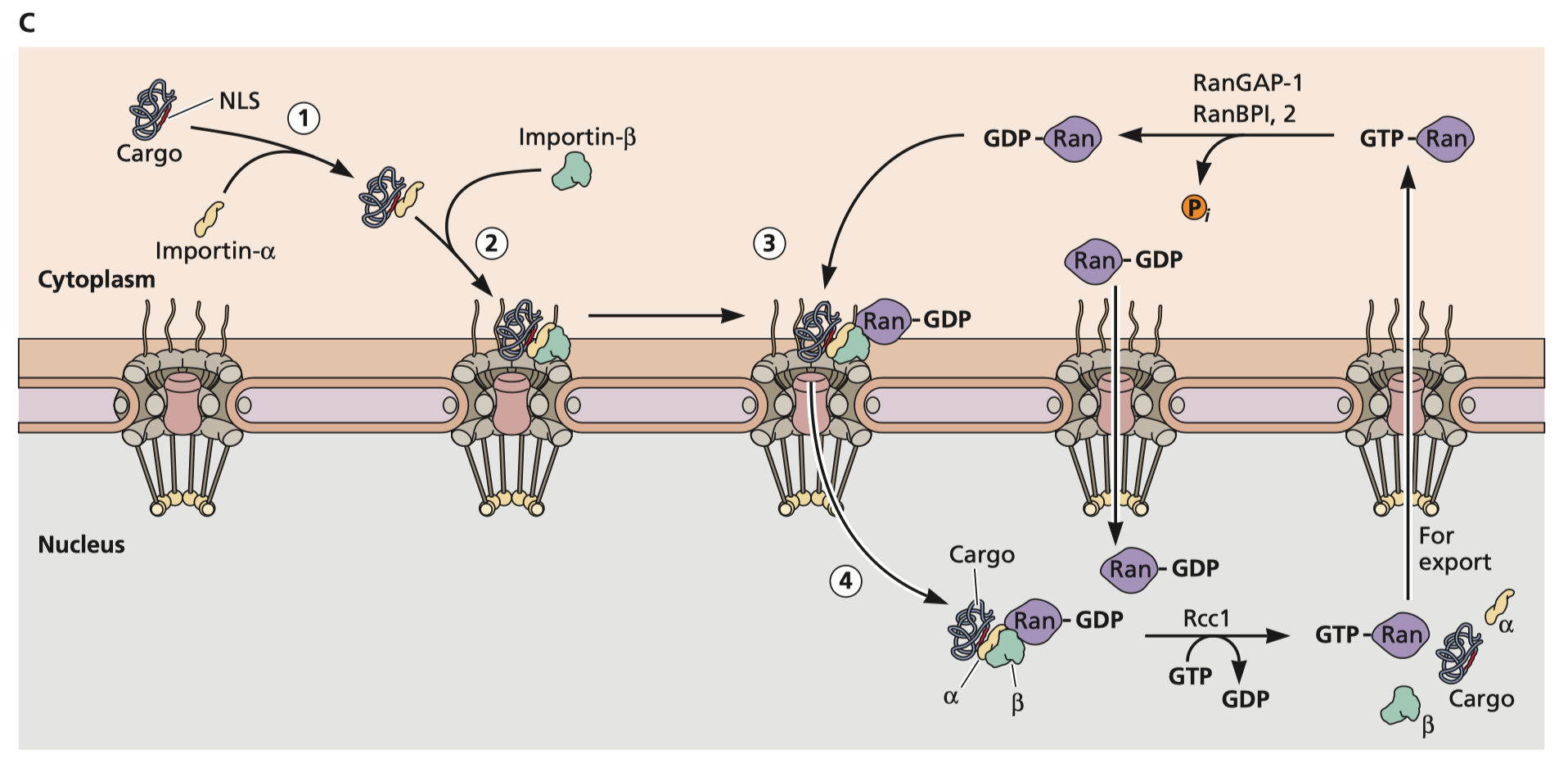
Flint S, Racaniello V, Rall G, Skalka A, Enquist L. 病毒学原理。华盛顿特区:ASM Press;2015. 图 5.23C,以流感核糖核蛋白为例显示核输入周期。核酸定位信号被 importin-α 识别,然后 importin-β 募集一种称为 Ran 的小 GTP 酶。当结合 GDP 时,Ran 能够跨核孔复合体运输 RNP。然后 importins 和 Ran 的复合物将解离,鸟嘌呤核苷酸交换因子将 GDP 交换为 GTP,从而允许 Ran-GTP 从细胞核输出。然后,RanGAP-1 或 RanBPI, 2 可以催化 GTP 水解为 GDP,这使得 Ran 能够结合另一个输入β以再次启动输入周期。
我给出这个回答很大程度上是因为我觉得对逆转录、核运输、内吞途径以及其他 11 个左右高级细胞生物学主题的详细讨论(我必须援引这些主题才能给出一个严格的答案)太复杂了,对普通人来说没有好处,他们想知道这是否可能。然而,我有一连串关于逆转录病毒或肝炎病毒(乙型肝炎)的“如果”的问题,我可以承认这个回答并没有解决这个问题,所以在这里我将尝试尽可能明确地回答这个问题,并以我的能力最低。
为了简化讨论,以避免解释磷脂双层的相位和脂质纳米颗粒的分子组成,因为它与稳定性有关(在 1、2、3、4 中讨论),我将要求读者理所当然地认为 mRNA 疫苗被内吞并释放(以及这)到细胞的细胞质中。
首先,要让 mRNA 影响您的 DNA,我们至少需要确定它需要获得相关 DNA。有两个亚细胞区室可以完成此作。第一个是核心,所以让我们从讨论核心中的货物贩运开始。细胞核是一个带有孔隙复合物 (NPC) 的隔离隔室,这些孔隙复合物对可以自由进入的颗粒的大小施加了限制。由于转录发生在细胞核内,因此 RNA 很容易运输出去,但产生蛋白质所需的核糖体在胞质溶胶或粗面内质网中。这个过程是由几种辅助蛋白介导的,您可以在右侧看到。但请注意,在任何生理情况下,人们都不需要将胞质溶胶中的 RNA 运输回细胞核。RNA 在细胞核内合成。在复制周期中具有核期的病毒必须具有各种技巧才能允许其 RNA 有效载荷进入。虽然 RNA 不容易运输到细胞中,但蛋白质可以。这是通过称为 importins 的蛋白质网络发生的(参见右侧的图 5-23C)。含有称为核定位序列 (NLS;有 2 种常见序列) 的氨基酸序列的蛋白质能够结合 importins,然后 importins 可以将它们转运穿过核孔复合物,如右图所示。RNA 病毒通常具有不需要进入细胞核的复制周期,但也有一些例外。例如,流感病毒是其基因组与核糖核蛋白相关的 RNA 病毒,这些核糖核蛋白表达核定位信号,促进其基因组 RNA 进入细胞核。另一方面,mRNA 疫苗与任何蛋白质无关。一旦进入胞质溶胶,mRNA 就会裸露出来,并暴露在核糖体和核酸外切酶的恶劣环境中,这些环境会在几个小时(最多)内破坏 mRNA。没有可以想象的机制可以让 mRNA 自发地运输到细胞核中。它由核苷酸组成,不能包含核定位序列。
另一个相关的隔室是线粒体。线粒体实际上是具有自身基因组的退化细菌,人们认为数十亿年前,一个古老的细胞(可能是古细菌 – 细菌的表亲)试图消耗线粒体的祖先,但缺乏实际进行消化的机制,两者建立了共生关系。从那时起,线粒体一直是我们细胞生物学的基本特征。这使得线粒体发育出一个极度缩小的基因组,仅包含 37 个基因(大多数与线粒体功能相关的基因仍在细胞核中)。线粒体有自己的核糖体,甚至有自己的遗传密码(某种程度上)。还有一个用于清除患病线粒体的特殊过程,称为线粒体自噬,这是许多优秀评论的主题,例如 this、this 和 this。
根据我们对这些生物过程的理解,集体得出的结论是,胞质溶胶中裸露的 mRNA 不可能最终进入包含我们自己的 DNA 的细胞区室,这意味着,无论是否存在其他因素,mRNA 疫苗都不会对 DNA 造成伤害。但人们仍然想问我关于逆转录酶的问题,所以让我们讨论一下。
从 RNA 到 DNA 的过程(与分子生物学的中心法则完全相反)被称为逆转录,它是用一种称为逆转录酶的酶(这是一组非常有趣的酶)进行的。一般来说,逆转录由几种不同的遗传实体进行:逆转录病毒、肝病毒、端粒和逆转录转座子。这些都值得定义。
逆转录病毒是具有 RNA 基因组的病毒,它们通过逆转录从中产生 DNA 拷贝,然后整合到宿主细胞的细胞中(我的意思是,从字面上看,将自身插入宿主细胞的基因组并成为它的永久部分,以称为前病毒的序列的形式)。然后,前病毒序列本身可以在宿主细胞中转录,以产生病毒蛋白和颗粒,这些蛋白质和颗粒可以继续扩散到下一个细胞。最著名的逆转录病毒是 HIV-1。
肝病毒是具有间隙基因组的 DNA 病毒(有一条完整的 DNA 链和另一条与前基因组 RNA 相连的部分 DNA 链),与逆转录病毒不同,它不会整合到它们感染的宿主细胞的基因组中。最著名的例子是乙型肝炎病毒,存在多种有效的疫苗。
端粒是存在于人类染色体末端的结构,由一种称为端粒酶的蛋白质复合物维持,该复合物使用一种称为 TERT 的逆转录酶来维持它们。下面将讨论必要的原因。它们正常长约 5-15 kb,缩短会导致细胞生长和复制停滞(衰老),甚至可以通过细胞凋亡引发细胞死亡。

Hartwell L, Goldberg M, Fischer J, Hood L. 遗传学。第 6 版。纽约:麦格劳·希尔;2018. 表 13-2
反转录转座子实际上是我们基因组中最丰富的组成部分。人类基因组包含大约 21,000-27,000 个基因(您获得的数量取决于您定义基因的精确程度以及您查阅的来源),它们跨越 40-4800 万个碱基对,但这仅占 32 亿个总碱基对的 1.5% 左右。反转录转座子约占 20 亿个碱基对。有几种类型的 retroelements,值得进一步讨论:
SINE(短散布核元件)编码 tRNA 等短转录本,没有 LINE 编码的蛋白质就无法发挥作用。
编码由 ORF1 和 pol 基因形成的逆转录酶的 LINE(长散布核元件),可以将自身和其他 LINE 和 SINE 元件复制到基因组的其他区域。
大约 5-8% 的人类基因组也由人类内源性逆转录病毒 HERV 组成,它们也属于反转录转座子的范畴,更具体地说是 LTR(长末端重复序列)反转录转座子(稍后会详细介绍)。HERV 包含 3 个基因:gag(“组抗原”,编码一种多蛋白,该多蛋白被裂解成所得逆转录病毒的结构蛋白)、pol(病毒复制所需的逆转录酶)和 env(包膜,编码赋予病毒颗粒形状的蛋白质)。
更广泛地说,术语逆转录元件是指通过逆转录从基因组的一个区域移动到另一个区域的基因序列,其中包括逆转录转座子和加工的假基因。加工假基因是指缺乏通过逆转录插入的内含子的加工 mRNA 序列(我们知道它们必须通过逆转录插入基因组,这在很大程度上是因为它们缺乏内含子)。他们不能产生任何基因产物。
唯一可以在基因组中移动的反转录转座子(从字面上将其 DNA 复制到最初不存在的新位点)是 LINE 和 SINE,其中只有少数能够做到这一点。HERV 卡在原地,加工后的假基因也是如此。

Linares-Fernández S、Lacroix C、Exposito JY、Verrier B. 定制 mRNA 疫苗以平衡先天性/适应性免疫反应。分子医学趋势。2020;26(3):311–323.图 2 mRNA 疫苗序列的基本组织

Zhang Q, Kim NK, Feigon J. 人类端粒酶 RNA 的结构。美利坚合众国国家科学院院刊。2011;108(51):20325–20332.图 1

Hartwell L, Goldberg M, Fischer J, Hood L. 遗传学。第 6 版。纽约:麦格劳·希尔;2018. 图 12.20 显示了端粒酶产生端粒的机制。RNA 引物
端粒酶是作为末端复制问题的解决方案而进化的。新生(新)DNA 链是用一条前导链和一条滞后链合成的,因为 DNA 聚合酶的方向性非常有限,因为它们必须相对于模板链行进 3′ 到 5’。这会产生一个问题,因为 DNA 的方向是反平行的(链是平行的,但一条链的方向与另一条链相反),因此要同时制造两条链,单个 DNA 聚合酶必须设法同时向相反的方向移动西西弗斯长度(成像尝试同时向东和向西运行 10 英里)。为了解决这个难题,其中一条链被合成为前导链,其中聚合酶在许多核苷酸中不间断地沿着链移动(正式术语是“进行性地”),以及一条滞后链,其中 DNA 片段(称为冈崎片段)持续产生,这些片段与连接(融合)在一起的另一条链互补。困境在于,因为我们的染色体不是圆形的,所以一旦我们到达染色体的 3′ 端,总会有一个缺失的片段,因此 DNA 的每个复制周期都会导致基因组的大小缩小,最终有可能击中对生物功能很重要的基因。这称为末端复制问题。
在您的右侧,您可以看到一个端粒酶复合物及其最喜欢的端粒酶 RNA。染色体的末端包含称为端粒的结构,这些结构是重复的、短的、回文序列,被多次复制,直到链之间的间隙被填满约 5000 到 15000 个核苷酸的长度。端粒 DNA 的产生是通过一种称为端粒酶的大型蛋白质复合物发生的,它利用 TERT(端粒酶逆转录酶),这是一种逆转录酶,需要 RNA 模板来制造回文 DNA 序列。重要的是,细胞最终确实会失去其端粒酶功能,这被认为代表了对癌症的保护措施(高水平表达端粒酶的细胞可以继续分裂并因此积累突变,其中一些可能是有害的,无限期,因此在大多数细胞中,经过大约 50 次分裂后,细胞将停止分裂;端粒酶在干细胞中显着高水平表达)。在实践中,没有功能性端粒酶的小鼠会在 3 代内出现明显的染色体缩短,到第 4 代最终无法繁殖。现在,我必须粉碎你对 RNA 工作原理的所有先入为主的想法。当谈到 DNA 和 RNA 时,我们倾向于使用“链”一词,它会让人联想到线的形象。螺纹相对线性,它可能会弯曲,但结构相对枯燥。这是大多数 DNA 的合理近似值,因为 DNA 基本上可以具有 3 种结构中的一种,称为 A、B 和 Z(尽管有更罕见的结构,例如 i 基序,而 DNA 酶可以做奇怪的事情)。另一方面,RNA 在结构方面是一种更自由的精神。RNA 折叠成具有各种结构基序的复杂形状,其方式与蛋白质没有什么不同,因为蛋白质的结构与其功能直接相关。这意味着:特定的 RNA 根据它们的折叠方式做特定的事情,这取决于它们的序列。在您的右侧,您可以看到与端粒酶复合物结合的端粒酶 RNA 的详细图表。那个带有梯子和气泡等条形的弯曲物是端粒酶 RNA。TERT 是端粒酶的逆转录酶,在核心结构域和称为 CR4/CR5 的区域结合端粒酶 RNA。我不会深入讨论该综合体的其他组成部分,但您可以在此处和此处详细了解其工作原理。在右图的正下方,您可以看到端粒酶如何借助重复的回文 RNA 序列来延长染色体的 3′ 帽:CAAUCCCAAUC,它在 DNA 上复制重复的“GGGTTA”,形成长度约为 5,000-15,000 个核苷酸的端粒。要做到这一点,必须做很多事情,但仅仅为了让 TERT 能够识别端粒酶 RNA,就需要有:逆转录模板(回文序列 CCCAAU)、假结结构域(图中的核心结构域)、与 TERT 相互作用的茎环 (CR4/CR5) 和 RNA 稳定性所需的 3′ 元件 (CR7)。这是一组非常具体的限制条件,mRNA 疫苗必须设计为具有这些限制条件(参见上图 mRNA 疫苗的标准组织)。核糖体还具有内在的 mRNA 解旋酶活性,可破坏这些结构,以便它们可以被读取和处理以合成蛋白质。此外,成熟的人端粒酶 RNA 长度为 451 个核苷酸。这些疫苗的 mRNA 太大,无法在人类中用作端粒酶 RNA(有些动物具有这种大小的端粒酶 RNA,但我们不是其中之一),并且考虑到端粒酶 RNA 必须折叠的精度,它不太可能呈现识别和结合端粒酶所需的结构。

Flint S, Racaniello V, Rall G, Skalka A, Enquist L. 病毒学原理。华盛顿特区:ASM Press;2015. 图 7.2
我最初考虑详细讨论肝炎病毒(即乙型肝炎)和逆转录病毒(即 HIV 和 HERV)的逆转录酶,但很快就无法进行讨论。可以说,逆转录酶不能拾取任何随机 RNA 并从中生成 DNA。它们需要一个 RNA 序列来引发反应。对于逆转录病毒,有一种 tRNA 从宿主细胞中被盗并包装到病毒粒子中。此外,在逆转录病毒中,逆转录发生在核衣壳内,它允许 dNTP(DNA 的组成部分)进入,但不允许像编码刺突 RBD(在 Moderna 疫苗的情况下)或整个刺突(在辉瑞疫苗的情况下)的完全独立的 RNA 分子一样大的东西。hepadnaviruses 的逆转录原理相似,需要一个与 hepadnavirus 的 DNA 化学连接的前基因组 RNA 片段。逆转录不会随便任何 RNA 自发发生。即使对于 RT-PCR 反应,该反应也需要寡脱氧胸苷序列与相关 mRNA 的 polyA 尾结合。此外,这里还有一个次要要求,即能够 “改变” 宿主的 DNA:以某种方式实际纵它。就肝病毒而言,这并没有真正发生。肝病毒基因组进入细胞核,形成一个共价闭合的环状 DNA,其自身的相关组蛋白本质上是一个小的、独立的染色体。它不会触及宿主的 DNA。在逆转录病毒的情况下,DNA 被整合到宿主染色体中,其效果取决于它被整合到的位置。例如,HIV 对将自身插入基因有很强的偏见,例如,如果该基因产生对维持基因组完整性很重要的蛋白质(如果不加以控制,可能会导致癌症),这可能会有问题。然而,从这样的过程发展为癌症,不可能在没有许多其他事情出错的情况下发生,例如辅助性 T 细胞的大量死亡,严重损害免疫系统对细胞进行监测以寻找恶性肿瘤证据并杀死它们的能力,就像 HIV 一样。现在,如果我们选择忽略迄今为止关于细胞生物学如何工作的所有内容,包括需要引物来启动逆转录酶反应,并允许逆转录病毒很容易允许将产生的刺突蛋白 RBD 或刺突基因整合到宿主中,这只会导致插入一个可能能够制造刺突蛋白 RBD 或整个刺突蛋白的基因(取决于它的插入位置以及它是否可以募集转录机制),这只会向免疫系统呈递一种外来蛋白质,它已经准备好对这种蛋白质做出反应,然后杀死细胞。此外,由于它们是通过肌肉注射输送的,因此有问题的细胞很可能是肌肉细胞(您可以失去而不会失去任何雄辩的功能)或树突状细胞(您也可以在不损失任何显着免疫功能的情况下失去)。
总而言之,我真的希望到此结束:
没有可行的方法可以让 mRNA 疫苗最终进入细胞核,也无法引发逆转录反应,也不会给您带来线粒体疾病。
根据我们对细胞生物学、逆转录酶、人类遗传学和免疫系统的全面了解,mRNA 疫苗没有合理的可能性会影响您的 DNA。
我们应该等待详细的安全数据,但是,先验地,编码 SARS-CoV-2 刺突蛋白 RBD 的 RNA 片段,甚至是没有复制潜力、没有形成整个病毒的能力,甚至没有形成整个刺突蛋白的全部能力的整个刺突蛋白,应该预期是一种安全的疫苗,不会引起这些疯狂的天上掉馅饼的科幻场景。
如果您担心 mRNA 疫苗,那就不要接种。数据表明,很快也会有其他种类的疫苗具有良好的疗效。然而,我满足于为其中之一卷起袖子。
无与伦比的 Vincent Racaniello 教授创作了这个壮观的动画,它为那些可能感兴趣的人精确地展示了像 HIV 这样的逆转录病毒是如何复制的。
引用
Hartwell L, Goldberg M, Fischer J, Hood L. 遗传学。第 6 版。纽约:麦格劳·希尔;2018.
Lodish H, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H, Amon A, Martin K. 分子细胞生物学。第 8 版。纽约:W.H. Freeman;2016
Flint S, Racaniello V, Rall G, Skalka A, Enquist L. 病毒学原理。华盛顿特区:ASM Press;2015.
Blanco, E., Shen, H. & Ferrari, M. 克服药物输送生物障碍的纳米颗粒设计原理。国家生物技术 33, 941–951 (2015)。https://doi.org/10.1038/nbt.3330
Palikaras, K., Lionaki, E. & Tavernarakis, N. 细胞稳态、生理学和病理学中的线粒体自噬机制。Nat 细胞生物学 20, 1013–1022 (2018)。https://doi.org/10.1038/s41556-018-0176-2
Zhang Q, Kim NK, Feigon J. 人类端粒酶 RNA 的结构。美利坚合众国国家科学院院刊。2011;108(51):20325–20332.
阿克曼 DG,费根森 GW。脂质双层:簇、结构域和相。生物化学论文。2015;57:33–42.
张 J, Shrivastava S, 克利夫兰 RO, 拉比茨 TH.脂质-mRNA 纳米颗粒旨在增强由冲击波介导的细胞内递送。ACS 应用材料和接口。2019;11(11):10481–10491.
Hafez IM、Maurer N、Cullis PR。关于阳离子脂质促进多核酸细胞内递送的机制。基因治疗。2001;8(15):1188–1196.
Hassett KJ、Benenato KE、Jacquinet E、Lee A、Woods A、Yuzhakov O、Himansu S、Deterling J、Geilich BM、Ketova T 等人。用于 mRNA 疫苗肌肉注射的脂质纳米颗粒的优化。分子疗法。核酸。2019;15:1–11.
Maruggi G, Zhang C, Li J, Ulmer JB, Yu D. MRNA 作为疫苗开发控制传染病的变革性技术。分子疗法:美国基因治疗学会杂志。2019;27(4):757–772.
Linares-Fernández S、Lacroix C、Exposito JY、Verrier B. 定制 mRNA 疫苗以平衡先天性/适应性免疫反应。分子医学趋势。2020;26(3):311–323.
Kowalski PS、Rudra A、Miao L、Anderson DG。传递信使:治疗性 mRNA 递送技术的进步。分子疗法:美国基因治疗学会杂志。2019;27(4):710–728.
Rauch J, JANOFFt AS.用于体内非双层脂质相的免疫识别。Pnas.org。https://www.pnas.org/content/pnas/87/11/4112.full.pdf
Pickles S, Vigié P, Youle RJ.线粒体维持中的线粒体自噬和质量控制机制。当前生物学:CB。2018;28(4):R170–R185。
古奇 JW。转移 RNA (tRNA)。收录于:聚合物百科全书词典。纽约州纽约市:Springer New York;2011. 第 929-929 页。
Alston CL、Rocha MC、Lax NZ、Turnbull DM、Taylor RW。线粒体疾病的遗传学和病理学。病理学杂志。2017;241(2):236–250.
Huet S, Avilov SV, Ferbitz L, Daigle N, Cusack S, Ellenberg J. 通过荧光互相关光谱在活细胞中研究甲型流感病毒 RNA 聚合酶的核输入和组装。病毒学杂志。2010;84(3):1254–1264.
人类端粒酶:生物发生、运输、招募和激活。基因与发育。2015;29(11):1095–1105.
生物技术革命:PCR 和克隆表达基因。Nature.com。https://www.nature.com/scitable/topicpage/the-biotechnology-revolution-pcr-and-the-use-553/
Šponer J, Bussi G, Krepl M, Banáš P, Bottaro S, Cunha RA, Gil-Ley A, Pinamonti G, Poblete S, Jurečka P, et al. 分子模拟捕获的 RNA 结构动力学:全面概述。化学评论。2018;118(8):4177–4338.
核糖体的 mRNA 解旋酶活性 Takyar S、Hickerson RP、Noller HF。细胞。2005;120(1):49–58.
Hits: 27
