Knife’s edge: Balancing immunogenicity and reactogenicity in mRNA vaccines
实验和分子医学 卷 55, 页1305–1313 (2023)
摘要
自从信使RNA (mRNA)被发现以来,人们已经付出了巨大的努力来开发治疗和疫苗。在新冠肺炎疫情期间,两种mRNA疫苗在破纪录的时间内被开发和批准,彻底改变了疫苗开发的前景。虽然第一代新冠肺炎mRNA疫苗已证明有超过90%的效力,并且在体液和细胞介导的免疫反应中具有强免疫原性,但与长寿命疫苗(如黄热病疫苗)相比,它们的持久性滞后。尽管世界范围内的疫苗接种运动挽救了数千万人的生命,但从轻度反应原性到罕见的严重疾病的副作用都有报道。这篇综述提供了主要针对新冠肺炎mRNA疫苗的免疫应答和不良反应的概述和机理见解。此外,我们讨论了这个有前途的疫苗平台的前景和平衡免疫原性和副作用的挑战。
其他人正在查看类似的内容
介绍
100多年来,公共疫苗接种运动一直是我们预防人类传染病的最成功手段。实施预防性疫苗接种是为了延长预期寿命和改善公共健康,从而拯救无数生命1,2。然而,尽管疫苗技术在过去一个世纪取得了显著进步3随着我们对与保护性免疫相关的细胞成分的理解的快速进步,“最佳”疫苗的概念化变得更加复杂。传统疫苗对难以靶向和抗原可变的病毒,如人类免疫缺陷病毒(HIV)和丙型肝炎病毒(HCV)经常失败4由于病毒基因组的发展过程和快速突变需要时间,一些传统疫苗技术不太适合威胁全球健康和安全的突发疫情,如最近的冠状病毒疾病(新冠肺炎)疫情。考虑到这些限制,信使RNA (mRNA)疫苗由于其无细胞、快速和可扩展的开发和生产而成为传统疫苗的有吸引力的替代物5.
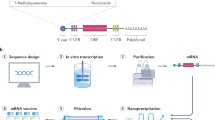
由于mRNA疫苗技术能够引发有效的T细胞反应,耐受性良好,并适合个性化设计,因此已被广泛研究用于癌症治疗。基于mRNA的癌症疫苗开发的细节在最近的综述中有全面的描述6,7,8。然而,是新冠肺炎·疫情激发了人们对mRNA医学应用的兴趣,导致了两种mRNA疫苗的快速批准9,10,与其他几个处于不同发展阶段或临床试验11。新型冠状病毒疫苗推出的前所未有的速度之所以能够实现,仅仅是因为mRNA疫苗平台的独特性质。对于目前的新冠肺炎mRNA疫苗,在抗原性mRNA的有效递送和表达方面已经取得了巨大的进步。诸如N1-甲基假哌啶、5’加帽和密码子优化的修饰已被用于优化mRNA的生产以最大化抗原的可用性12,13。为了能够将mRNA有效地递送到靶细胞的胞质溶胶中,已经使用了由可电离的阳离子脂质、胆固醇、磷脂和聚乙二醇(PEG)组成的脂质纳米颗粒(LNPs)。LNP-mRNA复合物在生理pH值下是中性的,但当LNP在内体中被隔离和酸化时,它会带正电荷;这个过程之后是与核内体膜的融合和mRNA释放到胞质溶胶中13,14,15。仅由工程LNP包裹的修饰mRNA组成16这种方法消除了减毒或灭活/裂解疫苗(如脊髓灰质炎疫苗)所需的大量病原体培养工作17或者流感疫苗18。全新的DNA模板合成和基础分子生物学繁殖使这项技术大大超过了基于蛋白质亚单位的方法,从而产生了灵活、经济高效的平台,能够快速部署到一线以改善公共卫生19.
新冠肺炎疫情允许对mRNA疫苗的强大潜力进行实时评估,以快速重塑一种致命的新兴传染病的世界格局。第一代新型冠状病毒疫苗是在全长的原型株刺突蛋白序列发表后的几周内完全设计出来的20并在病毒鉴定后的4个月内进入第一阶段临床试验21。尽管开发速度很快,设计优化的机会有限,但由此产生的疫苗在三期试验中表现令人钦佩,最初报道的通过引发中和抗体的大量产生和适度的T细胞反应来预防一般疾病的效率为94-95%,从而使它们成为有史以来最成功的疫苗之一22。由此产生的疫苗的快速生产和分发在疫苗上市的第一年估计防止了1440万人死亡23.
尽管mRNA疫苗具有快速应对疫情疫情的功能,但仍有报道称其存在各种副作用,从相对常见的局部反应原性到罕见的严重疾病后果。该综述总结了目前对mRNA疫苗诱导的免疫刺激和不良事件之间的平衡的理解,并推测了利用这种有前途的疫苗技术开发更有效和更安全的疫苗的未来方向。
mRNA疫苗诱导的免疫应答及其作用机制
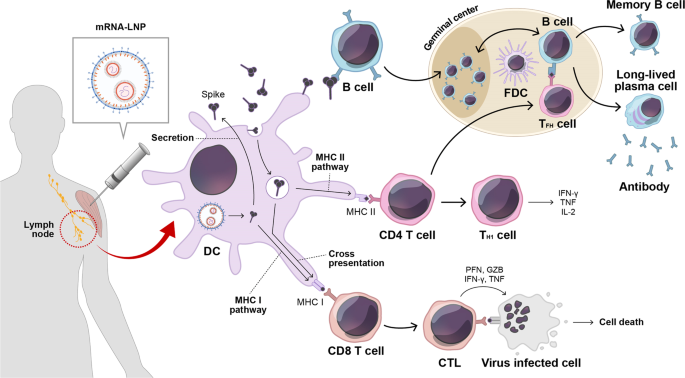
最近,Pfizer/BioNTech和Moderna批准的新冠肺炎mRNA疫苗采用了类似的技术途径,即利用编码核苷修饰的预融合形式的刺突抗原(S-2P)的抗原性mRNA,包装在可电离的阳离子LNP中用于递送。两种制剂都在动物模型和人类疫苗中强烈诱导了保护性免疫13。由新冠肺炎mRNA触发的免疫反应的特征在于强烈产生刺突结合和中和抗体,以及中等水平的T细胞反应(图。1).值得注意的是,在第一次接种后,观察到中度的先天免疫反应,包括抗病毒和干扰素反应,而在加强免疫后,观察到更广泛和更强烈的炎症反应,如炎性单核细胞和IFN-γ的急剧增加24.
尽管在整个疫情获得了mRNA疫苗效力的明确证据9,25挑战依然存在。低效的B细胞靶向性继续阻碍广泛中和新型冠状病毒疫苗接种的努力26就像艾滋病病毒一样27和流感28。对与短期效应子和长期记忆群体中的B细胞激活和发育偏差相关的独立途径的表征,激发了人们对这些途径的不同激活如何有助于疫苗效力的兴趣29,瞄准30和反应原性31。此外,在疫苗诱导的保护中,特别是在粘膜部位,将强烈刺激的体液反应与有效的T细胞介导的免疫(已知在产生初级免疫反应中是至关重要的)整合仍是目前无法实现的目标32。为了应对这些挑战,至关重要的是充分了解mRNA疫苗免疫应答的潜在机制,以在不断扩大的基于mRNA的治疗领域发挥最大功效。
抗体产生和靶向
新型冠状病毒mRNA疫苗诱导的中和抗体是防止感染和严重新冠肺炎结果的主要相关因素。尽管在刺激针对新型冠状病毒刺突蛋白的强抗体滴度方面取得了广泛的成功33,加上针对受体结合结构域(RBD)的强中和反应性34第一代mRNA疫苗不足以维持广泛的保护作用。事实上,针对快速变异RNA病毒的固定毒株疫苗的局限性是显而易见的。在功效测试期间,新型冠状病毒阿尔法毒株(B.1.1.7)在南非的出现以及由此导致的功效下降几乎立即引发了一个危险信号,即RBD一级结构的微小改变可能会妨碍疫苗的整体功效35。这些担心随着Omicron亚变异体的出现而得到证实,该亚变异体现在拥有大量修饰的RBD,与原型株靶向mRNA疫苗应答相比,其导致中和能力降低30倍36.
虽然不幸的是,这种对新出现的病毒变体的反应性的丧失并不是完全出乎意料的。尽管通过更新的疫苗平台(最近是基于mRNA的平台)在引发抗体滴度方面有了显著的改进,但是仍然缺乏将体内反应导向预期抗原表位的能力37。因此,尽管目前的mRNA疫苗平台显示出引发强大体液反应的强大能力,但科学家在决定表位靶向的B细胞选择过程中仍然是被动的观察者。针对不期望的但免疫显性表位的反应性可能会继续挑战跨毒株保护性免疫的发展,这已在先前调查HIV和流感的研究中显示27,28.
mRNA疫苗设计的灵活性,加上B细胞表位选择基础科学的新进展,提供了令人兴奋的新途径。特别是,在B细胞选择中一个新的支配原则——稀有表位抑制的确定,可能提供了一个独特的机会与mRNA疫苗一起产生针对表位的反应38。通过在单一疫苗剂量内使抗原种类多样化,应答的B细胞被置于相互竞争共享的T细胞池中。因此,mRNA种类可以是多样化的,使得可能提供针对多种变体的交叉保护的来自保守区域的表位可以比菌株特异性反应更重要。尽管仍处于早期测试阶段,但副表位聚焦已被间接证明是一种开发嵌合纳米颗粒的可行方法,这种纳米颗粒整合了多种流感血凝素,从而增加了普遍的交叉反应性39。mRNA疫苗接种的多价方法目前正在研究中,目前可用的二价新型冠状病毒“更新”疫苗加强剂是概念的重要证明40.
B细胞活化和记忆发展
除了在B细胞选择和表位靶向方面的挑战,应答持久性已经成为针对新型冠状病毒的mRNA疫苗接种努力中的主要关注点33。虽然早期结果表明,在最初的2剂系列后,形成了显著和持久的抗原特异性B细胞记忆,但对最初接种疫苗的患者队列的分析表明,循环抗体反应显著下降,抗刺突蛋白IgG半衰期为30天41。结果是疫苗效力逐渐减弱42,最终导致提议和推荐额外的加强剂量以维持抗病毒滴度和宿主保护43。虽然这种三剂系列在亚单位疫苗中并不少见,但第一代mRNA疫苗的持久性与具有类似初始效力的历史疫苗(如脊髓灰质炎和牛痘疫苗)不匹配,已知这些疫苗的滴度可持续数十年而无需额外的加强剂量44.
这也许并不奇怪,因为B细胞反应的复杂性导致了终生体液免疫的产生。虽然已经将许多焦点放在被认为主要负责疫苗接种反应发展的传统生发中心(GC)反应上45初级免疫反应的一个重要的新特征,特别是在高炎症环境中出现的,是强调滤泡外(EF) B细胞途径46。最初,在小鼠感染模型中鉴定47和人类自身免疫性疾病48新冠肺炎疫情已经证实这种途径是早期体液免疫的重要组成部分,在严重疾病患者中尤为重要。与以GC为中心的应答形成鲜明对比的是,EF应答经历较少的躯体超突变,尽管针对外源抗原进行了良好的选择,但在感染后的持续免疫记忆数月或数年中,它们不太经常被识别,尽管需要在疫苗接种的背景下进行评估49。对这一途径的鉴定和表征表明,最初的体液反应不足以产生目标明确、持久的记忆反应。事实上,近年来越来越清楚的是,即使产生完全功能的浆细胞也不足以进行长期骨髓移植,因为这些细胞的进一步成熟似乎是必需的,并取决于未知的参数50.
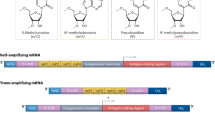
这种在疫苗接种过程中仔细调节B细胞反应的需要导致了对通过疫苗佐剂递送的传染性微环境的模拟的重要研究51。现在已经很好地确定,精心选择的微生物相关分子模式和危险信号的组合可以极大地影响先天免疫激活和下游体液免疫52,53,54。然而,由于mRNA和LNPs的内在佐剂特性,mRNA疫苗平台的独特特性在某种程度上颠覆了这些研究领域。虽然以前的亚单位疫苗显示强烈依赖Toll样受体(TLR)信号和细胞死亡途径来驱动足够的反应性,但对mRNA疫苗的体液反应性可能与这些因素不密切相关,因为MyD88途径部分负责最佳抗体和B细胞反应55,56。除了MyD88,在小鼠中的功能研究已经确定了抗病毒途径,特别是由RIG-I样受体黑色素瘤分化相关蛋白5 (MDA5)控制的途径,作为发展体液免疫的额外介质55。由于这些系统是I型干扰素依赖性和dsRNA反应性的,因此很容易发现这些反应和“天然”抗病毒免疫之间的联系。值得注意的是,具有可电离脂质的LNP制剂可以强烈诱导促炎细胞因子IL-6,其反过来有助于有效的体液免疫56。然而,与长期持续的抗病毒应答相比,第一代应答缺乏持久性,这表明需要额外的因素。使用自我复制的mRNA载体,一种mRNA疫苗接种平台独有的方法,在继续推动疫苗接种微环境向真正的病毒感染模拟方向发展方面具有很高的兴趣57.
尽管有理由对创新疫苗设计继续推动病毒感染模拟的边缘感到兴奋,但同样清楚的是,将炎症信号引入疫苗设计必须仔细平衡耐受性。现在清楚的是,EF反应途径的过度刺激——一个依赖于高TLR7信号并与IFN-γ诱导的细胞因子环境相关的过程——不仅导致短期体液反应,而且导致能够靶向自身组织的交叉反应抗体的出现49。因此,很明显,在第二代mRNA平台及其以后的概念化和设计中,局部和仔细调节的炎症信号与全身反应原性之间的平衡是非常复杂和关键的。
新冠肺炎mRNA疫苗的T细胞免疫
有效的体液免疫反应,如疫苗接种后中和抗体的产生,被认为提供了针对病毒病原体的保护性免疫。然而,在微调B细胞活化和分化以及清除病毒感染细胞方面,高质量的T细胞反应是最佳疫苗效力所必需的58,59,60。对于预防性新冠肺炎疫苗,高滴度的刺突结合中和抗体与保护性结果密切相关36,55,61。然而,在某些情况下,T细胞反应也与保护免受新型冠状病毒病毒感染有关。例如,在康复期恒河猴中,CD8 T细胞的减少削弱了它们对随后攻击的保护性免疫62。此外,无丙种球蛋白血症患者或接受靶向抗CD20免疫疗法的个体从新冠肺炎中简单恢复,以及T细胞对病毒变异体的保留和持久反应性,表明T细胞免疫在新型冠状病毒保护中起作用63,64,65.
与传统疫苗技术(包括依赖于细胞外抗原捕获的灭活疫苗和蛋白亚单位疫苗)相比,当前新冠肺炎mRNA疫苗的LNPs能够将mRNA释放到靶细胞的胞质溶胶中,并在细胞内产生刺突蛋白,类似于病毒感染的情况13。刺突抗原的细胞内产生促进抗原衍生肽在I类MHC上的经典装载,并刺激CD8 T细胞的活化,而分泌的抗原可被内吞并通过抗原呈递细胞中的II类MHC呈递,并诱导CD4 T细胞应答。
滤泡助手T (TFH)细胞和辅助性T细胞1 (TH1)细胞偏好
在CD4 T细胞亚群中,TFH细胞是专门支持GC反应的,在GC反应中,活化的B细胞经历大量的增殖和选择。此外,它们促进记忆B和长寿浆细胞的分化,并通过同种型转换和B细胞受体的亲和力成熟提高抗体质量66。在GC反应过程中,TFH细胞通过识别B细胞表面的II类MHC上存在的相关肽与B细胞相互作用,并通过提供共刺激分子和细胞因子如IL-21来促进抗原特异性B细胞的扩增和存活66,67。以前对mRNA疫苗的评估表明,这种疫苗可以引发有效的TFH细胞反应显示出TH1和TH2在小鼠和非人灵长类动物的细胞68,69。从机制上讲,MyD88途径是mRNA疫苗诱导的有效T细胞所必需的。TFH令人感兴趣的是,LNP还作为一种内在的佐剂来支持正常的TFH和GC B细胞反应56。新冠肺炎mRNA疫苗,如BNT162b2和mRNA-1273,也能产生有效的TFH恒河猴CD40L和IL-21表达的细胞反应70,71。值得注意的是,新冠肺炎mRNA疫苗诱导了更高水平的TFH细胞比乳剂佐剂RBD疫苗72.
除了TFH细胞,CD4 T细胞被有效地激活并分化成效应T细胞氕棘波衍生肽再刺激后的反应和分泌IFN-γ、TNF-α和IL-2。用新冠肺炎mRNA疫苗进行一次免疫导致了TH1-小鼠中偏斜的多功能CD4 T细胞73。在非人灵长类动物中,施用BNT162b2和mRNA-1273后,观察到有效的IFN-γ和最小的IL-4产生70,71。TH1在几项人类mRNA疫苗研究中也证实了-偏向性CD4 T细胞表型74,75,76,77,这与它在对抗细胞内病原体的应答中的假定作用一致。有趣的是,TH2在针对其他呼吸道病毒感染的疫苗中,应答极化与疫苗相关的呼吸道疾病免疫增强有关78。上述证据表明,新冠肺炎mRNA疫苗导致理想的TH新型冠状病毒感染后的细胞反应。
CD8 T细胞反应的调节
由于靶细胞中的细胞内抗原表达和在基于mRNA的癌症免疫疗法开发中的临床前和临床试验的丰富记录,通过mRNA疫苗平台建立CD8 T细胞应答是另一个相关方面,其中溶细胞T淋巴细胞(CTL)活性是关键6,19。最初,关于CD8 T细胞对新冠肺炎mRNA疫苗的反应有不同的证据,其中在BNT162b2免疫的恒河猴和人类中观察到可检测的刺突蛋白特异性CD8 T细胞反应。然而,在恒河猴和人的mRNA-1273疫苗接种后,观察到低CD8 T细胞应答70,71。然而,最近的研究直接比较了两种批准的mRNA疫苗,并证明了在人类中类似的峰特异性CD8 T细胞的诱导65,79。值得注意的是,在小鼠模型中的一项机理研究揭示,BNT162b2诱导的CD8 T细胞反应是通过经典的MHC I呈递来传递的,至少是部分传递的,因为CD8 T细胞反应在交叉呈递缺陷型Batf3敲除小鼠中没有被完全消除55。重要的是,胞质RNA识别受体之一MDA5和随后的I型IFN信号对于BNT162b2疫苗接种后的刺突蛋白特异性CTL反应是必需的55.
mRNA疫苗的不良事件
已经开发了各种针对新型冠状病毒的疫苗,并且比较了它们的功效;mRNA疫苗的有效性优于从先前存在的技术中获得的疫苗。然而,随着有效性的提高,需要仔细评估不良反应,以便更安全地使用和改进当前的疫苗。最近,自然杀伤(NK)/单核细胞亚群、树突细胞(DC)亚群和NK T样细胞已被证明与mRNA疫苗效应(增加中和抗体滴度)和副作用有关80。此外,这些细胞与IFN-γ诱导的趋化因子的增加有关。这些结果表明,mRNA诱导的高疫苗效力可能与几种副作用密切相关,维持两种相反反应的适当平衡对于开发合适的疫苗至关重要。在这里,我们总结了mRNA疫苗诱导的副作用及其潜在机制。
局部和全身反应原性
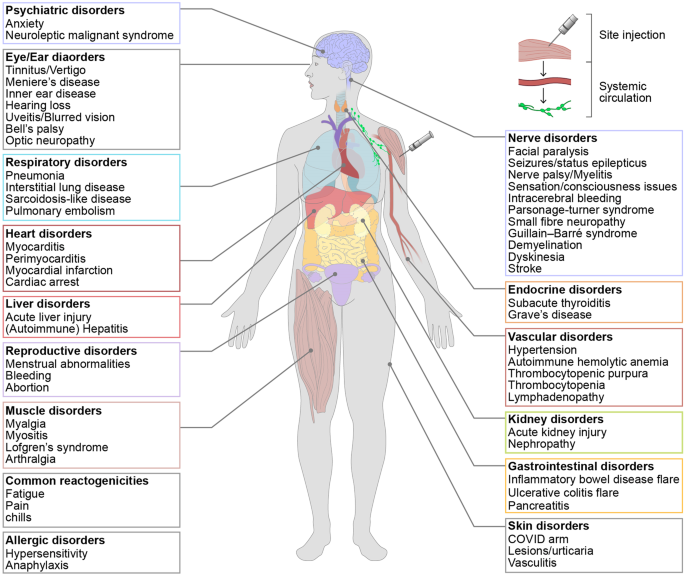
在新冠肺炎mRNA疫苗的早期临床试验中,局部副作用和症状,如肿胀、发红、疼痛和发热,在疫苗患者中比在接受安慰剂的患者中更常见。接种疫苗一周内,最常见的局部反应之一是注射部位疼痛81,82。全身副作用,如疲劳、头痛、发热、肌痛和关节痛,在施用mRNA疫苗后也比接受安慰剂的更常见。此外,据报道,在年轻疫苗接种者(16/55岁)中观察到的系统性副作用比年长的疫苗接种者(> 55岁)更为常见。较高的全身反应原性可能意味着年轻人群的免疫反应比老年人群更强。与第一剂相比,第二剂疫苗与更严重的副作用相关,如疲劳和头痛9,10.
严重不良事件
最近的一份报告显示,虽然结果是初步的,有几个局限性,但0.125%的mRNA疫苗接种个体显示出严重的不良反应,包括急性心肌梗死、贝尔麻痹、脑静脉窦血栓形成、格林-巴利综合征、心肌炎/心包炎(大多发生在较年轻的年龄)、肺栓塞、中风、血栓形成伴血小板减少综合征、淋巴结病、阑尾炎、带状疱疹复发、神经系统并发症和自身免疫83.
过敏反应是一种严重的不良反应,需要立即就医。根据最近的一份报告,大约1:200,000的受试者因辉瑞/BioNTech疫苗而出现过敏反应10。最近,接受Moderna或辉瑞/BioNTech疫苗后,过敏反应的发生率估计为百万分之2-11例84。大多数疫苗的接种率低于百万分之一。尽管PEG被认为是过敏反应的潜在致病因子,但致病抗原和相关机制仍在研究中81,85,86。心肌炎和心包炎也是mRNA疫苗接种的严重不良反应,尽管发生率极低(0.005%)87。常见轻度和重度不良反应和潜在并发症的总结见图。2.
mRNA疫苗相关的危险因素和细胞毒性机制
mRNA疫苗的安全性至少部分来源于制剂中包含的脂质和mRNA组分的耐受性。以前已经证明脂质在疫苗给药后诱导宿主免疫反应,并且通过补体介导的机制对基于PEG的纳米颗粒的重复给药的反应性可能对安全性和功效特征产生负面影响88。另一个安全问题是体外转录物(IVT) mRNA的免疫原性,尽管对于适当的疫苗接种来说,刺激细胞和体液免疫具有潜在的优势89,90,91.
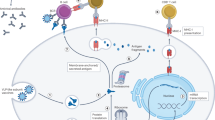
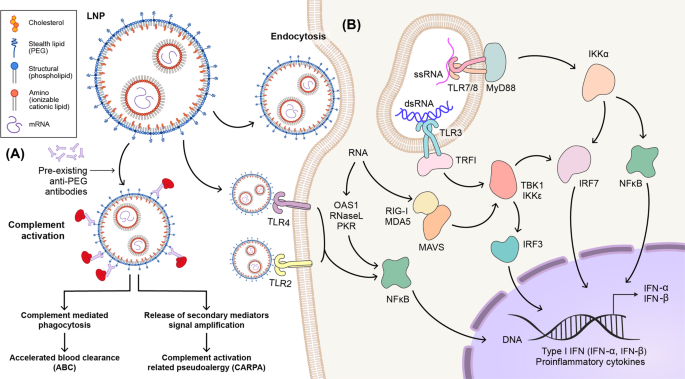
由于mRNA疫苗使用单链RNA,预计免疫反应将通过TLR7/8被诱导。然而,最近的报道表明,mRNA疫苗通过MDA5而不是TLR7和促炎细胞因子如IL-1β和IL-6产生I型干扰素(IFN-I)55,56。这些诱导的IFN-I和促炎细胞因子具有刺激免疫反应和提高疫苗效力的益处,然而它们也可能诱导免疫副作用。同时,当LNP成分之一PEG与体内已经存在的抗PEG抗体相互作用时,补体系统被激活。然而,仅仅假设补体介导的吞噬作用可能引起副作用,如快速血液清除和补体激活相关的假过敏(CARPA)92。在本节中,我们回顾了由LNPs和mRNA组成的mRNA疫苗的潜在风险因素。图2描述了一系列不良事件及其相关机制。3.
ALNP诱导的免疫激活。包封在由可离子化阳离子脂质、辅助脂质、胆固醇和PEG组成的LNP制剂中的mRNA的结构示意图。LNPs可以通过刺激Toll样受体(TLR) 2和TLR4并导致NF-kB活化和细胞因子分泌来诱导免疫活化。预先存在的抗PEG抗体可导致补体激活和随后的补体介导的现象,如ABC或CARPA。B免疫细胞通过胞吞作用摄取LNP包裹的mRNA。在内体中,TLR7/8和TLR3分别识别ssRNA和dsRNA,这些受体激活含白细胞介素-1结构域的接头诱导干扰素(TRIF)中的MyD88和TLR3。最终,相关的信号级联转导到细胞核,在那里转录因子(NF-kB、IRF3和IRF7)促进I型IFN和促炎细胞因子的产生。内体逃逸用于将少量的mRNA和IVT反应副产物转运到细胞质中。这些RNA被RIG-1和MDA5识别,然后两条信号通路激活炎症基因表达的转录因子。
LNP
LNP的免疫原性
LNP的物理和化学性质,如其形状和电荷,会影响其与免疫系统的相互作用。先前的一项研究表明,LNP作为一种内置的佐剂,可以激发有效的抗原特异性CD4+ TFH不依赖于MAVS介导的RNA感应途径,通过诱导IL-6产生的细胞和GC B细胞反应93。强免疫原性通常是导致局部和全身炎症的反应原性(甚至毒性)的原因。因此,为了确保mRNA疫苗的有效性和安全性,理解佐剂(如脂质成分)促进免疫系统的分子机制是重要的94。最近的几项研究表明,含有可电离脂质的LNP可触发促炎细胞因子,包括IL-1β和IL-6,以及随后的抗体和T细胞反应56,95。此外,补体系统和TLRs可能参与先天免疫系统的激活90.
LNP的成分和毒性
LNP是一种多组分脂质系统,由阳离子/可电离脂质、胆固醇、辅助脂质和PEG-脂质等组成。到目前为止,一些研究已经调查了LNP的结构-活性关系以及LNP通过其颗粒大小、电荷、疏水性、组分摩尔分数和表面化学与免疫系统相互作用的机制96,97。LNPs可在体内引起各种免疫效应,包括免疫细胞激活、炎症、适应性免疫反应和补体激活,以及CARPA,这取决于它们的性质和递送方法98,99,100.
阳离子/可电离脂质
阳离子脂质,例如1,2-二-O-十八烯基-3-三甲基铵-丙烷(DOTMA)101或1,2-二油酰-3-三甲基铵-丙烷(DOTAP ),在最早的脂质体递送系统中用于促进mRNA的包封102。已经证明基于阳离子的mRNA递送系统与体外和体内的先天免疫反应相关103,104。阳离子脂质纳米载体由于其小的尺寸和电特性,在抗原呈递细胞如树突状细胞和巨噬细胞上诱导TLR2和TLR4蛋白的二聚化和活化105,106,107。因此,LNP-TLR复合体通过相似的信号通路触发各种促炎细胞因子和趋化因子的分泌108并促进NLRP3炎症体的形成98,105。因此,基于安全考虑,阳离子脂质不被认为是开发当前mRNA疫苗的合适材料。然而,已经尝试开发可电离脂质,其通过在酸性pH下游离胺的质子化而带正电荷,允许RNA在酸性缓冲液中络合,同时在生理pH下保持中性。可电离脂质的这种能力通过形成不稳定的非双层结构并降低pH,在内体逃逸和RNA胞质递送中发挥作用103。因此,在生理和内体条件下,脂质材料的pH敏感性质子化或电离特性对于在全身给药的临床使用中安全有效的LNP结构是必需的。这些pH敏感的可电离脂质在生理pH下具有很小或没有两亲性,但在内体pH下表现出高两亲性,显著降低了体内的细胞毒性和副作用。此外,pH敏感的两亲性细胞膜的去稳定化可以通过LNP浓度的梯度来控制109。此外,pH敏感的离子化脂质可能通过稳定的LNP形成和在低N/P比下核酸的有效细胞内递送来最小化细胞毒性和不良反应,这也可以通过使用生物相容性聚合物对LNP进行表面修饰来改善110,111。迄今为止,三种可电离的阳离子脂质,ALC-0315、SM-102和DLin-MC3-DMA (MC3)已被批准用于临床112。对于新冠肺炎疫苗,Moderna使用的是SM-102,辉瑞/BioNTech使用的是Acuitas许可的ALC-0315113;这些脂质在结构上非常相似。最近,在用于RNA治疗的可电离阳离子脂质的比较研究中,ALC-0135 LNPs显示出比MC-3 LNPs高得多的siRNA敲除效率,且毒性显著降低112。综上所述,这些数据揭示了可离子化的阳离子脂质是在有限毒性下获得最大功效所需的RNA治疗剂的关键成分。
PEG
LNPs的聚乙二醇化被广泛用于提供稳定性和增加血浆半衰期。目前,超过15种聚乙二醇化药物,包括Doxil、Onpattro、辉瑞/BioNTech新冠肺炎疫苗(COMIRNATY)和MODERNA新冠肺炎疫苗,在全球范围内获得完全批准或紧急授权114。尽管基于PEG的纳米颗粒显示出低的反应原性115抗PEG抗体的产生是一个潜在的问题,可以通过重复施用聚乙二醇化药物来克服92,99.
在1983年,通过将聚乙二醇化的蛋白质注射到兔子体内来评估抗聚乙二醇抗体的产生,首次发现了聚乙二醇的免疫原性116。PEG分子在各个行业的广泛使用,增加了抗PEG抗体阳性健康志愿者的比例,从1984年的约0.2%增加到2016年的40%98,99。预先存在的或重新产生的抗PEG抗体激活补体系统。正如最近在新冠肺炎的两种LNP-mRNA疫苗mRNA-1273 (Moderna)和BNT162b2 (Pfizer/BioNTech)的情况中所表明的,聚乙二醇化的LNPs通过激活补体系统诱导抗PEG抗体;因此,它们的使用可能会使疫苗接受者面临过敏反应的风险117.
补体系统的激活可以加速血液清除(ABC ),并显著降低LNP mRNA疫苗的治疗效果99,118。此外,抗PEG抗体与通过静脉注射接受聚乙二醇化药物的患者的假性过敏反应有关,可能导致过敏性休克和死亡100,119。这些过敏反应被认为是通过CARPA激活而发生的92,119这是包括假性过敏性休克在内的输液反应的主要机制98。因此,开发无PEG的递送系统对于未来mRNA疫苗的开发是必要的。在这方面,探索各种材料的性质,如合成的、天然的和两性离子聚合物,被建议用于开发更有效和更安全的mRNA递送系统。与PEG相比,这些材料被认为具有提供创新和有前途的医学应用的潜力。然而,它们是否提供治疗益处而不引起病理性免疫反应或副作用还不确定。因此,应建立筛选和准确确定潜在候选物免疫原性程度的指南120.
mRNA平台的毒性
关于mRNA生物分子,由于输出RNA的免疫原性,外源RNA可使个体暴露于内皮损伤、细胞间连接松弛、水肿、粘度增加、高凝状态和血栓栓塞事件19。为了减少外源RNA诱导的免疫原性,通常有两种技术方法。首先,用假尿苷(ψ)或N1-甲基假尿苷(m1ψ)对IVT mRNA分子进行化学修饰,使得mRNA能够避免通过外源mRNA与TLR7相互作用而发生的先天免疫感应121,122。m1ψ修饰的mRNA显示出比野生型mRNA更低的细胞毒性和免疫原性。细胞内先天免疫信号的干扰为用mRNA平台替代传统的蛋白质疗法提供了优势。第二,在IVT mRNA制备过程中,层析纯化可以减弱免疫反应并提高翻译效率,以消除双链RNA,如病毒基因组的类似物123。然而,它可能需要优化mRNA疫苗接种,因为炎症细胞因子已被证明可以促进适应性免疫反应。因此,mRNA疫苗接种可能需要进一步微调碱基修饰水平,以平衡外源mRNA翻译和先天免疫刺激。
先前已用于抗病毒治疗的修饰核苷不能天然地掺入天然生物体的RNA中124。理论上,化学修饰的非天然分子可以改善天然mRNAs的性质。然而,在纳入治疗前,需要对其安全性进行深入研究,因为在临床试验中,对人类个体施用非天然修饰的核苷分子曾导致线粒体毒性、肝衰竭,甚至死亡125。因此,使用RNA中天然存在的碱基修饰对于治疗应用来说可能是更安全的策略126.
结论和未来方向
在新冠肺炎疫情期间,mRNA疫苗获得了相当大的关注,因为它们具有与快速生产、合理的疫苗效力、可接受的耐受性以及与治疗领域相关的广泛应用(包括肿瘤学和酶替代以及预防)相关的巨大优势。通过预防相关的副作用和减少与使用修饰的mRNA和LNP相关的风险因素,以及克服不稳定的持久性和增强CD8 T细胞应答,可以进一步提高它们的适用性。尽管存在这些挑战,mRNA平台的灵活性和成本效益提供了独特的策略,以进一步改善和解决与疫苗设计相关的长期挑战127。由于它们目前的广泛使用128和可能轨迹作为各种人类疫苗接种努力中的选择平台19重要的是评估潜在的途径来研究它们克服这些挑战的能力以及它们对人类反应原性和耐受性的潜在影响。此外,同时识别潜在的疾病靶标也很重要,因为mRNA疫苗平台可能不是万能的解决方案。然而,考虑到mRNA疫苗在减轻人类疾病方面的巨大潜力,在阐明这一令人兴奋的新技术的所有方面的重大努力是有保证的和必要的。
参考
Doherty,m .、Buchy,p .、Standaert,b .、Giaquinto,c .和Prado-Cohrs,d.《疫苗的影响:对人类健康的益处》。疫苗 34, 6707–6714 (2016).
Rappuoli,r .,Mandl,C. W .,Black,s .和De Gregorio,e . 21世纪社会的疫苗。纳特。免疫Rev。 11, 865–872 (2011).
Brisse,m ,, Vrba,s . m ,, Kirk,n ,, Liang,y &, Ly,h,《疫苗开发中的新概念和技术》。前面。免疫学。 11, 583077 (2020).
Kennedy,R. B .,Ovsyannikova,I. G .,Palese,p .和Poland,G. A.《疫苗学的当前挑战》。前面。免疫学。 11, 1181 (2020).
Kis,z .、Kontoravdi,c .、Dey,A. K .、Shattock,r .和Shah,n.《快速开发和部署用于疫情应对的大量疫苗》。J.马努夫。过程 2,e10060 (2020)。
用于癌症治疗的mRNA疫苗的临床进展和正在进行的试验。柳叶刀肿瘤。 23,e450–e458(2022)。
苗,张,黄,等。基因疫苗在肿瘤免疫治疗中的应用。摩尔。巨蟹星座 20, 41 (2021).
陈军,陈军,徐,陈。mRNA疫苗的发展现状和挑战。安奴。Rev .生物医学。英语。 24, 85–109 (2022).
mRNA-1273新型冠状病毒疫苗的有效性和安全性。名词(noun的缩写)英国医学博士。 384, 403–416 (2021).
BNT162b2 mRNA新冠肺炎疫苗的安全性和有效性。名词(noun的缩写)英国医学博士。 383, 2603–2615 (2020).
临床和临床试验中的脂质纳米粒:从癌症纳米医学到新冠肺炎疫苗。疫苗(巴塞尔) 9, 359 (2021).
通过在哺乳动物细胞系和小鼠中提供增强的蛋白质表达和降低的免疫原性,N(1)-甲基假尿苷掺入的mRNA优于假尿苷掺入的mRNA。J.控制释放 217, 337–344 (2015).
新冠肺炎疫情及更远地区的mRNA疫苗。安奴。医学博士。 73, 17–39 (2022).
mRNA疫苗的纳米材料递送系统。疫苗(巴塞尔) 9, 65 (2021).
肌肉注射mRNA疫苗的脂质纳米粒的优化。摩尔。Ther。核酸 15, 1–11 (2019).
Kanekiyo,m .,Ellis,D. & King,N. P .新疫苗设计和输送技术。J.传染。Dis。 219,S88–S96(2019)。
脊髓灰质炎和狂犬病疫苗在连续细胞系中生产:Vero细胞系的现实。戴夫。生物。站起来。 70, 27–47 (1989).
流感疫苗的年度生产周期。疫苗 21, 1776–1779 (2003).
Pardi,n .,Hogan,M. J .,Porter,F. W .和Weissman,D. mRNA疫苗——疫苗学的新时代。纳特。Rev .药物发现。 17, 261–279 (2018).
中国一种与人类呼吸系统疾病相关的新型冠状病毒。自然 579, 265–269 (2020).
抗新型冠状病毒的mRNA疫苗-初步报告。名词(noun的缩写)英国医学博士。 383, 1920–1931 (2020).
成功的疫苗。Curr。顶端。微生物群。免疫学。 428, 1–30 (2020).
新冠肺炎疫苗接种第一年的全球影响:一项数学模型研究。柳叶刀感染。Dis。 22, 1293–1302 (2022).
人体BNT162b2 mRNA疫苗的系统疫苗学。自然 596, 410–416 (2021).
BNT162b2 mRNA新冠肺炎疫苗6个月的安全性和有效性。名词(noun的缩写)英国医学博士。 385, 1761–1773 (2021).
Weisblum,y .等人通过新型冠状病毒刺突蛋白变体逃避中和抗体。Elife 9,e61312 (2020)。
急性HIV-1病毒感染期间的病毒进化和逃逸。J.传染。Dis。 202,S309–S314(2010年)。
流感病毒和对HA干细胞抗体耐药的不同基因屏障。科学 368, 1335–1340 (2020).
疫苗接种、免疫和自身免疫中的生发中心和滤泡外B细胞反应。免疫 53, 1136–1150 (2020).
mRNA疫苗接种后新型冠状病毒病毒初发和恢复个体中不同的抗体和记忆B细胞反应。Sci。免疫学。 6,eabi6950 (2021)。
Sachinidis,A. & Garyfallos,a .新冠肺炎疫苗接种偶尔会引发自身免疫现象,可能是通过诱导年龄相关的B细胞。里面的大黄。Dis。 25, 83–85 (2022).
疫苗诱导的针对新型冠状病毒病毒变异体的系统和粘膜T细胞免疫。继续。国家科学院。Sci。美国 119,e2118312119 (2022)。
新型冠状病毒mRNA-1273疫苗接种后反应的持久性。名词(noun的缩写)英国医学博士。 384, 80–82 (2021).
与来自新型冠状病毒感染的抗体相比,由mRNA-1273疫苗接种引发的抗体与受体结合结构域的结合更广泛。Sci。Transl。医学。 13,eabi9915 (2021)。
新冠肺炎疫苗对α和δ变异体传播的影响。名词(noun的缩写)英国医学博士。 386, 744–756 (2022).
Edara,V. V. et al. mRNA-1273和BNT162b2 mRNA疫苗降低了针对新型冠状病毒奥米克隆变异体的中和活性。细胞代表医学。 3, 100529 (2022).
针对表位的疫苗的前景和挑战。哼。疫苗。免疫疗法。 12, 2113–2116 (2016).
B细胞对限制性T细胞的竞争有助于抑制罕见表位反应。细胞代表 25,321–327 . e323(2018)。
四价流感纳米颗粒疫苗诱导广泛的保护作用。自然 592, 623–628 (2021).
一种抗新冠肺炎的二价含寡核苷酸加强疫苗。名词(noun的缩写)英国医学博士。 387, 1279–1291 (2022).
mRNA疫苗诱导对新型冠状病毒和相关变异体的持久免疫记忆。科学 374,abm0829 (2021)。
中和抗体水平高度预测对有症状的新型冠状病毒感染的免疫保护。纳特。医学。 27, 1205–1211 (2021).
第三剂BNT162b2 mRNA新冠肺炎疫苗预防以色列严重后果的有效性:一项观察性研究。柳叶刀 398, 2093–2100 (2021).
天花疫苗免疫持续数十年:一项纵向研究。我是。医学博士。 121, 1058–1064 (2008).
新型冠状病毒mRNA疫苗诱导持续的人类生发中心反应。自然 596, 109–113 (2021).
詹克斯,S. A .,凯许曼,K. S .,伍德拉夫,M. C .,李,F. E. &桑斯,I .人类和系统性红斑狼疮的毛囊外反应。免疫学。《启示录》 288, 136–148 (2019).
流感病毒感染后B细胞命运的决定。欧元。免疫学杂志。 40, 366–377 (2010).
未调节的Toll样受体7诱导的不同效应B细胞促进系统性红斑狼疮的致病反应。免疫 52, 203 (2020).
Woodruff,M. C .等:“严重新冠肺炎”患者的幼稚B细胞和新生自身反应失调。自然 611, 139–147 (2022).
影响早期抗体分泌细胞成熟为长寿命浆细胞的因素。前面。免疫学。 10, 2138 (2019).
疫苗佐剂科学中的新概念。纳特。Rev .药物发现。 20, 454–475 (2021).
用先天免疫规划抗体反应的强度和持续性。自然 470, 543–547 (2011).
基于角鲨烯乳剂疫苗佐剂通过RIPK3依赖性途径刺激CD8 T细胞,但不刺激抗体反应。Elife 9,e52687 (2020)。
损伤相关分子模式/细胞死亡途径在疫苗诱导免疫中的作用。病毒 13, 2340 (2021).
李,c。等。辉瑞-BioNTech BNT162b2疫苗的天然免疫和获得性免疫机制。纳特。免疫学。 23, 543–555 (2022).
脂质纳米粒通过诱导强大的T滤泡辅助细胞和体液反应增强mRNA和蛋白质亚单位疫苗的效力。免疫 54,2877–2892 . e 2877(2021)。
用于传染病的自扩增RNA疫苗。基因疗法。 28, 117–129 (2021).
疫苗设计的下一个前沿:将免疫相关的保护融入合理的疫苗设计。Curr。Opin。免疫学。 78, 102234 (2022).
疫苗:疫苗诱导免疫的相关性。Clin。传染。Dis。 47, 401–409 (2008).
疫苗接种的免疫学机制。纳特。免疫学。 12, 509–517 (2011).
mRNA-1273新冠肺炎疫苗效力临床试验的免疫相关性分析。科学 375, 43–50 (2022).
McMahan,k .等人研究了恒河猴对新型冠状病毒的保护作用。自然 590, 630–634 (2021).
T细胞对新型冠状病毒峰的反应交叉识别奥米克隆。自然 603, 488–492 (2022).
理解今天的新冠肺炎疫苗:T细胞是关键角色吗?疫苗(巴塞尔) 10, 904 (2022).
新型冠状病毒疫苗诱导免疫T细胞记忆,能够交叉识别从α到ω的变体。细胞 185,847–859 . e811(2022)。
维多利亚,G. D .和Nussenzweig,M. C生发中心。安奴。免疫Rev。 40, 413–442 (2022).
滤泡辅助性CD4 T细胞(TFH). 安奴。免疫Rev。 29, 621–663 (2011).
在流感mRNA疫苗接种后,伴随着循环血凝素特异性ICOS+ PD-1+ CXCR3+ T滤泡辅助细胞,诱导了强有力的B细胞应答。前面。免疫学。 8, 1539 (2017).
核苷修饰的mRNA疫苗诱导有效的T滤泡辅助细胞和生发中心B细胞反应。J.Exp。医学。 215, 1571–1588 (2018).
非人灵长类动物中新型冠状病毒mRNA-1273疫苗的评估。名词(noun的缩写)英国医学博士。 383, 1544–1555 (2020).
BNT162b疫苗保护恒河猴免受新型冠状病毒病毒感染。自然 592, 283–289 (2021).
莱德雷尔,k .等人新型冠状病毒mRNA疫苗促进与中和抗体生成相关的有效抗原特异性生发中心反应。免疫 53,1281–1295 . e 1285(2020)。
用核苷修饰的mRNA疫苗进行的单次免疫在小鼠中引发了针对新型冠状病毒的强烈的细胞和体液免疫应答。免疫 53,724–732 . e727(2020)。
新型冠状病毒mRNA-1273疫苗在老年人中的安全性和免疫原性。名词(noun的缩写)英国医学博士。 383, 2427–2438 (2020).
抗原特异性CD4(+) T细胞的快速诱导与针对新型冠状病毒mRNA疫苗的协同体液免疫和细胞免疫相关。免疫 54,2133–2142 . e 2133(2021)。
新冠肺炎疫苗BNT162b1引发人类抗体和TH1 T细胞反应。自然 586, 594–599 (2020).
BNT162b2疫苗在人体内诱导中和抗体和多特异性T细胞。自然 595, 572–577 (2021).
新型冠状病毒mRNA疫苗:免疫机制及其他。疫苗(巴塞尔) 9, 147 (2021).
新型冠状病毒变异体对受感染或接种的个体中总CD4(+)和CD8(+) T细胞反应性的影响。细胞代表医学。 2, 100355 (2021).
不同的免疫细胞动力学与新型冠状病毒mRNA疫苗的免疫原性和反应原性相关。细胞代表医学。 3, 100631 (2022).
阿南德,p .和斯塔赫尔,V. P .审查新冠肺炎mRNA疫苗的安全性:一项审查。患者安全。外科医生。 15, 20 (2021).
第三剂BNT162b2新冠肺炎疫苗的安全性和有效性。名词(noun的缩写)英国医学博士。 386, 1910–1921 (2022).
在成人随机试验中,mRNA新冠肺炎疫苗接种后特别关注的严重不良事件。疫苗 40, 5798–5805 (2022).
既往感染对mRNA疫苗接种后住院和不良事件发生率的影响:一项全国性回顾性队列研究。疫苗 40, 1082–1089 (2022).
Repajic,m .,Lai,X. L .,Xu,p .和Liu,一名有复发性贝尔麻痹病史的患者在接受第二剂辉瑞疫苗接种后出现贝尔麻痹。大脑行为。伊蒙。健康 13, 100217 (2021).
谁真的有因新冠肺炎疫苗引起过敏反应的风险?疫苗(巴塞尔) 9, 38 (2021).
BNT162b2 mRNA新冠肺炎疫苗在全国范围内的安全性。名词(noun的缩写)英国医学博士。 385, 1078–1090 (2021).
Abu Lila,A. S .,Kiwada,h .和Ishida,t.《加速血液清除(ABC)现象:临床挑战和管理方法》.J.控制释放 172, 38–47 (2013).
通过toll样受体7和8对单链RNA进行物种特异性识别。科学 303, 1526–1529 (2004).
用于mRNA递送的脂质纳米粒。纳特。脱线牧师。 6, 1078–1094 (2021).
Kariko,k .等人将假尿苷掺入mRNA产生了具有增加的翻译能力和生物稳定性的优良的非免疫原性载体。摩尔。Ther。 16, 1833–1840 (2008).
Estape Senti,m .等。抗PEG抗体通过补体损害聚乙二醇化脂质纳米粒的完整性。J.控制释放 341, 475–486 (2022).
脂质纳米粒通过诱导强大的T滤泡辅助细胞和体液反应增强mRNA和蛋白质亚单位疫苗的效力。免疫 55, 1136–1138 (2022).
Kobiyama,k .和Ishii,K. J .对mRNA疫苗佐剂性的先天认识。纳特。免疫学。 23, 474–476 (2022).
IL-1和IL-1ra是RNA疫苗炎症反应的关键调节因子。纳特。免疫学。 23, 532–542 (2022).
基因工程纳米颗粒对先天免疫系统的影响。塞明。免疫学。 34, 25–32 (2017).
功能化磷脂纳米颗粒表面对补体的可变抗体依赖性激活。J.生物。化学。 286, 123–130 (2011).
LNP mRNA的非免疫疗法应用:最大化疗效和安全性。生物医学 9, 530 (2021).
Kozma,G. T .,Shimizu,t .,Ishida,T. & Szebeni,j.《抗聚乙二醇抗体:性质、形成、测试和在聚乙二醇化纳米生物药物的不良免疫反应中的作用》。药物输送。《启示录》 154–155, 163–175 (2020).
补体激活相关的假性过敏:由纳米药物和生物制剂引发的血液应激反应。摩尔。免疫学。 61, 163–173 (2014).
马龙,R. W .,费尔格纳,P. L .和维尔马,阳离子脂质体介导的RNA转染。继续。国家科学院。Sci。美国 86, 6077–6081 (1989).
编码单纯疱疹病毒1型胸苷激酶的修饰mRNA的系统递送用于靶向癌症基因治疗。摩尔。Ther。 21, 358–367 (2013).
一种用于mRNA递送的新型可电离脂质的非临床安全性评估。毒物。应用药理学。 451, 116143 (2022).
阳离子脂质激活细胞内信号通路。药物输送。《启示录》 64, 1749–1758 (2012).
阳离子脂质纳米载体激活Toll样受体2和NLRP3炎症体途径。纳米医学 10, 775–782 (2014).
阳离子脂质纳米载体激活Toll样受体4的关键残基不在脂多糖结合界面。细胞分子。生命科学。 72, 3971–3982 (2015).
带正电荷的脂质纳米颗粒的全身毒性和Toll样受体4在免疫激活中的作用。生物材料 31, 6867–6875 (2010).
Abrams,M. T .等人对强效siRNA纳米颗粒的功效、生物分布和炎症的评估:地塞米松联合治疗的效果。摩尔。Ther。 18, 171–180 (2010).
Malamas,A. S .,Gujrati,m .,Kummitha,C. M .,Xu,r .和Lu,Z. R . .设计和评价用于给药的新型pH敏感性两亲性阳离子脂质。J.控制释放 171, 296–307 (2013).
用于核酸传递的阳离子和可电离脂质的结构和功能。制药。水库。 40, 27–46 (2023).
Ganesan,p .,Ramalingam,p .,Karthivashan,g .,Ko,Y. T .和Choi,D. K.《用于在各种慢性疾病中口服递送植物生物活性化合物的固体脂质纳米粒和表面修饰的固体脂质纳米粒递送系统的最新发展》。里面的纳米医学博士。 13, 1569–1583 (2018).
比较DLin-MC3-DMA和ALC-0315对肝细胞和肝星状细胞的siRNA递送。摩尔。制药。 19, 2175–2182 (2022).
自我组装mRNA疫苗。药物输送。《启示录》 170, 83–112 (2021).
Halamoda-Kenzaoui,b .和Bremer-Hoffmann,s .临床前研究中纳米药物引发的免疫效应的主要趋势。里面的纳米医学博士。 13, 5419–5431 (2018).
蛋白质和脂质体的聚乙二醇化:一种有效和灵活的改善药物传递的策略。Curr。药物代谢。 13, 105–119 (2012).
Richter,A. W. & Akerblom,e .用单甲氧基聚乙二醇修饰的蛋白质免疫动物产生的抗聚乙二醇抗体。里面的拱门。过敏应用免疫。 70, 124–131 (1983).
新型冠状病毒脂质纳米粒mRNA疫苗在人体内增强的抗聚乙二醇抗体。ACS纳米 16, 11769–11780 (2022).
mRNA-LNP疗法的最新进展:免疫学和药理学方面。J.纳米生物技术。 20, 276 (2022).
脂质体和脂质体包裹的血红蛋白在猪体内引起的血液动力学变化:一个对脂质体的假过敏性心肺反应模型。补体的作用以及可溶性CR1和抗C5a抗体的抑制作用。流通 99, 2302–2309 (1999).
Hoang Thi,T. T .等,《聚乙二醇替代物在药物递送和生物偶联中克服peg免疫原性的重要性》。聚合物。(巴塞尔) 12, 298 (2020).
Kariko,k .,Buckstein,m .,Ni,H. & Weissman,d . Toll样受体对RNA识别的抑制:核苷修饰的影响和RNA的进化起源。免疫 23, 165–175 (2005).
基于mRNA的疗法——开发一类新的药物。纳特。Rev .药物发现。 13, 759–780 (2014).
Kariko,k .,Muramatsu,h .,Ludwig,j .和Weissman,d .产生用于治疗的最佳mRNA:HPLC纯化消除了免疫激活并提高了核苷修饰的蛋白质编码mRNA的翻译。核酸研究 39,e142 (2011)。
Schlake,t .,Thess,a .,Thran,m .和Jordan,I. mRNA作为被动免疫疗法的新技术。细胞分子。生命科学。 76, 301–328 (2019).
没有化学核苷修饰的序列工程mRNA使得在大型动物中进行有效的蛋白质治疗成为可能。摩尔。Ther。 23, 1456–1464 (2015).
设计最佳mRNA脂质纳米粒疫苗的原则。Curr。Opin。生物技术。 73, 329–336 (2022).
挑战与瓶颈。疫苗 39, 2190–2200 (2021).
确保全球获得新冠肺炎疫苗的挑战:生产、可负担性、分配和部署。柳叶刀 397, 1023–1034 (2021).
承认
这项工作得到了食品和药品安全部的资助(J.H.N的资助号为22213MFDS421,E.H.K的资助号为22203MFDS402)、韩国政府资助的国家研究基金会(NRF)、科学和信息通信部(J.H.N的资助号为NRF-2021M3E5E3080558,E.H.K的资助号为NRF-2023M3A9G6057281)以及韩国21+大脑计划的部分支持。
道德宣言
竞争的利益
作者声明没有利益冲突。
附加说明
出版商的说明Springer Nature在已发布地图和机构关联的管辖权主张方面保持中立。
权利和权限
开架借阅本文根据知识共享署名4.0国际许可证进行许可,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您适当注明原作者和来源,提供知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包括在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
放大图片作者:李j .以及其他人 刀刃:平衡mRNA疫苗的免疫原性和反应原性。Exp Mol Med 55, 1305–1313 (2023).https://doi.org/10.1038/s12276-023-00999-x
Hits: 479