Contents
- 1 更新历史记录
- 2 摘要
- 3 摘要和背景
- 4 方法和搜索结果
- 5 建议 1: 对有症状者进行抗原检测与不进行检测的比较
- 6 建议 2:对有症状个体进行抗原检测与标准核酸扩增检测的比较
- 7 建议 3:对有症状者进行重复快速抗原检测 ,而非单次标准核酸扩增检测。
- 8 建议 4:对已知接触过 SARS-CoV-2 的无症状个体进行抗原检测与不进行检测的比较
- 9 建议 5:对已知接触过 SARS-CoV-2 的无症状个体进行抗原检测与标准核酸扩增检测 (NAAT) 的比较
- 10 建议 6:对已知接触过 SARS-CoV-2 的无症状个体进行重复抗原检测 ,并与单次标准核酸扩增检测进行比较
- 11 建议 7:对教育机构中的无症状学生和工作场所中的员工进行重复抗原检测与不检测的比较
- 12 建议 8:对计划参加大型集会的无症状者进行抗原检测与不进行检测的比较
- 13 建议 9:即时检测与实验室抗原检测
- 14 建议 10:观察与非观察下自行采集抗原检测样本的比较
- 15 讨论与结论
- 16 笔记
- 17 参考
- 18 补充信息
COVID-19 Guideline, Part 5: Antigen Testing 2022
尼马替韦/利托那韦(Paxlovid®)药物相互作用的管理:临床医生资源
玛丽 ·K·海登、* 雷姆·A·穆斯塔法、** 金伯利·E·汉森、珍妮特·A·恩格伦德、弗朗西斯卡·李、马克·J·李、马克·勒布、丹尼尔·J·摩根、罗宾·帕特尔、阿卜杜拉·埃尔·阿莱利、** 易卜拉欣·K·埃尔·米卡蒂、** 沙纳兹·苏丹、** Yngve Falck-Ytter、** 拉赞·曼苏尔、** 贾斯汀·Z·阿马林、** 丽贝卡·L.摩根,M.** 哈桑·穆拉德,** 帕亚尔·帕特尔,** 阿达什·比姆拉杰
* 通讯作者 ** 方法学家
2022年12月20日
2.0.0 版本已发布,其中包含针对医疗和非医疗机构中出现症状和无症状人员的 COVID-19 抗原检测的更新和新增建议。
本次更新已获得儿科传染病学会、美国微生物学会和美国医疗保健流行病学会的认可。
更新历史记录
2021年5月27日
版本 1.0.0 已发布,并获得了美国微生物学会、美国医疗保健流行病学会和儿科传染病学会的认可。
摘要
背景: 用于检测 SARS-CoV-2 蛋白抗原(Ag)的免疫测定法是诊断 COVID-19 的常用方法。最常用的检测方法是侧向层析法,可在约 15 分钟内得出结果,适用于床旁诊断。此外,也开发了高通量、实验室检测的 SARS-CoV-2 抗原检测方法。市售 SARS-CoV-2 抗原检测试剂盒的数量以及 COVID-19 诊断相关文献均迅速增加。美国传染病学会(IDSA)召集了一个专家小组,对相关文献进行系统性回顾,并制定了 SARS-CoV-2 抗原检测的最佳实践指南。本指南是 IDSA 制定的 COVID-19 诊断指南系列中第三版的更新版本,该系列指南会定期更新。
目标: IDSA 的目标是制定循证建议或意见,以帮助临床医生、临床实验室、患者、公共卫生机构、管理人员和政策制定者在医疗和非医疗环境中做出与 SARS-CoV-2 抗原检测的最佳使用相关的决策。
方法: 由传染病临床医生、临床微生物学家和系统文献综述专家组成的多学科小组,确定并优先考虑了与 SARS-CoV-2 抗原检测相关的临床问题。该小组检索了截至 2022 年 4 月 1 日的相关同行评审已发表文献。采用推荐意见分级评估、制定及评价(GRADE)方法评估证据的确定性并提出检测建议。
结果: 专家组提出了十项诊断建议。这些建议涉及有症状和无症状个体的抗原检测,并评估了单次检测与重复检测策略。
结论: 美国食品药品监督管理局 (FDA) 紧急使用授权 (EUA) 的 SARS-CoV-2 抗原检测与核酸扩增检测 (NAAT) 相比,具有较高的特异性和较低至中等的灵敏度。抗原检测的灵敏度取决于是否存在症状,对于有症状的患者,还取决于症状出现后检测的时间。相比之下,抗原检测具有较高的特异性,并且在大多数情况下,阳性结果无需确认即可采取行动。即时检测的结果与实验室检测的结果相当,无论是在监督下还是在无人监督的情况下自行采集样本进行检测,结果都相似。模型表明,重复进行抗原检测比单次检测更能提高灵敏度,但目前尚无实证数据支持这一结论。基于以上观察,快速 RT-PCR 或实验室 NAAT 仍然是诊断 SARS-CoV-2 感染的首选检测方法。然而,当无法及时进行分子检测或在后勤方面不可行时,抗原检测有助于识别 SARS-CoV-2 感染者。目前尚无足够数据就抗原检测在指导 COVID-19 患者解除隔离方面的效用提出建议。现有证据支持使用抗原检测的总体质量被评为极低至中等。
摘要和背景
执行摘要
诊断检测是抗击 COVID-19 的重要工具。SARS-CoV-2 抗原 (Ag) 检测现已广泛应用,这有助于将检测范围扩展到医院或诊所以外的场所。目前临床使用的大多数 SARS-CoV-2 抗原检测是即时检测 (POC) 侧向层析装置,可在约 15 分钟内得出结果。实验室抗原检测平台也已存在,但其性能和实用性方面的经验有限。POC 检测的主要优势在于能够快速获得结果,这有助于隔离、接触者追踪、检疫以及潜在的治疗决策。鉴于近期关于诊断检测的文献数量激增,以及抗原检测的广泛应用,尤其是在医疗机构以外的场所,美国传染病学会 (IDSA) 已更新了基于循证医学的指南,用于指导美国食品药品监督管理局 (FDA) 紧急使用授权 (EUA) 的 SARS-CoV-2 抗原检测的使用。
与标准核酸扩增检测(NAAT,即快速 RT-PCR 或实验室 NAAT; 图 S2b )相比,SARS-CoV-2 抗原检测的总体特异性≥99%。因此,在大多数情况下,无需使用参考分子方法对抗原阳性结果进行常规确认。相反,抗原检测的敏感性较低或中等,且取决于是否存在 COVID-19 症状以及症状出现后检测的时间。对于有症状的个体,抗原检测的汇总敏感性为 81%(95% CI:78%至 84%)( 图 S2a );如果在发病后 5 天内进行检测,则敏感性为 89%(95% CI:83%至 93%)( 图 S3a );5 天后,敏感性下降至 54%( 图 S4a )。在症状出现后 3 天内对患者进行检测,其结果与 5 天内进行检测的结果相似。未发现报告症状出现后 1 至 2 天内患者检测结果的研究。在无症状人群中,抗原检测的汇总敏感性为 63%( 图 S12a )。抗原检测在成人和儿童中的表现相似,但儿童数据有限( 图 S12a-S13b )。
尽管抗原检测被广泛用于指导个人出勤(包括上学、上班和参加大型社交聚会),但专家组并未发现任何直接指导这些检测应用的临床试验或观察性研究,因此无法就这些情况下的抗原检测提出建议。同样,专家组也未发现任何临床试验或观察性研究比较根据症状出现时间解除隔离的患者与根据抗原检测结果解除隔离的患者之间 SARS-CoV-2 病毒传播风险的差异。因此,专家组无法就抗原检测在指导解除隔离方面的效用提出建议。
由于缺乏实证数据来评估连续样本检测与单次样本检测相比,在分子检测方面的价值,因此采用数学模型对连续样本检测的结果进行了估算;分析结果表明,重复检测可以提高灵敏度。 [1] 其他证据缺口包括抗原检测在已接种疫苗者或既往感染过 SARS-CoV-2 的人群中的表现。关于抗原检测在免疫功能低下或儿童患者(尽管文献综述排除了仅纳入免疫功能低下人群的研究)或近期感染 SARS-CoV-2 变异株的人群中的表现,现有数据非常有限。在截至 2022 年 4 月的文献检索中,专家组仅发现一项研究纳入了 2021 年 11 月之后接受检测的人群,而 2021 年 11 月正是 Omicron 变异株出现并占据主导地位的时期。所有研究均将抗原检测结果与分子检测结果进行了比较,但没有一项研究使用临床参考标准。
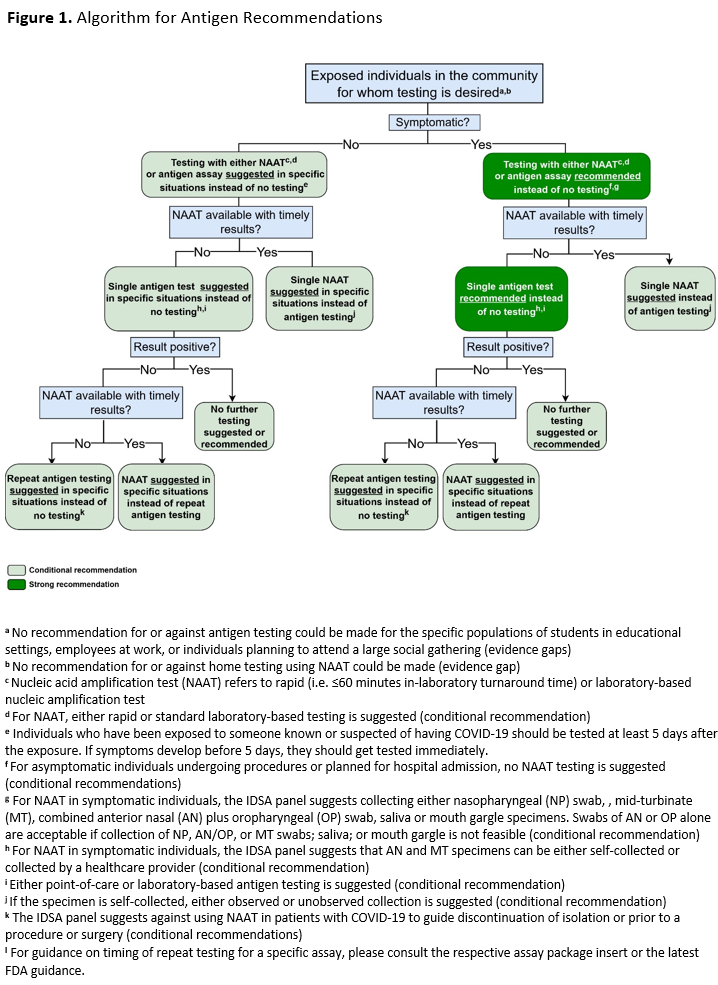
以下总结了与使用已获 FDA 紧急使用授权(EUA)的 SARS-CoV-2 抗原检测相关的具体建议和意见。我们提供了一个基于这些建议的算法,以辅助决策( 图 1 )。关于每项建议的背景、方法、证据总结和理由,以及尚未满足的研究需求,详见全文。
[1] 注:2022 年 8 月 11 日,FDA 发布了关于对有症状和无症状者进行重复抗原检测以诊断 COVID-19 的建议。( https://www.fda.gov/medical-devices/safety-communications/home-covid-19-antigen-tests-take-steps-reduce-your-risk-false-negative-results-fda-safety#:~:text=Currently%2C%20all%20at%2Dhome%20COVID,t%20have%20COVID%2D19%20symptoms ) 这项建议基于一篇预印本的发表,该预印本报告称,与复合标准核酸扩增参考标准相比,快速抗原检测的灵敏度更高。研究对象中,无症状受试者每隔 48 小时接受三次检测,有症状受试者在 48 小时内接受两次检测。https ://pubmed.ncbi.nlm.nih.gov/35982680/
简而言之,由临床医生、医学微生物学家和方法学家组成的专家组采用推荐意见分级评估、制定和评价(GRADE)方法,对 SARS-CoV-2 抗原诊断文献进行了严格评估,以评价证据的确定性。根据 GRADE 方法,推荐意见分为“强推荐”和“有条件推荐”。“推荐”表示强推荐,“建议”表示有条件推荐。本指南假设快速抗原检测可用,并侧重于诊断检测和无症状筛查。
鉴于分子诊断具有更高的灵敏度,专家组建议,如果标准核酸扩增检测(NAAT)可用且检测结果能够及时获得,则应优先使用标准 NAAT 而非抗原检测。专家组认识到快速诊断 COVID-19 的重要性,因为治疗方案通常在症状出现后 5 天内获批使用。此外,快速隔离传染性患者有望降低 SARS-CoV-2 的传播。因此,当无法及时进行 NAAT 时,快速抗原检测具有价值,尤其是在结果呈阳性时;抗原检测的高特异性意味着阳性结果无需确认即可采取行动。相反,当临床高度怀疑 COVID-19 时,阴性抗原检测结果应通过标准 NAAT 进行确认。最终,是否在低风险的非医疗环境中使用快速抗原检测将取决于多种因素,包括人群中的疾病流行率,以及对检测真正 SARS-CoV-2 感染的价值与错误结果(即假阴性或假阳性结果)的不利影响的评估。测试实施的可行性和测试成本也是需要考虑的重要因素。
建议
建议 1: 对于疑似感染 COVID-19 的有症状个体,IDSA 专家组建议进行一次抗原检测,而不是不进行检测 (强烈推荐,中等确定性证据)。
- 评论:
- 有症状者定义为至少出现一种 COVID-19 常见症状的人( 表 1,IDSA COVID-19 诊断指南:分子诊断检测 )。
- 为获得最佳检测效果,抗原检测应在症状出现后 5 天内进行。
- 如果临床上仍然高度怀疑 COVID-19,则应通过标准 NAAT(即快速 RT-PCR 或基于实验室的 NAAT)确认阴性抗原结果。
- 单次抗原检测具有很高的特异性;阳性结果可用于指导治疗和隔离决策,无需进一步确认。
- 关于抗原检测在儿童、免疫功能低下者、接种过疫苗者或曾感染过 SARS-CoV-2 的人群中的分析性能数据有限。
- 专家组未能找到研究比较根据抗原检测结果解除隔离的 COVID-19 康复患者与未进行抗原检测的患者之间的传播风险。
建议 2: 对于疑似患有 COVID-19 的有症状个体,IDSA 专家组建议使用标准 NAAT(即快速 RT-PCR 或基于实验室的 NAAT)而不是快速抗原检测 (有条件推荐,证据确定性低) 。
- 评论:
- 如果标准 NAAT 不可用或预计结果会延迟一天以上,IDSA 专家组建议使用快速抗原检测而不是标准 NAAT。
- 为获得最佳检测效果,抗原检测应在症状出现后五天内进行。
- 专家组未能找到研究比较根据抗原检测结果与标准核酸扩增检测结果解除隔离的 COVID-19 康复患者的传播风险。
建议 3: 对于疑似感染 COVID-19 的有症状个体,IDSA 专家组建议使用单一标准 NAAT(即快速 RT-PCR 或基于实验室的 NAAT),而不是连续进行两次快速抗原检测的策略 (有条件建议,证据确定性非常低) 。
- 评论:
- 如果 NAAT 结果不能及时获得,且第一次抗原检测结果为阴性,IDSA 专家组建议重复进行抗原检测。
- 由于缺乏直接的经验证据来解答这个问题,因此进行的分析是基于使用重复测试算法对诊断测试准确性进行建模,该算法涉及两次连续的抗原测试。
- 为了达到最佳灵敏度,应在症状出现后 5 天内进行重复测试。
- 如果第一次抗原检测结果为阳性,则无需重复检测。
建议 4: 对于已知接触过 SARS-CoV-2 感染的无症状个体,IDSA 专家组建议在特定情况下使用单次(即一次性)抗原检测,而不是不进行检测 (有条件建议,中等确定性证据) 。
- 评论:
- 对于无新冠肺炎样症状者,应根据个体情况进行 SARS-CoV-2 检测。如果检测结果会影响个人的后续行动,则可考虑进行一次性抗原检测。例如,在以下情况下,可考虑进行单次检测:对于新冠肺炎重症高风险人群,阳性检测结果将促使加强对其症状和感染体征的监测;或者在疫情暴发的情况下,阳性结果有助于制定隔离、检疫和接触者追踪等决策。
- 抗原检测结果为阴性可降低感染 SARS-CoV-2 的可能性。然而,检测时间越长,这种可能性降低的幅度就越小,尤其是在感染初期病毒复制迅速的时候。也就是说,今天的阴性检测结果可能无法反映明天或之后几天的感染状况。相比之下,阳性检测结果具有较高的阳性预测值。
- 专家组承认缺乏证据支持对无症状患者进行治疗,并且没有通过 FDA EUA 批准的针对无症状 COVID-19 的治疗方法,但承认个别临床情况可能会促使临床医生进行检测并考虑治疗。
建议 5: 对于已知接触过 SARS-CoV-2 感染的无症状个体,IDSA 专家组建议使用单一标准 NAAT(即快速 RT-PCR 或基于实验室的 NAAT),而不是单一快速抗原检测 (有条件推荐,证据确定性低) 。
- 评论:
- 对于无新冠肺炎样症状者,应根据个体情况进行 SARS-CoV-2 检测。如果检测结果会影响个人的后续行动,则可考虑进行一次性标准核酸扩增检测(NAAT)。例如,对于新冠肺炎重症高风险人群,如果检测结果呈阳性,则需加强对其症状和体征的监测;或者在疫情暴发的情况下,如果阳性结果有助于制定隔离、检疫和接触者追踪等决策,则可考虑进行单次检测。
- 在某些情况下,可能无法及时获得标准 NAAT 检测结果;在这种情况下,可以考虑使用抗原检测。
- 专家组承认缺乏证据支持对无症状感染者进行 COVID-19 治疗,也没有通过 FDA EUA 批准的针对无症状 COVID-19 的治疗方法,但承认个别临床情况可能会促使临床医生进行检测并考虑治疗。
建议 6: 对于已知接触过 SARS-CoV-2 的无症状个体,如果无法及时获得标准 NAAT 检测或结果,且第一次抗原检测结果为阴性,IDSA 专家组建议重复进行抗原检测 (有条件建议,证据确定性非常低) 。
- 评论:
- 由于缺乏直接的经验证据来解答这个问题,因此分析是基于使用重复测试算法对诊断测试准确性进行建模,该算法涉及两次连续的抗原测试。
建议 7: 对于希望进行 SARS-CoV-2 检测的教育机构中的学生或工作场所中的员工,IDSA 专家组建议,对于 SARS-CoV-2 感染的诊断,既不赞成也不反对连续两次抗原检测,而不进行检测(证据不足)。
- 评论:
- IDSA 专家组没有发现直接证据表明,在学校、学院或工作场所等群体环境中,两种 Ag 检测与单一标准 NAAT 与第三种参考标准之间存在差异。
- 由于缺乏直接的经验证据来解答这个问题,因此分析是基于使用重复测试算法对诊断测试准确性进行建模,该算法涉及两次连续的抗原测试。
建议 8: 对于计划参加大型聚会(例如音乐会、会议、派对、体育赛事)的无症状个人,IDSA 专家组建议既不赞成也不反对进行抗原检测(证据不足)。
- 评论:
- 目前尚无研究直接探讨此问题。
建议 9: 对于希望进行抗原检测的个人,IDSA 专家组建议进行即时检测或实验室抗原检测 (有条件推荐,证据确定性低) 。
- 评论:
- 尽管即时检测和实验室抗原检测的性能结果似乎相当,但现有证据的一个重要局限性在于,研究并未报告有症状和无症状受试者的相对数量。由于抗原检测对有症状个体的敏感性高于无症状个体,即时检测或实验室研究中纳入的有症状和无症状个体比例未知,这可能导致结果被低估,从而掩盖了两种检测方法之间的差异。
建议 10: IDSA 专家组建议,如果进行自我采集,则可采用观察或非观察的方式进行拭子样本的自我采集以进行抗原检测 (有条件建议,证据确定性低) 。
- 评论:
- 目前还没有研究对同一患者的观察标本采集和非观察标本采集进行比较。
- 研究报告显示,标本采集技术以及用作比较的参考标准存在异质性。
- 提供最佳标本采集方法的指导可以提高自行采集标本的质量。
背景
快速准确地诊断 SARS-CoV-2 感染仍然是旨在遏制 COVID-19 传播的综合缓解策略的重要组成部分。标准核酸扩增检测(NAAT),在本文件中定义为快速 RT-PCR 或实验室核酸扩增检测,被认为是诊断有症状或无症状 COVID-19 的参考方法。然而,在疫情期间,尤其是在早期,分子诊断试剂短缺和检测结果延迟阻碍了许多地区的检测工作。目前,多种 COVID-19 药物疗法已获得美国 FDA 的紧急使用授权(EUA),可在症状出现后的前 5 天内使用,这凸显了快速准确检测结果的必要性。
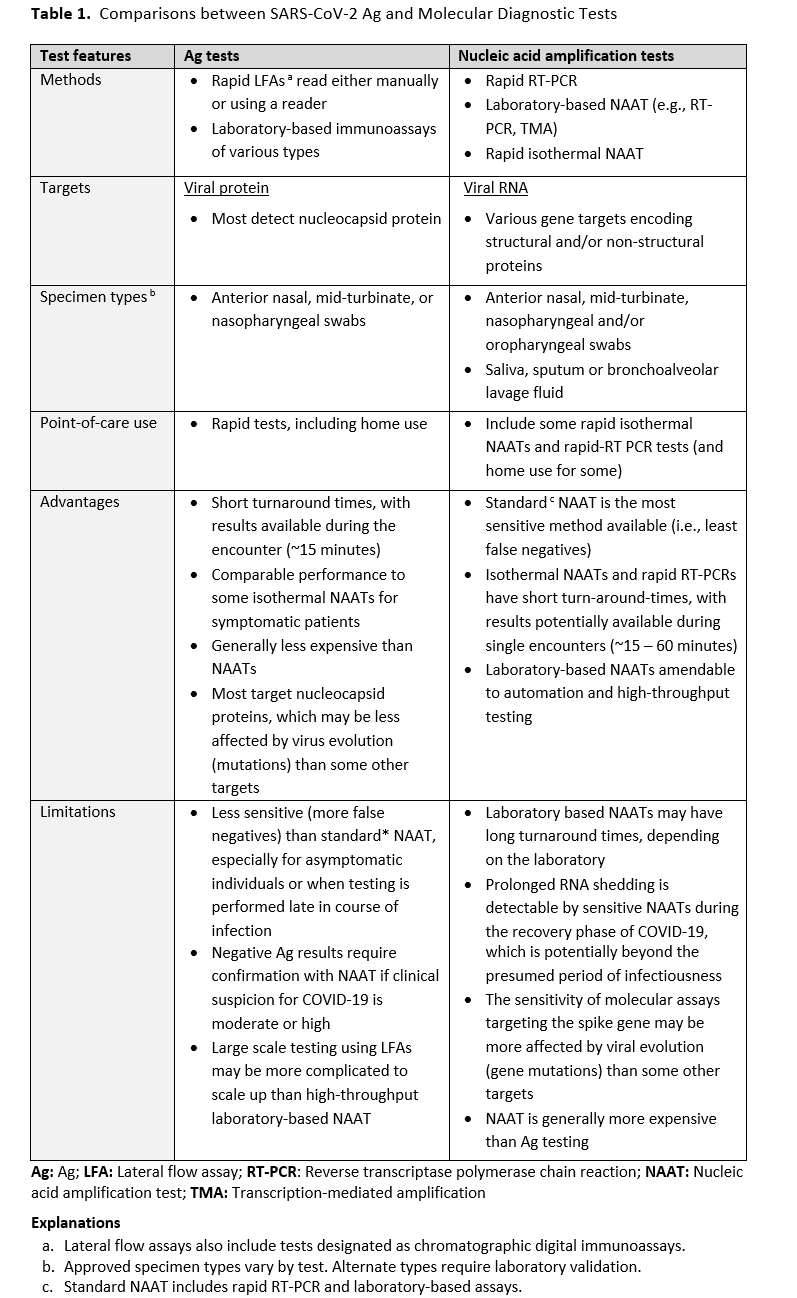
市售的快速抗原检测方法可检测 SARS-CoV-2 蛋白,有助于满足目前广泛开展 SARS-CoV-2 检测的需求。虽然基于抗原的呼吸道病毒检测方法通常不如参考分子方法灵敏,但抗原检测操作更简便快捷,且通常比核酸扩增检测(NAAT)更经济。此外,快速抗原检测易于在诊所或医院以外的场所进行,且分析可由非医务人员完成。 表 1 比较了抗原检测与核酸扩增检测的优势和局限性。
截至 2022 年 9 月,已有 51 种 SARS-CoV-2 抗原检测产品获得美国食品药品监督管理局(FDA)的紧急使用授权(EUA)[1]。SARS-CoV-2 抗原检测产品使用单克隆抗体捕获并检测通过鼻咽拭子、中鼻甲拭子或鼻拭子采集的呼吸道分泌物中的病毒蛋白。2021 年 9 月 23 日,FDA 修订了部分抗原检测产品的 EUA,要求生产商评估 SARS-CoV-2 病毒变异对其检测性能的影响,并相应地更新其授权标签[1]。根据生产商的不同,抗原检测拭子可以直接进行分析,也可以置于经批准的运输培养基或其他液体中进行检测。目前可用的 SARS-CoV-2 抗原检测产品有多种形式,包括快速侧向层析免疫分析(LFA)和其他类型的免疫测定。LFA 是目前最常用的 SARS-CoV-2 抗原检测方法,并且适用于即时检测(POC)。此外,多种 SARS-CoV-2 侧向流动免疫分析(LFA)已获得紧急使用授权(EUA),可用于居家检测。侧向流动免疫分析采用一次性试纸条,结果可通过目测或仪器读取,耗时约 15 分钟。其他免疫分析方法可能需要仪器或操作步骤,这些步骤必须由受过培训的实验室人员在临床实验室完成,通常仪器运行时间不到一小时即可生成结果。
大多数获得紧急使用授权(EUA)的 SARS-CoV-2 抗原检测产品都适用于疑似感染 COVID-19 的有症状个体,但越来越多的检测产品也适用于无症状人群的暴露后筛查[1]。大多数抗原检测产品的使用期限为症状出现后的前 5、7、12 或 14 天,具体使用期限取决于检测产品。设备制造商和美国疾病控制与预防中心(CDC)建议,对于有症状的患者,如果抗原检测结果为阴性,应使用后续的参考分子诊断检测进行确认[2]。抗原检测也被用于监测目的(即,检测未接触过 SARS-CoV-2 确诊病例的无症状个体)。美国医疗保险和医疗补助服务中心(CMS)行使了执法自由裁量权,允许在 COVID-19 公共卫生紧急状态期间对所有无症状个体使用抗原检测产品。根据检测目的,Ag 检测也可以只进行一次(单次检测),或者随着时间的推移依次进行(重复检测)。
鉴于抗原检测用途广泛,且已发表的抗原检测相关研究数量迅速增长,美国传染病学会(IDSA)召集了一个专家小组,系统地审查了 SARS-CoV-2 抗原诊断检测文献,重点关注已获得紧急使用授权(EUA)的检测方法。该小组比较了各项检测准确性的汇总估计值,并据此提出了基于证据的临床实践最佳应用建议。本指南假设 SARS-CoV-2 在社区持续传播,且已获得 EUA 认证的抗原检测方法可用,但并未涉及其在公共卫生监测中的应用。
方法和搜索结果
面板组成
该专家组由临床医生和临床微生物学家组成,他们均为美国传染病学会 (IDSA)、美国微生物学会 (ASM)、美国医疗保健流行病学会 (SHEA) 和儿科传染病学会 (PIDS) 的成员。他们分别代表了传染病学、儿科学和医学微生物学领域。循证基金会为本指南的制定提供了技术支持和指南方法学专家。
披露和管理潜在利益冲突
利益冲突审查小组由两名来自美国传染病学会 (IDSA) 的代表组成,负责审查、评估和批准所有披露信息。专家组所有成员均遵守利益冲突审查和管理流程,该流程要求披露任何可能被视为构成实际、潜在或表面利益冲突的财务、知识产权或其他利益,无论其是否与指南主题相关。对已披露关系是否存在潜在利益冲突的评估基于财务关系的相对重要性(即金额)和关系的相关性(即独立观察者在多大程度上可能合理地将该关联解读为与待审议的主题或建议相关)。利益冲突审查小组确保专家组大多数成员和主席不存在潜在的相关利益冲突(即与主题相关的利益冲突)。主席和技术团队的所有成员均被认定不存在利益冲突。
问题生成
在第一次专家组会议之前,与 SARS-CoV-2 抗原检测相关的临床问题被整理成 PICO 格式(人群、干预措施、比较、结果)( 表 S1 )。专家组成员优先考虑有证据支持且符合最低可接受标准的问题(即,证据体系至少基于病例系列设计;病例报告被排除在外)。
搜索策略
我们对多个数据库进行了全面检索,检索时间范围为 2019 年 1 月至 2022 年 4 月 1 日,检索范围限定为人类研究和英文文献。检索的数据库包括 PubMed、MEDLINE、EMBASE 和 Cochrane 对照试验中心注册库。检索策略由一位经验丰富的图书馆员设计并执行,并参考了方法学专家组的意见。检索使用了受控词表,并辅以关键词,检索关键词包括 SARS-CoV-2、诊断和抗原检测。我们审查了专家组推荐的参考文献和文献列表,以确定是否纳入研究。预印本会持续更新,直至最终发表,但除非已正式发表,否则不会纳入文献综述。在证据评估和推荐过程中,我们进行了前瞻性研究,以查找其他灰色文献(即通过传统出版和发行渠道之外的信息)、手稿预印本以及在最后一次检索日期之后发表的文献。我们审查了专家组推荐的参考文献和文献列表,以确定是否纳入研究。完整的检索策略见补充材料( 表 S2 )。
筛选和研究选择
纳入标准
四位审稿人(AE、IKE、RM、PP 和 FA)独立筛选了标题和摘要,以及符合条件的全文研究。纳入的研究类型包括报告抗原检测诊断准确性的研究(队列研究、横断面研究和病例对照研究)。我们的目标是找到比较抗原检测或基于抗原检测的策略与快速 RT-PCR 检测或不使用第三种参考标准进行诊断性能的研究。如果未找到此类研究,我们则选择报告抗原检测与快速 RT-PCR(作为参考标准)相比的诊断准确性的研究。我们仅纳入截至 2022 年 3 月已获得 FDA EUA 或 CE 认证的检测方法。我们仅纳入使用单一或多种核酸扩增检测 (NAAT) 作为参考标准的研究。我们纳入了所有研究,无论 COVID-19 的流行情况如何。如果研究将抗原检测与预先定义的参考标准进行比较,则无论症状出现时间如何,我们均予以纳入。我们仅纳入使用上呼吸道样本(前鼻拭子、中鼻甲拭子或鼻咽拭子)的研究。审稿人将相关信息提取到标准化的数据提取表格中。如果研究报告了检测策略对疾病患病率或结果的影响,则该研究将被纳入。
排除标准
我们排除了以下研究:以抗原检测与病毒培养作为参考标准的研究;纳入患者少于 100 例以进行敏感性或特异性评估的研究;仅报告敏感性或特异性的研究;未获得 FDA 紧急使用授权(EUA)或 CE 认证的检测;以及信息不足以计算敏感性和特异性的研究。我们排除了使用混合样本的研究和评估分析敏感性/特异性(而非临床样本)的研究。我们排除了仅纳入免疫功能低下个体的研究,因为与该患者群体相关的问题并非本次更新的重点。此外,我们也排除了未经同行评审的预印本研究。
数据收集与分析
评审小组从纳入的研究中提取了数据。提取的数据包括研究的一般特征(作者、发表年份、国家、研究设计)、诊断指标检测和参考标准、COVID-19 的流行率以及确定检测准确性的参数(即指标检测的灵敏度和特异性)。对于每项检测,我们提取了采样点、采样方法(医护人员、自行采集或在监督下自行采集)、是否使用运输培养基(与干拭子或直接检测相比)、样本采集地点(例如,门诊、医院、现场)、目标抗原、检测平台(例如,侧向层析)。我们还记录了抗原检测和核酸扩增检测是否使用同一份样本;两种检测是否使用同一部位(如果使用不同的样本);一种检测的样本是否系统性地先于另一种检测采集(例如,抗原拭子总是先采集);样本采集之间是否存在时间间隔(例如,入院时采集用于核酸扩增检测的样本,几天后再采集用于抗原检测的样本)。以及样本是从右侧、左侧还是两侧采集的(如果可以确定侧向性,例如鼻拭子),以及标本采集时间与症状出现时间的关系。
对于每项研究,我们计算了诊断指标测试的敏感性和特异性,并使用 Clopper-Pearson 方法估计 95% 置信区间。然后,我们使用 R 语言(版本 4.1.2)lme4 包中的 glmer 函数,拟合 Chu 和 Cole (1) 的随机效应双变量二项式模型来合并准确性估计值。对于纳入研究少于 5 项的分析,我们使用 R 语言(版本 4.1.2)meta 包中实现的固定效应模型来合并准确性估计值。我们使用森林图绘制个体估计值和汇总估计值,并进行亚组分析以探索异质性。
对于重复检测,我们纳入了报告对 COVID-19 患者进行重复检测结果的研究。
本指南假定存在因在社区、家庭或机构中暴露而感染 SARS-CoV-2 的风险。为了确定每个 PICO 问题的感染率,我们参考了已发表的文献并咨询了临床专家。根据每个社区过去 14 天的核酸扩增检测 (NAAT) 结果定义的感染率,已证实其会随时间变化。在本指南中,我们对无症状感染者采用了 1%、5% 和 10% 的预检概率,对有症状患者(即至少出现一种 COVID-19 常见症状的患者)采用了 5%、20% 至 50% 的预检概率( 表 1,IDSA COVID-19 诊断指南:分子诊断检测 )。这些预检概率的选择基于美国疾病控制与预防中心 (CDC) 和其他来源在疫情期间不同时期报告的 SARS-CoV-2 感染率 [3]。较高的检测前概率包括有症状的患者、居住在高流行社区的人,和/或在过去 14 天内与确诊 COVID-19 患者同住或持续接触的人。为了进行比较,我们选取了 5 项研究中采用复合参考标准的快速 RT-PCR 和实验室核酸扩增检测(NAAT)的诊断准确性作为参考标准,以此来比较抗原检测的性能[4-8]( 图 s10a、s10b )。在这 5 项研究中,每项 NAAT 的性能均与至少包含 2 种其他 NAAT 的复合参考标准进行了比较。
偏倚风险和证据确定性
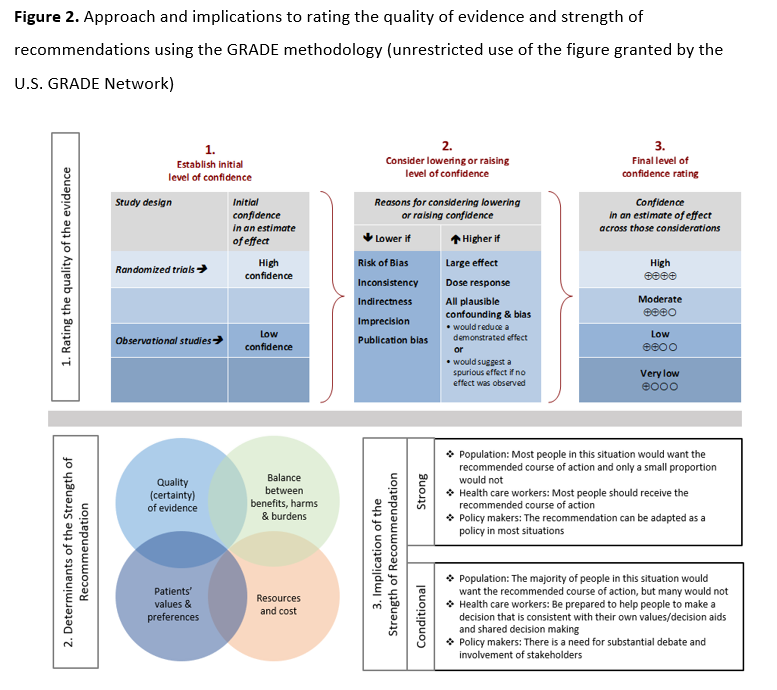
我们使用诊断准确性研究质量评估工具(QUADAS-2 修订版)( 表 S3 )[9]对诊断试验准确性研究进行了偏倚风险评估。GRADE 框架用于评估总体确定性,通过评估每个结局在以下几个方面的证据:偏倚风险、不精确性、不一致性、间接性和发表偏倚[10, 11]。如果所报告的检测策略没有直接的分析性能比较,则判定存在间接性。在决策过程中,专家组考虑了其他因素,例如检测的可行性(即可用性、便利性)、结果的及时性、成本和患病率。GRADE 结果汇总表使用 GRADEpro 指南制定工具生成[12]。
从证据到建议
专家组在决策过程中考虑了 GRADE 证据的核心要素,包括证据的确定性以及预期效果与不良效果之间的平衡。在适用的情况下,专家组也考虑了其他方面(例如可行性、资源利用、可接受性)。所有建议均由专家组成员达成共识。在专家组会议召开前,已就无法达成共识的情况制定了投票规则。
根据 GRADE 方法,推荐意见被标记为“强推荐”或“有条件推荐”。“我们推荐”表示强推荐,“我们建议”表示有条件推荐。 图 2 为患者、临床医生和医疗政策制定者提供了强推荐和弱推荐的建议解读。极少数情况下,低确定性证据也可能导致强推荐。在这些情况下,我们遵循 GRADE 工作组普遍推荐的方法,这些方法在五种典型情境中进行了概述(例如,避免灾难性伤害)[13]。对于未正式说明比较对象的推荐意见,其隐含的比较对象是“不使用该检测”。一些推荐意见承认当前存在“知识空白”,旨在避免过早地推荐使用检测方法,从而避免推广可能不准确的检测方法。
修订过程
该指南草案经 IDSA 董事会执行委员会(独立于指南制定小组)快速审查批准。该指南随后经 ASM、SHEA 和 PIDS 审查并认可。IDSA 董事会执行委员会在指南发布前对其进行了审查和批准。
更新过程
我们将定期审查相关文献和新冠疫情形势,以确定是否需要根据新数据对建议产生的影响程度进行修订。如有必要,专家组全体成员将再次召开会议,讨论可能的修改方案。
搜索结果
通过对文献进行系统回顾和前瞻性扫描,共检索到 17,334 篇参考文献,其中 95 篇为这些建议提供了证据基础( 图 s1 )。纳入研究的特征见表 s4 。
建议 1: 对有症状者进行抗原检测与不进行检测的比较
建议 1: 对于疑似感染 COVID-19 的有症状个体,IDSA 专家组建议进行一次抗原检测,而不是不进行检测 (强烈推荐,中等确定性证据)。
- 评论:
- 有症状者定义为至少出现一种 COVID-19 常见症状的人( 表 1,IDSA COVID-19 诊断指南:分子诊断检测 )。
- 为了获得最佳效果,抗原检测应在症状出现后 5 天内进行;专家组没有发现任何研究报告在症状出现的第一天或第二天进行抗原检测的效果。
- 如果临床上仍然高度怀疑 COVID-19,则应通过标准 NAAT(即快速 RT-PCR 或基于实验室的 NAAT)确认阴性抗原结果。
- 单次抗原检测具有很高的特异性;阳性结果可用于指导治疗和隔离决策,无需进一步确认。
- 关于抗原检测在儿童、免疫功能低下者或接种过疫苗者,以及曾感染过 SARS-CoV-2 的人群中的分析性能数据有限。
- 专家组未能找到研究比较根据抗原检测结果解除隔离的 COVID-19 康复患者与未进行抗原检测的患者之间的传播风险。
证据概要
我们未找到直接证据评估对有症状患者进行检测与不进行检测在患者或人群层面的结局。因此,专家组依据诊断试验的准确性数据提出了此项建议。纳入研究的参考标准为标准核酸扩增检测(NAAT)(即快速 RT-PCR 或实验室核酸扩增检测)。
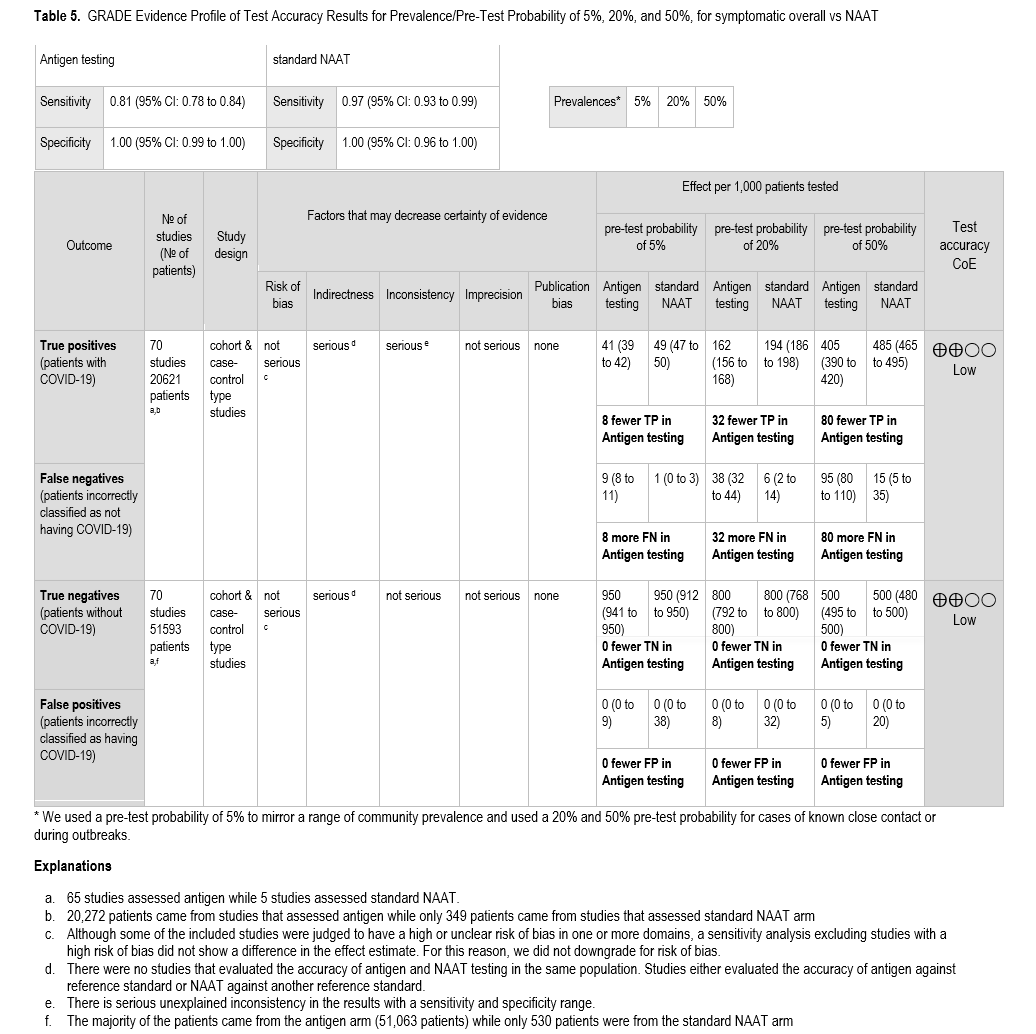
我们检索到 65 项研究 [14-77],这些研究评估了抗原检测与核酸扩增检测 (NAAT) 相比在有症状个体中的诊断准确性( 表 2 )。这些研究共纳入 20,272 名受试者用于评估敏感性,51,063 名受试者用于评估特异性。我们根据症状出现后的时间进行了亚组分析(即,≤3 天 vs. >3 天,≤5 天 vs. >5 天,以及 ≤7 天 vs. >7 天)。此外,我们还根据不同的年龄组(即,成人 vs. 儿童患者)进行了亚组分析。有症状患者的总体和亚组检测准确性数据见图 s2a – s9b 。除症状出现后时间的评估外,汇总的诊断准确性指标在所有亚组或敏感性分析中均无差异,症状出现 5 天或 7 天后,抗原检测的敏感性降低。既往研究并未单独报告免疫功能低下、疫苗接种或既往 COVID-19 感染对诊断准确性的影响。我们检索了明确指出纳入了 SARS-CoV-2 变异株的研究,并尝试根据样本采集日期推断变异株的纳入情况。仅找到一项研究;该研究报告称,几种快速抗原检测方法对 Omicron 变异株的检测灵敏度低于 Delta 变异株 [78]。我们也未能找到比较 COVID-19 康复患者中,根据抗原检测结果解除隔离与未进行抗原检测结果解除隔离的传播风险的研究。
我们分析了患者出现症状前、后 3 天、5 天和 7 天采集的样本的诊断检测准确性。选择 3 天是因为担心抗原检测在症状出现后不久的敏感性较低;我们未能找到报告仅在症状出现第一天或第二天采集的样本进行检测的研究。选择 5 天是因为几种 COVID-19 治疗方案已获得紧急使用授权(EUA),可在症状出现后 5 天内开始治疗。选择 7 天是因为许多评估的抗原检测已获得 EUA,可在症状出现后 7 天内使用。
汇总敏感性为 81%(95% CI:78% 至 84%),汇总特异性为 100%(95% CI:100% 至 100%)。由于报告的检测性能存在无法解释的不一致性,即使是相同的抗原检测、相同的样本来源以及症状出现时间相近的情况,敏感性的证据确定性也为中等。特异性的证据确定性为高。
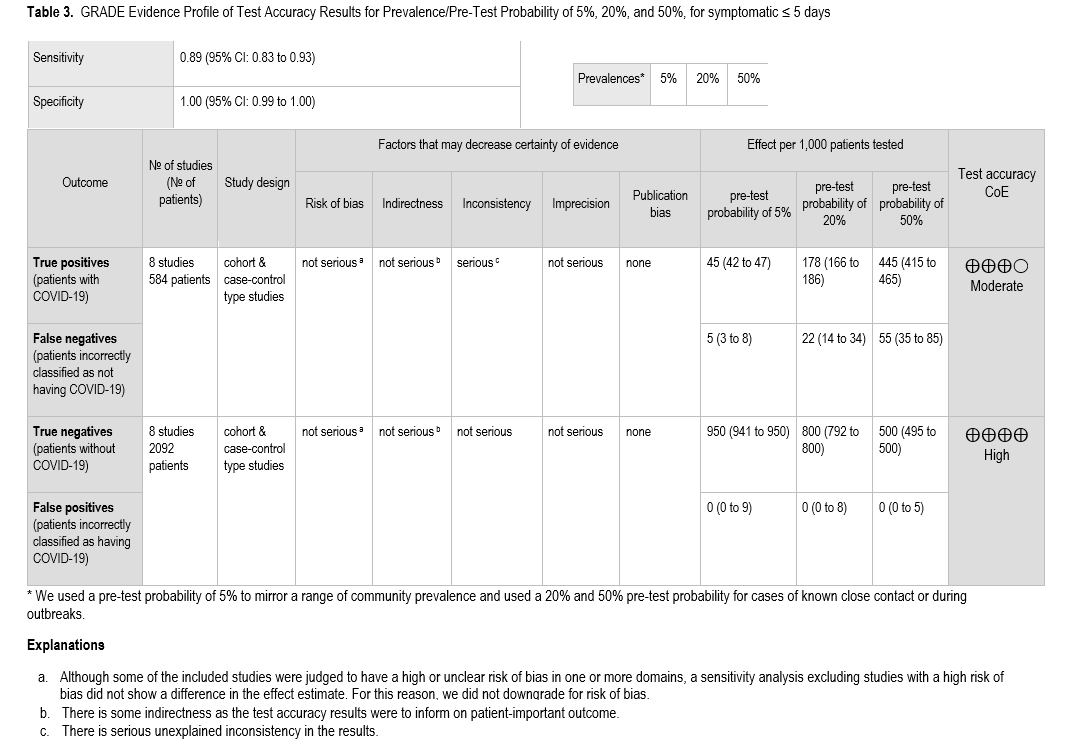
对于症状持续时间≤5 天的患者亚组,纳入了 8 项研究[30, 32, 34, 36, 53, 63, 65, 67],基于标准核酸扩增检测(NAAT),共获得 584 例阳性结果和 2092 例阴性结果。该组的汇总敏感性为 89%(95% CI:83%~93%),汇总特异性为 100%(95% CI:99%~100%)。由于存在无法解释的不一致性,敏感性的证据确定性为中等,而特异性的证据确定性为高( 表 3 )。对于症状持续时间≤3 天的患者亚组,结果相似(即,与标准 NAAT 相比,我们未观察到敏感性或特异性的降低)( 图 s7a、s7b )。
对于症状出现 5 天后接受检测的患者子集,纳入了 15 项研究,基于标准核酸扩增检测(NAAT),共包含 1076 例阳性患者和 4933 例阴性患者。该组的汇总敏感性为 54%(95% CI:44%至 64%),汇总特异性为 100%(95% CI:99%至 100%)( 图 S4a )。由于存在无法解释的不一致性,敏感性的证据确定性较低,而特异性的证据确定性较高。症状出现 7 天后采集的样本的分析结果与症状出现 5 天后采集的样本的结果相似( 表 4 )。
益处和危害
专家组认为,对有症状的患者进行 COVID-19 诊断对个人和社会均有益。确定 SARS-CoV-2 是导致个体症状的病原体,可以影响对感染者启动治疗和隔离的决策,以及接触者追踪和检疫的决策。单次抗原检测的敏感性取决于检测时间与症状出现时间的相对关系,在症状出现早期检测的敏感性更高。在症状出现后 5 天内进行的抗原检测,假阴性率在 5% 的患病率下为每 1000 名受检者 5 例(范围:3 至 8 例),在 50% 的患病率下为每 1000 名受检者 55 例(范围:35 至 85 例)。如上所述,症状出现后 3 天内进行的单次抗原检测结果与症状出现后 5 天内进行的检测结果相似,但专家组未能找到症状出现后第 1 天或第 2 天进行的检测报告。症状出现 5 天后对有症状者进行抗原检测,其敏感性显著降低至 54%(95% CI:44%至 64%),真阳性和假阴性结果的数量几乎相等。假阴性结果可能导致未能对需要治疗的有症状患者进行治疗,从而可能导致患者预后不良。假阴性结果还可能导致未能隔离感染者或隔离密切接触者,从而可能增加 SARS-CoV-2 病毒进一步传播的风险。鉴于这些潜在的患者危害,对于持续疑似 COVID-19 的人员,即使检测结果为阴性,也应立即使用标准核酸扩增检测(NAAT)进行确认。
相比之下,无论症状出现后多久进行检测,抗原检测的特异性都接近 100%。目前推荐的治疗方案是在症状出现后 5 天内开始。在此期间进行的抗原检测几乎没有假阳性结果,即使 COVID-19 的感染率低至 5%(每 1000 名受检患者中假阳性结果为 0,范围为 0 至 9)。这表明,在症状出现后的前 5 天内进行抗原检测,对于检测结果呈阳性且符合治疗条件的有症状患者,可以获得可指导治疗的结果。抗原检测的高特异性使得因假阳性结果而导致不当治疗的风险极低。
针对有症状的儿科患者的研究较少,但现有数据显示,总体敏感性与成人相当(80%,95% CI:74% 至 86%),总体特异性也接近 100%(95% CI:94% 至 100%)。根据患病率,每 1000 名受检儿童中假阴性结果的数量在 10 至 100 例之间。专家组未能找到足够的研究,因此无法根据儿童症状持续时间对检测性能进行可靠的比较。
其他考虑因素
尽管美国传染病学会 (IDSA) 专家组建议对出现疑似 COVID-19 症状的患者进行抗原检测,但在某些情况下,对有症状者进行检测可能并非必要。例如,一位年轻、已接种疫苗、身体健康、出现症状但不符合治疗条件且选择在未确诊的情况下进行隔离的成年人,可能无需接受检测。此外,SARS-CoV-2 培养阳性与抗原检测结果之间的相关性并不完美,因此不能仅凭抗原检测阳性结果来预测传染性。尽管如此,阴性的抗原检测结果并不能排除传染性,但阳性结果会增加传染的可能性。
本建议的结论和研究需求
对于有症状的个体,抗原检测呈阳性对 COVID-19 具有较高的阳性预测值,可用于指导患者的治疗和隔离、接触者追踪以及检疫等决策。抗原检测呈阴性的阴性预测值较低,难以排除 COVID-19 感染。对于抗原检测结果为阴性但仍有症状且尚未确诊其他疾病的个体,应立即使用标准核酸扩增检测 (NAAT) 进行 SARS-CoV-2 检测。
关于变异毒株、免疫功能低下宿主状态、疫苗接种和/或既往 COVID-19 感染对抗原检测分析准确性的影响,仍存在疑问,包括最佳样本来源(例如,前鼻孔与咽拭子)和检测时间(例如,症状出现第 1 天或第 2 天进行抗原检测的敏感性)[79]。此外,对于婴幼儿(例如 6 个月以下的婴儿)的抗原检测性能,目前也知之甚少。这一点尤其值得关注,因为这些人群无法佩戴口罩,且不符合目前可用的 COVID-19 疫苗的接种条件。
专家组发现一些研究[80-83]报告称,抗原检测与病毒培养的阳性符合率高于标准核酸扩增检测(NAAT)与病毒培养的符合率,但未发现任何实证证据能够说明抗原检测结果是否能预测传染性(以传播能力衡量)。此外,IDSA 专家组也未发现任何实证证据支持使用抗原检测结果来指导 COVID-19 患者解除隔离。鉴于这种广泛做法的后果(包括成本),需要开展研究以确定传染性标志物。确保服务不足的人群(包括种族和少数族裔群体)平等地获得准确、经济、及时的 SARS-CoV-2 诊断检测应是当务之急[83]。
建议 2:对有症状个体进行抗原检测与标准核酸扩增检测的比较
建议 2: 对于疑似患有 COVID-19 的有症状个体,IDSA 专家组建议使用标准 NAAT(即快速 RT-PCR 或基于实验室的 NAAT)而不是快速抗原检测 (有条件推荐,证据确定性低) 。
- 评论:
- 如果标准 NAAT 不可用或预计结果会延迟一天以上,IDSA 专家组建议使用快速抗原检测而不是标准 NAAT。
- 为了获得最佳效果,抗原检测应在症状出现后五天内进行;专家组未能找到任何研究报告在症状出现后 2 天内进行抗原检测的结果。
- 专家组未能找到研究比较根据抗原检测结果解除隔离的 COVID-19 康复患者与根据标准 NAAT 检测结果解除隔离的患者的传播风险。
证据概要
由于缺乏直接证据比较抗原检测和标准核酸扩增检测(NAAT)与第三种参考标准,我们采用了以标准 NAAT 为参考标准的抗原检测诊断准确率数据。为了计算标准 NAAT 的诊断准确率,我们汇总了 5 项研究[84-88]的结果,这些研究报告了标准 NAAT 结果与复合参考标准的比较( 图 s10a、s10b )。该分析得出的灵敏度为 97%(95% CI:93%至 99%),特异性为 100%(95% CI:96%至 100%)。
我们总结了所有有症状患者(症状出现后任何一天)的证据( 表 2 )、症状出现后 5 天以内的患者( 表 3 )以及症状出现后 5 天以上的患者( 表 4 )。其他亚组包括:症状出现后 7 天以内的患者( 图 S5a 和 S5b )以及症状出现后 7 天以上的患者( 图 S6a 和 S6b )。之所以选择 5 天作为分界点,是因为几种常用的 COVID-19 疗法已获得紧急使用授权(EUA),可在症状出现后的前 5 天内开始治疗。之所以选择 7 天作为分界点,是因为许多现有的快速抗原检测已获得紧急使用授权,可在症状出现后 7 天内使用。
为了进行比较,我们纳入了 70 项研究,其中 65 项研究为抗原检测提供了信息[14-77, 89],5 项研究[84-88](如上文所述)为标准核酸扩增检测(NAAT)提供了信息,共计 20,621 例阳性结果和 51,593 例阴性结果( 表 5 )。抗原检测的汇总敏感性为 81%(95% CI:78%至 84%),汇总特异性为 100%(95% CI:100%至 100%)。当 SARS-CoV-2 感染率在 5%至 50%之间时,与 NAAT 相比,抗原检测会产生额外的 8 至 80 例假阴性结果。纳入标准 NAAT 与复合参考标准比较的 5 项研究的患者与纳入抗原检测与标准 NAAT 比较的 65 项研究的患者不同;因此,标准 NAAT 和抗原检测性能的比较是间接的,这严重降低了证据确定性的可信度。因此,由于间接性和无法解释的不一致性,证据的敏感性确定性较低;由于间接性,证据的特异性也较低。
益处和危害
专家组认为,尽量减少有症状患者的 COVID-19 假阴性诊断数量是当务之急。与复合参考标准相比,标准核酸扩增检测(NAAT)的灵敏度高于快速抗原检测(Ag)与标准 NAAT 的灵敏度之比。在 COVID-19 疫情高峰期,当社区 SARS-CoV-2 流行率较高(例如 50%)时,与标准 NAAT 相比,单次 Ag 检测导致每 1000 名受检患者中假阴性结果多 80 例。如果在症状出现后 5 天内进行 Ag 检测,假阴性结果降至每 1000 名受检患者 40 例;但如果在症状出现 7 天后进行检测,假阴性结果则增至每 1000 名受检患者 215 例。在非疫情高峰期,当有症状人群的社区流行率较低时,假阴性结果的数量也相对较低。在 20%的患病率下,每 1000 名在症状出现后 5 天内进行抗原检测的人中,假阴性结果比标准核酸扩增检测(NAAT)多 16 例;如果在症状出现 5 天后进行抗原检测,则假阴性结果比标准 NAAT 多 86 例。因此,与单次标准 NAAT 相比,单次抗原检测可能导致更多的假阴性结果。
然而,专家组也高度重视检测的可及性和结果的及时性。进行标准的核酸扩增检测(NAAT)通常需要前往检测点,且结果可能需要几天才能出来。这种延迟可能导致患者错过抗病毒治疗窗口期,该窗口期通常为症状出现后的 5 天内。COVID-19 诊断检测的漫长等待时间会导致感染患者的隔离、密切接触者的追踪和隔离工作延误,从而可能进一步传播 COVID-19。另一方面,对于最终检测结果为阴性的患者,漫长的等待时间也可能导致不必要的居家隔离和缺勤。与标准的 NAAT 相比,抗原检测通常更容易获得,结果通常在检测后 15 分钟内即可报告,而且患者可以在家进行抗原自测。基于这些考虑,IDSA 专家组建议,如果标准的 NAAT 结果延迟超过一天,则应采用快速抗原检测。
抗原检测特异性极高,阳性结果可立即采取相应措施。由于其敏感性较低,若临床高度怀疑 COVID-19,则阴性抗原检测结果应使用标准核酸扩增检测(NAAT)进行确认。尤其对于需要接受 COVID-19 治疗的患者,应在症状出现后 5 天内进行抗原检测,以最大程度地减少假阴性结果,并确保患者在治疗窗口期内得到诊断。
其他考虑因素
由于结果准确,标准核酸扩增检测(NAAT,例如快速 RT-PCR 或实验室 NAAT)是诊断病毒性呼吸道感染的金标准 。 然而,在 COVID-19 疫情期间,SARS-CoV-2 标准 NAAT 的可用性和及时性往往不足。疫情期间,联邦政府对抗原检测的补贴政策有所调整,截至 2022 年 9 月,政府不再应要求提供免费的家用检测试剂盒。自同一日期起,保险公司被要求报销每位参保人每月最多八次抗原检测的费用。未参保人员仍可通过当地或州公共卫生部门、社区项目和非营利组织以及经联邦医疗保险认证的诊所获得免费的家用抗原检测试剂盒。这些项目可能服务于农村地区的家庭和传统上就医困难的弱势群体(尽管专家组并未评估抗原检测的可及性)。目前,无论是在国家层面还是地方层面,公共卫生部门都在大力努力,以确保能够继续获得检测,并使用抗原检测作为主要检测方式,因为它可以在家里进行,需要的技术专长很少,而且与标准核酸扩增检测相比价格相对便宜。
本建议的结论和研究需求
对于有症状的患者,IDSA 专家组建议使用标准核酸扩增检测(NAAT)而非快速抗原检测,因为前者灵敏度更高,从而降低漏诊 SARS-CoV-2 感染的风险。然而,尽管抗原检测的灵敏度较低,但由于其操作简便、出结果迅速、成本低廉且易于获取,仍将继续使用。在出现症状后的前 5 天内进行检测可最大程度地提高抗原检测的灵敏度。如果使用抗原检测对有症状者进行检测,且临床上仍高度怀疑 COVID-19,并且尚未得出其他诊断,则阴性结果应使用标准 NAAT 进行确认。另一方面,鉴于抗原检测的高特异性,阳性结果无需常规确认。
随着新变异株的出现,抗原检测的性能可能会发生变化。因此,监测抗原检测在诊断新变异株 COVID-19 方面的性能至关重要[79]。需要开展研究,以识别能够提高灵敏度并保持特异性的表位结合区域。更好地了解影响抗原检测的蛋白质折叠突变将有助于检测厂商开发更可靠的检测方法。其他需要研究的因素包括:针对不同变异株和不同样本来源(例如,前鼻孔与咽拭子)检测 SARS-CoV-2 的最佳时间,以及抗原检测与多重分子检测的性能比较。最后,尽管设计和实施难度较大,但设计严谨的临床试验,比较单一抗原检测与标准核酸扩增检测(NAAT)在治疗和传播结果方面的差异,将为本建议提供直接证据。确保服务不足的人群(包括种族和少数族裔群体)平等地获得准确、经济、及时的 SARS-CoV-2 诊断检测,应是当务之急。
建议 3:对有症状者进行重复快速抗原检测 ,而非单次标准核酸扩增检测。
建议 3: 对于疑似感染 COVID-19 的有症状个体,IDSA 专家组建议使用单一标准 NAAT(即快速 RT-PCR 或基于实验室的 NAAT),而不是连续进行两次快速抗原检测的策略 (有条件建议,证据确定性非常低) 。
- 评论:
- 如果 NAAT 结果不能及时获得,且第一次抗原检测结果为阴性,IDSA 专家组建议重复进行抗原检测。
- 由于缺乏直接证据来解答这个问题,因此进行的分析是基于使用重复测试算法对诊断测试准确性进行建模,该算法涉及两次连续的抗原测试。
- 为了优化灵敏度,应在症状出现后 5 天内进行重复测试;专家组未能找到任何报告在症状出现后 2 天内进行测试结果的研究。
- 如果第一次抗原检测结果为阳性,则无需重复检测。
证据概要
尚无直接证据将连续抗原检测与标准核酸扩增检测(NAAT,即快速 RT-PCR 或实验室 NAAT)与第三种参考标准进行比较。因此,我们采用重复检测算法进行建模分析。并将建模分析结果与标准 NAAT 的诊断准确性进行比较。所有比较中,SARS-CoV-2 感染在有症状人群中的患病率分别设定为 10%、20%和 50%。模型预测,症状出现后 5 天内进行抗原检测和重复抗原检测(共 2 次抗原检测)的敏感性和特异性分别为 98%(95% CI:97%至 99%)和 100%(95% CI:99%至 100%)。对于标准 NAAT 诊断准确性数据,我们汇总了 5 项研究[84-88]的结果,这些研究报告了标准 NAAT 结果与综合参考标准的比较( 图 s10a、s10b )。该分析得出的敏感性为 97%(95% CI:93% 至 99%),特异性为 100%(95% CI:96% 至 100%)。比较两种检测策略,根据疾病流行情况,重复抗原检测预计可减少 0 至 5 例假阴性结果(与标准核酸扩增检测相比)。在症状出现后 7 天内进行首次抗原检测以及在症状出现 7 天后进行重复检测的模型敏感性和特异性分别为 93%(95% CI:89% 至 96%)和 100%(95% CI:99% 至 100%)。比较两种检测方式,根据疾病流行情况,重复抗原检测预计比标准核酸扩增检测多 2 至 20 例假阴性结果。抗原检测和症状出现后前 5 天重复抗原检测的敏感性和特异性分别为 75%(95% CI:69% 至 86%)和 100%(95% CI:99% 至 100%)。 对比两种检测方式发现,与标准 NAAT 相比,重复抗原检测会产生 11 至 110 个假阴性结果,具体数值取决于 COVID-19 的流行程度。
由于结果的间接性和不一致性,灵敏度和特异性的确定性分别很低。间接性源于连续抗原检测的结果基于模型分析,而用作对照的标准核酸扩增检测(NAAT)结果则基于原始患者数据。此外,由于人群不同,重复检测与标准 NAAT 检测之间的比较也是间接的。最初的单次抗原检测研究中存在严重的、无法解释的不一致性。
益处和危害
抗原检测结果通常在一小时内即可获得(例如,15 分钟内),而核酸扩增检测(NAAT)结果的获得时间则可能因多种因素而异,例如检测点的接收时间、检测开始前的延误、单个检测仪器的运行时间以及从结果获取到最终交付的时间。COVID-19 诊断的延误可能导致检测结果呈阳性的患者无法获得可能挽救生命的治疗,并由于感染患者的隔离、接触者追踪和密切接触者的隔离延误,使其他人面临感染 SARS-CoV-2 的风险。另一方面,过长的检测周期可能会延长 SARS-CoV-2 检测结果呈阴性者的不必要隔离期。虽然重复进行抗原检测可能是一种更快的选择,但根据定义,这意味着初始检测结果为阴性,但受检者仍可能已被感染。
其他考虑因素
对于有症状的个体,推荐的检测方法是核酸扩增检测 (NAAT)。然而,NAAT 检测的可及性可能有限(例如,周末和节假日),且费用高于抗原检测 (Ag 检测),因此在某些情况下,抗原检测可能是更优的选择。此外,如果没有快速可靠的系统将检测结果传达给医护人员和患者,标准 NAAT 的出结果时间可能会延迟。最终,具体情况(例如,高风险患者、疫情暴发环境、长期护理机构、高度临床怀疑、COVID-19 病例激增、既往 COVID-19 病史、疫苗接种史)可能会影响选择进行抗原检测还是标准 NAAT。最后,在除 SARS-CoV-2 以外的其他呼吸道病毒(例如,流感病毒、呼吸道合胞病毒 [RSV])流行的环境中,可能需要进行多重分子呼吸道病原体检测。
本建议的结论和研究需求
尽管美国传染病学会 (IDSA) 专家组建议,对于有症状的个体,诊断 SARS-CoV-2 感染时,应采用单次标准核酸扩增检测 (NAAT) 而非两次连续的抗原检测 (Ag),但目前尚缺乏直接比较两次连续快速抗原检测与单次标准 NAAT 检测在患者中应用效果的研究,而此类研究亟需开展。此类研究应纳入已接种疫苗、加强免疫和未接种疫苗的人群,以及既往感染过 COVID-19 和未感染过 COVID-19 的人群,以及感染了当前 SARS-CoV-2 变种(例如 Omicron)的人群。此外,对于既往感染过 COVID-19 的人群,应考虑首次感染与潜在后续感染之间的时间间隔,因为如果既往感染发生在近期,则检测结果可能仍呈阳性,而并非代表新的感染;在这种情况下,需要明确标准 NAAT 检测与抗原检测的特异性差异。重复抗原检测之间的理想时间间隔也需要确定。
建议 4:对已知接触过 SARS-CoV-2 的无症状个体进行抗原检测与不进行检测的比较
建议 4: 对于已知接触过 SARS-CoV-2 感染的无症状个体,IDSA 专家组建议在特定情况下使用单次(即一次性)抗原检测,而不是不进行检测 (有条件建议,中等确定性证据) 。
- 评论:
- 对于无新冠肺炎样症状者,应根据个体情况进行 SARS-CoV-2 检测。如果检测结果会影响个人的后续行动,则可考虑进行一次性抗原检测。例如,在以下情况下,可考虑进行单次检测:对于新冠肺炎重症高风险人群,阳性检测结果将促使加强对其症状和感染体征的监测;或者在疫情暴发的情况下,阳性结果有助于制定隔离、检疫和接触者追踪等决策。
- 抗原检测结果为阴性可降低感染的可能性。然而,检测时间越长,这种可能性降低的幅度就越小,尤其是在感染初期病毒复制迅速的时候。也就是说,今天的阴性检测结果可能无法反映明天或之后几天的感染状况。相比之下,阳性检测结果具有较高的阳性预测值。
- 专家组承认缺乏证据支持对无症状患者进行治疗,也没有通过紧急使用授权批准用于治疗无症状 COVID-19 的疗法,但承认个别临床情况可能会促使临床医生进行检测并考虑治疗。
证据概要
尚无直接证据评估对已知接触过新冠病毒的无症状个体进行检测与不进行检测的患者预后。因此,我们依据诊断检测的准确性数据提出此项建议。所有纳入分析的研究均采用标准核酸扩增检测(NAAT)作为参考标准。
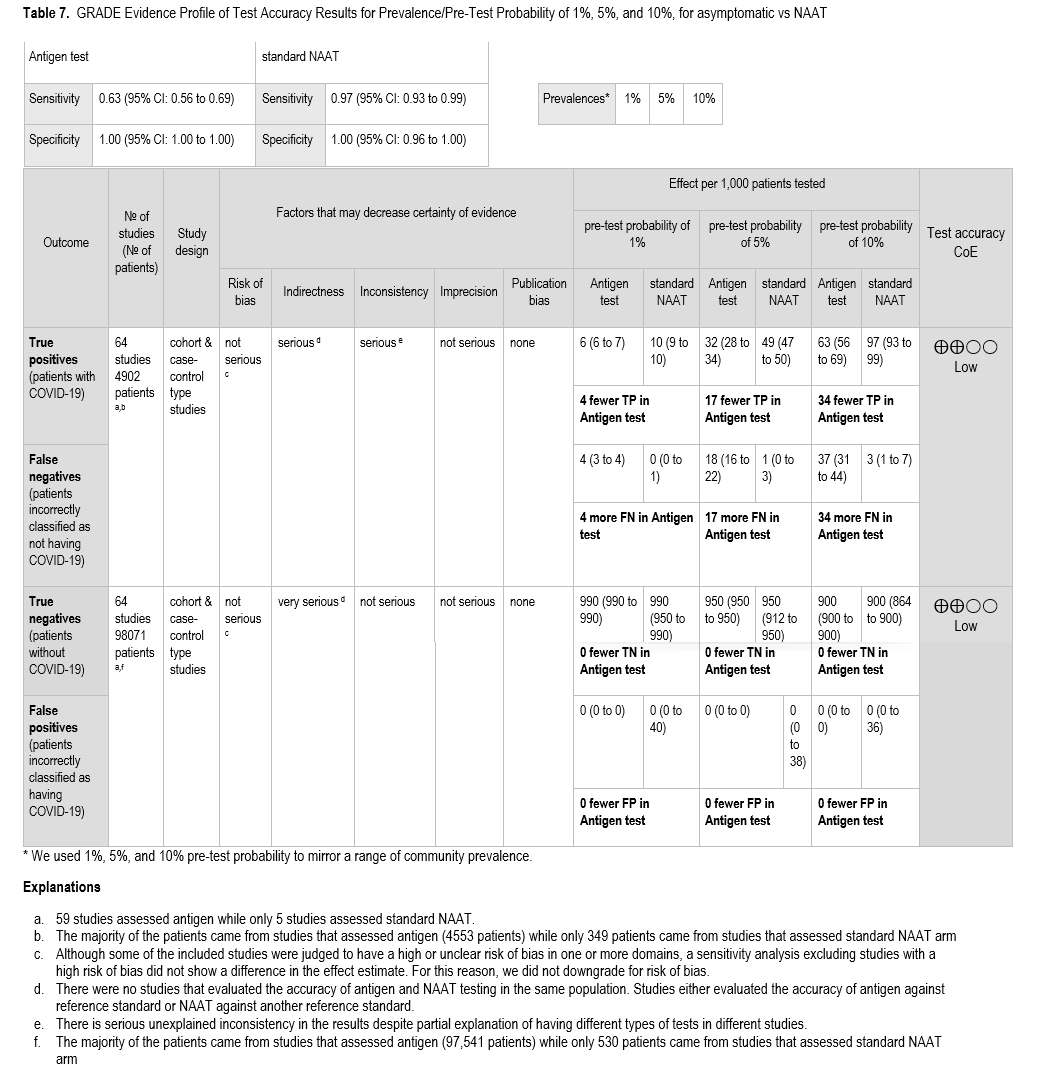
本研究纳入了 59 项研究[4-8, 15, 17-22, 24-28, 31, 33, 34, 36, 40, 41, 46, 47, 49, 51-53, 55, 57-59, 61, 63-67, 69, 70, 72, 73, 90-105],基于分子检测结果,共获得 4,553 例阳性患者和 97,541 例阴性患者,用于支持本建议。汇总敏感性为 63%(95% CI:56%至 69%),汇总特异性为 100%(95% CI:100%至 100%)( 表 6 )。 IDSA 专家组考虑了 1%、5%和 10%作为已知暴露史的无症状患者中 COVID-19 的患病率。在儿科人群中,这些数值相似,敏感性为 62%(95% CI:53%至 70%),特异性为 99%(95% CI:99%至 100%)( 图 s13a、 s13b )。由于存在无法解释的不一致性,敏感性的证据确定性为中等,而特异性的证据确定性为高。未报告其他结果。未报告暴露类型或暴露时间与检测时间的关系。
益处和危害
专家组高度重视尽量减少假阴性结果的数量,尤其是在高风险的医疗机构中。虽然理论上,如果单次抗原检测呈阳性并能隔离检测呈阳性者,则可能有助于减少 SARS-CoV-2 的暴露,但专家组并未发现任何证据表明使用抗原检测能够降低 SARS-CoV-2 的传播。此外,不建议对无症状感染者进行治疗。抗原检测结果呈阴性可能会给人造成不具传染性的错觉。快速抗原检测的使用者可能并不了解阴性检测结果的局限性。在一项研究中,三分之二的参与者在快速抗原检测结果呈阴性后的第二天认为自己不具传染性[106]。此外,检测的敏感性与暴露时间有关;在感染早期,阴性检测结果可能在数小时内转为阳性[80, 82]。
专家组考虑了多种 SARS-CoV-2 感染率,并以标准核酸扩增检测(NAAT)作为参考标准。当 SARS-CoV-2 感染率为 1%时,抗原检测真阳性结果数量较少,与假阴性结果数量大致相当(即每 1000 名无症状感染者中,真阳性 6 例,假阴性 4 例)( 表 6 )。在决定是否进行无症状检测时,社区和机构应权衡检测所需的资源与发现少量 SARS-CoV-2 感染真病例的益处,尤其是在无论检测结果如何,人们都会遵守佩戴口罩和保持社交距离等感染预防策略的情况下。随着感染率的增加,检测的潜在效用也随之增加,当感染率为 10%时,检测到 63 例真阳性(95% CI:56-69)和 37 例假阴性(95% CI:31-44)( 表 6 )。相比之下,无论疾病的真实患病率在 1% 到 10% 之间,假阳性结果的数量估计为 0。在大多数情况下,似乎没有必要对抗原检测阳性结果进行常规确认。
其他考虑因素
对于本 PICO 问题,以下考虑因素和假设需要明确说明:(1) 目前尚无 FDA 批准的针对无症状 COVID-19 的治疗方案;(2) IDSA COVID-19 诊断小组假设通过检测识别无症状感染者可能是有益的;(3) 该小组假设无症状感染者在其感染期间的某个阶段可能具有传染性;(4) 该小组未发现直接证据表明对无症状感染者进行 SARS-CoV-2 检测可以降低传播风险。
目前尚不清楚市售抗原检测方法在检测不同 SARS-CoV-2 变种病毒时是否具有可比性。对于暴露于 SARS-CoV-2 病毒的高危无症状人群,如果当前流行的变种病毒获得紧急使用授权(EUA),则暴露后单克隆抗体预防可能是一种替代检测的方案[107]。对用户进行快速抗原检测结果解读方面的教育,包括其局限性,对于确保在检测结果呈阳性或阴性后采取适当的措施至关重要。
本建议的结论和研究需求
是否进行快速抗原检测应根据个体情况而定。鉴于抗原检测的灵敏度相对较低,需要考虑的因素包括:识别出新冠肺炎病例的潜在益处与报告假阴性结果的潜在危害。通过识别无症状感染者来降低传播的可能性应与检测所需的资源进行权衡,并应考虑随着疫苗接种率提高或有效感染预防措施(例如佩戴口罩)的广泛采用而导致的流行率变化。抗原检测可能有助于指导疫情暴发期间的防控工作。还需要进一步研究以评估抗原筛查是否能降低不同场所(包括学校和非医疗工作场所)的传播。
建议 5:对已知接触过 SARS-CoV-2 的无症状个体进行抗原检测与标准核酸扩增检测 (NAAT) 的比较
建议 5: 对于已知接触过 SARS-CoV-2 感染的无症状个体,IDSA 专家组建议使用单一标准 NAAT(即快速 RT-PCR 或基于实验室的 NAAT),而不是单一快速抗原检测 (有条件推荐,证据确定性低) 。
- 评论:
- 对于无新冠肺炎样症状者,应根据个体情况进行 SARS-CoV-2 检测。如果检测结果会影响个人的后续行动,则可考虑进行一次性标准核酸扩增检测(NAAT)。例如,对于新冠肺炎重症高风险人群,如果检测结果呈阳性,则需加强对其症状和体征的监测;或者在疫情暴发的情况下,如果阳性结果有助于制定隔离、接触者追踪和检疫等决策,则可考虑进行单次检测。
- 在某些情况下,可能无法及时获得标准 NAAT 检测结果;在这种情况下,可以考虑使用抗原检测。
- 专家组承认缺乏证据支持对无症状感染者进行 COVID-19 治疗,也没有通过紧急使用授权批准用于治疗无症状 COVID-19 的疗法,但承认个别临床情况可能会促使临床医生进行检测并考虑治疗。
证据概要
尚无研究报告无症状人群中抗原检测与不检测的患者或人群结局。因此,专家组依据诊断试验准确性数据提出此项建议。纳入研究的参考标准为标准核酸扩增检测(NAAT)(即快速 RT-PCR 或实验室 NAAT)。为计算标准 NAAT 参考标准,我们汇总了 5 项研究[84-88]的结果,这些研究比较了标准 NAAT 结果与复合参考标准( 图 S10a、S10b )。该比较显示,汇总灵敏度为 97%(95% CI:93%至 99%),特异性为 100%(95% CI:96%至 100%)。IDSA 专家组考虑了 1%、5%和 10%作为已知暴露于 COVID-19 的无症状患者的患病率( 表 7 )。
针对此 PICO 问题,我们纳入了 64 项研究:59 项研究为抗原检测提供信息[4-8, 15, 17-22, 24-28, 31, 33, 34, 36, 40, 41, 46, 47, 49, 51-53, 55, 57-59, 61, 63-67, 69, 70, 72, 73, 90-105],5 项研究为标准核酸扩增检测(NAAT)提供信息,共包含 4902 例阳性患者和 98071 例阴性患者[84-88]。抗原检测的汇总敏感性为 63%(95% CI:56%至 69%),汇总特异性为 100%(95% CI:100%至 100%)( 图 s12a 和 s12b )。这项比较显示,当流行率在 1%至 10%之间时,抗原检测会产生 4 至 34 例额外的假阴性结果。接受标准核酸扩增检测(NAAT)的患者与接受抗原检测的患者不同;因此,比较是间接的,降低了证据确定性的可信度。由于间接性和无法解释的不一致性,敏感性的证据确定性非常低;由于间接性,特异性的证据确定性也很低。
益处和危害
与标准核酸扩增检测 (NAAT) 相比,抗原检测对无症状感染者 SARS-CoV-2 的检出敏感性较低,且抗原检测的检测窗口期也较窄。然而,抗原检测的特异性远高于标准 NAAT,接近 100%( 表 7 )。因此,使用抗原检测代替标准 NAAT 的潜在危害在于可能出现假阴性结果。在医疗机构等高风险环境中,抗原检测假阴性结果的危害尤为严重,因为在大型择期手术前未能诊断出无症状感染者可能会增加患者围手术期发生不良事件的风险[108, 109]。值得注意的是,由于方法学上的挑战以及这些研究是在 COVID-19 疫苗广泛接种之前进行的,其当前的参考价值可能有限[110]。 SARS-CoV-2 抗原检测的假阴性结果也可能导致 SARS-CoV-2 传播给医院或长期护理机构的其他患者、居民和工作人员,尤其是在感染预防措施(如戴口罩)取决于检测结果的情况下。
其他考虑因素
对于本问题(涉及无症状感染者),以下几点考虑和假设需要阐明:(1) 目前尚无 FDA 批准的针对无症状感染者的治疗方案;(2) IDSA COVID-19 诊断专家组假设无症状感染者在其感染过程中的某个阶段具有传染性;(3) IDSA 专家组假设通过检测识别已感染的无症状感染者可能是有益的;(4) 专家组未发现直接证据表明对无症状感染者进行 SARS-CoV-2 检测能够降低传播风险。
本建议的结论和研究需求
大量假阴性检测结果可能会削弱公共卫生部门控制 COVID-19 疫情的努力,并可能对医疗机构和人员聚集场所(尤其是长期护理机构)造成最大的潜在危害。与目前可用的抗原检测相比,标准核酸扩增检测 (NAAT) 能检测出更多 SARS-CoV-2 感染病例,并通过对检测呈阳性者进行有针对性的隔离、追踪密切接触者以及隔离密切接触者,提供更多预防传播的机会。当社区中无症状感染的流行率处于中高水平(即 ≥ 5%)时,标准 NAAT 的卓越性能预计将发挥最大作用。然而,在一些流行率较低且无法使用标准 NAAT 的情况下,使用灵敏度较低的快速抗原检测仍然可能有所帮助。抗原检测预计可在病毒载量较高时检测到感染。此外,鉴于在对无症状感染者的研究中观察到抗原检测具有较高的特异性,在大多数情况下无需对阳性结果进行常规确认。需要开展大规模研究,评估抗原检测与 RNA 检测在 SARS-CoV-2 传播事件中的价值,尤其是在疫苗接种覆盖率和既往感染人数增加的情况下。开发具有更高分析灵敏度的新型抗原检测方法具有重要意义。
建议 6:对已知接触过 SARS-CoV-2 的无症状个体进行重复抗原检测 ,并与单次标准核酸扩增检测进行比较
建议 6: 对于已知接触过 SARS-CoV-2 的无症状个体,如果无法及时获得标准 NAAT 检测或结果,且第一次抗原检测结果为阴性,IDSA 专家组建议重复进行抗原检测 (有条件建议,证据确定性非常低) 。
- 评论:
- 由于缺乏直接证据来解答这个问题,因此进行的分析是基于使用重复测试算法对诊断测试准确性进行建模,该算法涉及两次连续的抗原测试。
证据概要
尚无直接证据比较两种抗原检测与单次标准核酸扩增检测(NAAT)联合第三参考标准,且所分析的数据也未比较无症状 COVID-19 暴露人群中重复抗原检测与标准 NAAT 的准确性。因此,本研究采用重复检测算法(两次连续检测)进行建模分析,并将建模分析结果与标准 NAAT 的诊断准确性进行比较。所有比较均假设无症状人群中 SARS-CoV-2 的感染率为 1%、5%和 10%。暴露人群中无症状感染的患病率部分取决于暴露的性质,其中家庭接触是风险最高的环境之一(例如,无症状 COVID-19 继发病例的患病率可达 10%)[111, 112]。抗原检测和重复检测的敏感性和特异性分别建模为 86%(95% CI:80% 至 90%)和 100%(95% CI:99% 至 100%)。对于标准核酸扩增检测 (NAAT) 诊断准确性数据,我们汇总了 5 项研究 [84-88] 的结果,这些研究报告了 NAAT 结果与综合参考标准的比较( 图 s10a、s10b )。结果显示,敏感性为 97%(95% CI:93% 至 99%),特异性为 100%(95% CI:96% 至 100%)。比较两种检测策略,根据疾病流行率的不同,重复抗原检测的假阴性结果比标准 NAAT 多 1 至 11 个。
由于结果的间接性和不一致性,灵敏度和特异性的证据确定性均很低。间接性源于结果基于模型分析而非原始人体检测数据。此外,重复检测与标准核酸扩增检测(NAAT)之间的比较也是间接的,因为所用数据来自不同的人群。原始单次抗原检测结果中也存在严重的、无法解释的不一致性。
益处和危害
对无症状感染者进行暴露后检测的理论益处在于能够早期诊断感染,从而实现早期治疗;然而,IDSA 专家组指出,目前在这种情况下,尚无针对无症状 COVID-19 的特定治疗方案,因为目前尚无 FDA 批准或紧急使用授权(EUA)的疗法。另一项理论益处是预防 SARS-CoV-2 的传播,但我们未能找到将 SARS-CoV-2 感染的连续检测与分子检测进行比较的研究。一项研究评估了连续检测与隔离的比较,结果表明检测在预防传播方面不劣于隔离[113]。因此,本文的分析重点在于诊断检测的准确性。对普通人群中暴露后的无症状感染者进行检测的合理性尚不明确。在养老院等人员密集场所,在疫情暴发期间将连续快速抗原检测纳入一系列控制措施中,可能有助于识别最具传染性的个体,并指导隔离建议[81]。现有数据无法说明暴露后进行 NAAT 或 Ag 检测的时间,也无法说明重复 Ag 检测的时间。
其他考虑因素
在本指南中,IDSA 专家组将 COVID-19 暴露定义为 CDC 定义的密切接触[114]。IDSA 专家组的建议考虑了标准核酸扩增检测(NAAT)的可及性和可用性,尽管在所提出的情况下,检测结果的及时性可能并非至关重要。例如,如果周末无法进行标准 NAAT 检测,则可以在工作日进行检测,前提是暴露者在等待检测期间进行隔离或采取其他措施以降低感染的进一步传播风险。并非所有暴露情况都相同。例如,长时间的家庭暴露比短暂的非家庭暴露具有更高的传播风险[112, 115],传播风险还受以下因素影响:被暴露者的传染性水平、暴露者的免疫水平(疫苗接种史、既往 COVID-19 感染史及其时间)以及病毒变异株。
以下假设和说明对于探讨无症状感染者至关重要:(1) 目前尚无 FDA 批准的针对 SARS-CoV-2 检测呈阳性的无症状感染者的治疗方案;(2) IDSA COVID-19 诊断小组假设无症状感染者在其感染过程中通常会在某个阶段具有传染性;(3) IDSA 小组假设通过检测识别无症状感染者可能是有益的;(4) 小组未发现直接证据表明对无症状感染者进行 SARS-CoV-2 检测能够降低传播风险。
本建议的结论和研究需求
目前缺乏直接比较两次连续快速抗原检测与单次标准核酸扩增检测(NAAT)在无症状 SARS-CoV-2 暴露人群中检测结果的研究,而此类研究亟需开展。此类研究应纳入特殊人群,例如儿童、免疫功能低下者、已接种疫苗、加强免疫和未接种疫苗的人群,以及既往感染过 COVID-19 和未感染过 COVID-19 的人群,以及接触过当前 SARS-CoV-2 变种的人群。此外,对于既往感染过 COVID-19 的个体,应考虑两次感染之间的时间间隔,因为如果既往感染发生在近期,则检测结果可能仍为阳性,而并非代表新的感染;在这种情况下,需要明确标准 NAAT 与抗原检测的特异性差异。重复抗原检测的理想时间间隔也需要确定。
建议 7:对教育机构中的无症状学生和工作场所中的员工进行重复抗原检测与不检测的比较
建议 7: 对于希望进行 SARS-CoV-2 检测的教育机构中的学生或工作场所中的员工,IDSA 专家组建议,对于 SARS-CoV-2 感染的诊断,既不赞成也不反对连续两次抗原检测,而不进行检测(证据不足)。
- 评论:
- 由于缺乏直接证据来解答这个问题,因此进行的分析是基于使用重复测试算法对诊断测试准确性进行建模,该算法涉及两次连续的抗原测试。
证据概要
我们未发现任何研究比较在教育机构的学生或工作场所的员工中,连续进行抗原检测与不进行检测对 SARS-CoV-2 传播、COVID-19 发病率或诊断检测准确性的影响。因此,我们采用重复检测算法(连续两次抗原检测)进行建模分析。我们假设每次检测的结果相互独立,但这可能并非一个有效的假设。所有比较均考虑了 1%、5%和 10%的 SARS-CoV-2 感染率。以标准核酸扩增检测(NAAT)为参考标准,连续两次抗原检测与不进行检测相比 ,其敏感性和特异性分别为 86%(95% CI:80%至 90%)和 100%(95% CI:99%至 100%)。 与不进行检测相比,两次重复检测每 1000 名受检者中出现 1 至 14 例假阴性结果,具体数量取决于疾病流行率。
由于结果的间接性和不一致性,灵敏度和特异性的证据确定性分别很低。间接性源于结果基于模型分析而非原始人体试验数据。此外,重复检测与不检测之间的比较也是间接的,因为所使用的数据来自不同的群体。
益处和危害
在学校、学院、其他教育机构和工作场所对无症状个体进行连续抗原检测的理论益处包括预防 SARS-CoV-2 的传播,但 IDSA 专家组未能找到任何直接研究连续抗原检测与不检测相比是否能降低 SARS-CoV-2 传播的研究。一些间接证据表明连续检测可能具有益处。一项针对英国中学和学院的大型整群随机试验发现,每日抗原检测在预防 COVID-19 继发病例方面不劣于自我隔离,两组研究对象中 SARS-CoV-2 检测呈阳性的接触者人数相似[113]。一项针对美国康涅狄格州 18 所学院和大学学生的回顾性队列研究报告称,对学生进行更频繁检测的机构发现了更多 COVID-19 病例并阻止了进一步传播[116]; 2020 年秋季,每周每名学生每增加一次检测,每周每名学生的病例数就会减少 0.0014 例(95% 置信区间:-0.0028 至 -0.00001)。
其他考虑因素
这项建议的前提是抗原检测能够广泛普及,且未考虑成本因素。此外,众所周知,并非所有教室或工作场所的风险都相同。学习环境或工作场所的差异很大,从有幼儿的小型教室到通风不良、工位密集的工厂车间,再到工位间距较大的大型工作场所,不一而足。在某些工作场所,例如娱乐行业,可能存在一些独特的风险,例如电影/电视制作所需的密切接触(包括亲密接触)。暴露和病毒传播的风险还可能与暴露者的免疫水平(疫苗接种史、既往 COVID-19 感染史及其时间)、年龄和合并症、暴露时间相对于首例病例发病时间的相对关系以及病毒变种有关。
IDSA 专家组认识到,对学生和员工进行连续快速抗原检测很常见,检测频率也各不相同,常见的频率包括每日、每周两次或每周一次。我们选择模拟两次连续的快速抗原检测。进行更多轮次的检测预计会改变该检测策略的性能特征。
雇主可以要求拒绝接种新冠病毒疫苗的无症状员工接受系列检测。美国传染病学会(IDSA)专家组发现,没有证据表明对新冠病毒进行系列检测能提供与已证实的疫苗接种益处相当的益处,也没有证据表明系列检测能降低新冠病毒在职业环境中的传播率。
本建议的结论和研究需求
IDSA 专家组未发现任何实证证据表明,对教育机构中的无症状学生或工作场所中的员工进行连续抗原检测比不进行检测更有益。为了获得支持此项建议的证据,需要对学生和/或员工进行不检测、单次抗原检测或不同频率的连续抗原检测。由于一名受试者的行为可能会影响同一队列中的其他成员,因此最好采用整群随机对照试验的方式进行。需要考虑既往疫苗接种史和/或既往 COVID-19 感染史等变量,以及学生/员工的流行毒株和潜在风险因素。关注的结局指标可能包括疾病情况(包括确诊的 SARS-CoV-2 感染病例数,无论有症状还是无症状)、缺课或缺勤时间、就医情况、住院情况以及研究对象及其密切接触者的死亡情况。
建议 8:对计划参加大型集会的无症状者进行抗原检测与不进行检测的比较
建议 8: 对于计划参加大型聚会(例如音乐会、会议、派对、体育赛事)的无症状个人,IDSA 专家组建议既不赞成也不反对进行抗原检测(证据不足)。
- 评论:
- 目前尚无研究直接探讨此问题。
证据概要
尚无直接证据比较参加大型集会前进行抗原检测与不进行检测的效果。因此,本研究从一项针对参与居家抗原检测的无症状个体的研究[117]中获取了检测数据,因为假设如果在大型集会前进行检测,检测将在家中进行。基于标准核酸扩增检测(NAAT),共获得 86 例阳性结果和 601 例阴性结果。这些无症状个体的快速居家抗原检测的敏感性和特异性分别为 41%(95% CI:25%至 61%)和 100%(95% CI:97%至 100%)。这些敏感性和特异性值与无症状社区人群中 COVID-19 的患病率分别为 1%、5%和 10%的情况一起考虑。由于间接性和不精确性,证据的确定性对于敏感性和特异性而言分别非常低和较低。由于接受居家检测的患者与参加大型集会的人群并非同一群体,因此存在间接性。研究的精确度较低,是由于研究对象数量较少以及置信区间较宽所致。
益处和危害
在大型集会前对无症状者进行抗原检测的理论益处,可能更多地体现在检测结果为阴性的人身上,而非检测结果为阳性的人身上。这种益处的前提是,抗原检测结果为阳性的人不会参加大型集会,而检测结果为阴性的人会参加。在大型集会前进行检测对人群的理论益处在于,可以降低无症状感染者传播 SARS-CoV-2 的风险,尤其是在无法保持社交距离或通风不良,且社区无症状感染率中等至较高(即>5%)的场所。然而,我们未能找到实证证据支持在大型集会前对无症状者进行抗原检测能够降低 SARS-CoV-2 的传播。因此,这种益处目前仍停留在理论层面。
其他考虑因素
要求参加大型集会(例如婚礼、毕业典礼、体育赛事、音乐节、会议)的人员在集会前进行抗原检测,其前提是人们会主动进行检测,并正确操作、正确解读结果,且采取适当措施(例如,如果检测结果呈阳性则不参加集会)。如果参加集会需要花费一定的费用或安排,或者对个人而言极具吸引力,那么无法参加集会可能会促使他们不参与检测或不报告结果,或者不恰当地采集样本,从而影响检测结果的准确性。此外,抗原检测需要由参加集会的人员自行购买或提供,无论哪种方式都会增加成本。如果是前者,要求在集会前进行检测可能会造成经济困难和不公平现象。
本建议的结论和研究需求
目前尚无实证研究直接探讨此问题,因此无法就无症状者在参加大型集会前进行抗原检测( 而非不检测)提出任何建议。在社区无症状感染率中高(即≥5%)且无法保持社交距离、参与者未佩戴口罩或通风不良的情况下,对无症状者在活动前立即进行一次性抗原检测(而非不检测)可能有助于降低传播风险。然而,迄今为止,尚无实证证据表明抗原检测能够降低传播风险。或许可以通过一项整群随机对照试验来解答在大型集会前进行一次性检测的潜在益处这一问题。即使是这样的试验,其结果也可能因当地地理环境、疫苗接种覆盖率(包括疫苗类型、接种时间和加强针接种情况)、参与者和当地居民(或参与者聚会结束后将要返回的居民)的既往 COVID-19 感染史、参与者的特征(合并症、年龄)、是否佩戴口罩及口罩类型、是否提供食物、是否保持社交距离、活动是在室内还是室外举行、室内场所的通风水平以及疫情所处的阶段(例如,疫情高峰、疫情波次、病毒变异株)而有所不同。最后,所使用的特定抗原检测方法也可能因检测设计的差异以及流行病毒变异株的潜在影响而影响检测结果[79]。
建议 9:即时检测与实验室抗原检测
建议 9: 对于希望进行抗原检测的个人,IDSA 专家组建议进行即时检测或实验室抗原检测 (有条件推荐,证据确定性低) 。
- 评论:
- 尽管即时检测和实验室抗原检测的性能结果似乎相当,但现有证据的一个重要局限性在于,现有研究并未报告有症状和无症状受试者的相对数量。由于抗原检测对有症状个体的敏感性高于无症状个体,即时检测和实验室检测研究中纳入的有症状和无症状个体的比例未知,这可能导致结果被低估,从而影响了检测结果。
证据概要
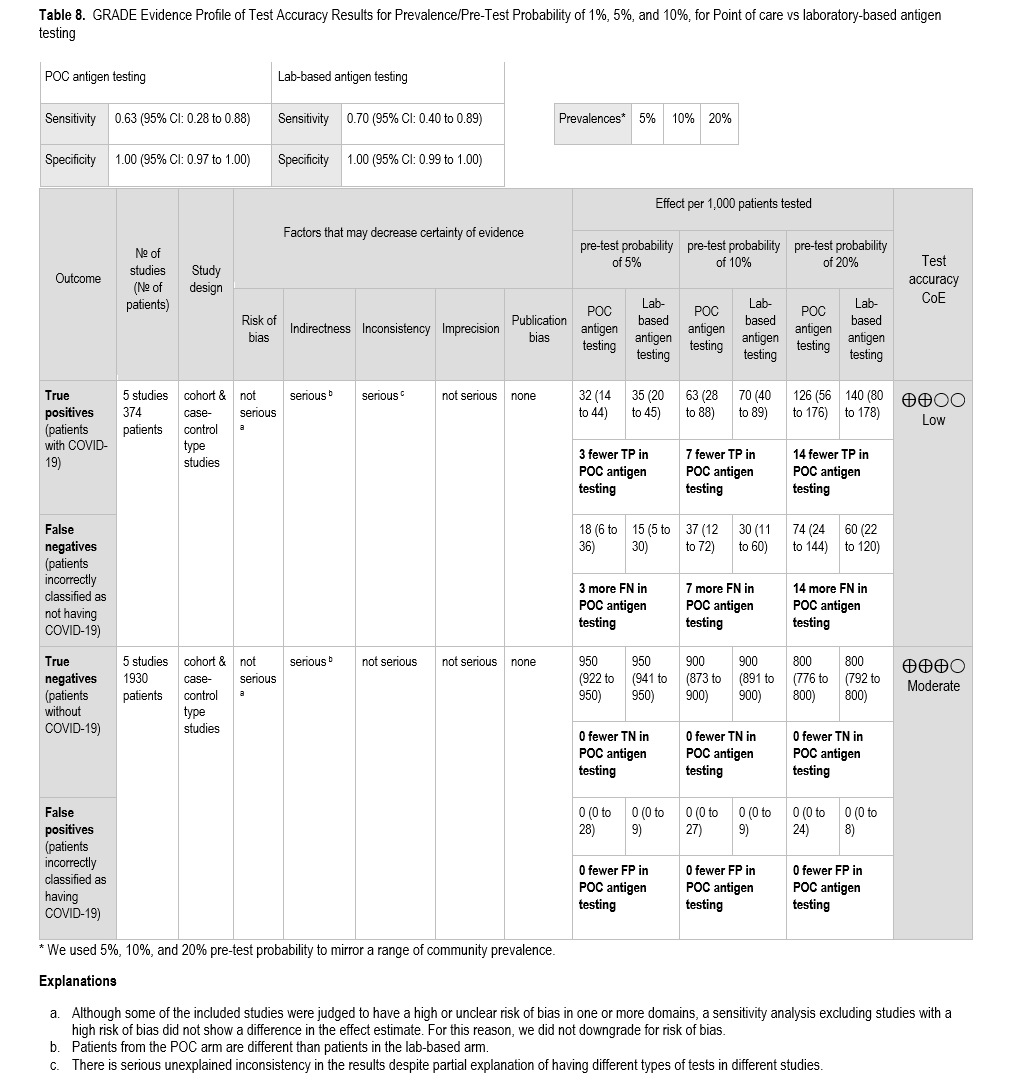
在本 PICO 研究中,我们检索到 5 项研究[118-122],这些研究直接比较了多种基于实验室和床旁 SARS-CoV-2 抗原检测方法,并以标准核酸扩增检测(NAAT)作为参考标准。主要研究结果为诊断检测的性能。这些研究共纳入 2304 例患者,其中 374 例检测结果为阳性,1930 例为阴性(基于标准 NAAT 检测结果)( 表 8 )。我们根据检测完成和结果解读的地点,将检测方法分为床旁检测和实验室检测。如果检测在标本采集后立即在床旁完成,则视为床旁检测;如果检测在标本送至实验室后完成,则视为实验室检测。
即时抗原检测的敏感性和特异性分别为 63%(95% CI:28% 至 88%)和 100%(95% CI:97% 至 100%)( 图 s14a、s14b )。实验室抗原检测的敏感性和特异性分别为 70%(95% CI:40% 至 89%)和 100%(95% CI:99% 至 100%)( 图 s15a、s15b )。我们假设 SARS-CoV-2 在总人群中的患病率为 5%、10% 和 20%,即假设人群中有症状感染者的患病率。与实验室抗原检测相比,即时抗原检测每 1000 名受检者中假阴性率高出 3 至 14 例,具体数值取决于患病率。
由于纳入的研究并未按研究参与者的症状状态进行分层,因此我们无法分别报告有症状和无症状个体的结果。由于纳入的研究是在混合人群中进行的,当这些证据被用于指导有症状和无症状个体的检测决策时,我们因间接性而降低了证据强度。此外,敏感性的置信区间较宽,考虑置信区间的下限和上限可能会导致不同的临床决策。因此,我们因不精确性而降低了证据的确定性。研究间在敏感性方面也存在无法解释的不一致性。总体而言,敏感性的证据确定性较低,特异性的证据确定性中等。
益处和危害
抗原检测是在即时检测点还是实验室进行,可能取决于可用资源和检测指征。即时检测的主要优势在于快速出结果,从而能够近乎实时地做出决策。其他益处包括更高的隐私性、便利性和对自身健康的掌控。如果居家检测出现更多技术错误、错误的检测结果解读,或未能向公共卫生部门或其他相关机构报告结果,则可能对患者或公众造成危害。加强患者教育并开发快速简便的检测结果报告方式或许能够减轻这些潜在的危害。本文概述的潜在益处和危害尚未在现有研究中得到评估。
目前,即时抗原检测已广泛应用于家庭或现场检测,但作为大型检测项目的一部分,同时检测多人可能在后勤方面面临挑战。另一种选择是,一些实验室抗原分析仪能够以自动化方式检测更多样本,并可在数小时内获得结果。这种方法适用于临床实验室拥有所需设备、需要检测大量样本且可接受当日出结果的情况。实验室检测的灵敏度可能略高于即时检测,因此假阴性结果更少。
其他考虑因素
目前,美国仅有少数实验室抗原检测平台获得了针对有症状或无症状人群的 SARS-CoV-2 检测的紧急使用授权(EUA)。实验室抗原检测通常比即时检测(POCT)更昂贵,但比包括标准核酸扩增检测(NAAT)在内的分子检测更便宜。
本建议的结论和研究需求
即时检测和实验室检测的诊断准确性相似。即时检测的优势在于成本更低、周转时间更短,便于在患者就诊期间做出临床决策。相比之下,由于实验室检测通常可以自动化并进行批量处理,因此可能更适合大规模检测,例如某些筛查或监测项目。目前尚不清楚即时检测和实验室检测的诊断准确性在无症状感染者和有症状感染者之间是否存在差异。其他知识空白还包括即时检测和实验室检测在特殊人群(例如免疫功能低下者、儿童、已接种疫苗者或感染新型 SARS-CoV-2 变种毒株(如 Omicron)的人群)中的分析性能。
建议 10:观察与非观察下自行采集抗原检测样本的比较
建议 10: IDSA 专家组建议,如果进行自我采集,则应采用观察或非观察的方式进行拭子样本的自我采集以进行抗原检测 (有条件建议,证据确定性低)。
- 评论:
- 目前还没有研究对同一患者的观察标本采集和非观察标本采集进行比较。
- 研究报告显示,标本采集技术以及用作比较的参考标准存在异质性。
- 提供最佳标本采集方法的指导可以提高自行采集标本的质量。
证据概要
我们未找到直接证据比较观察或非观察条件下的抗原检测样本自采集方法与参考标准。因此,我们将分别报告每种技术的研究与标准核酸扩增检测(NAAT)进行了比较。
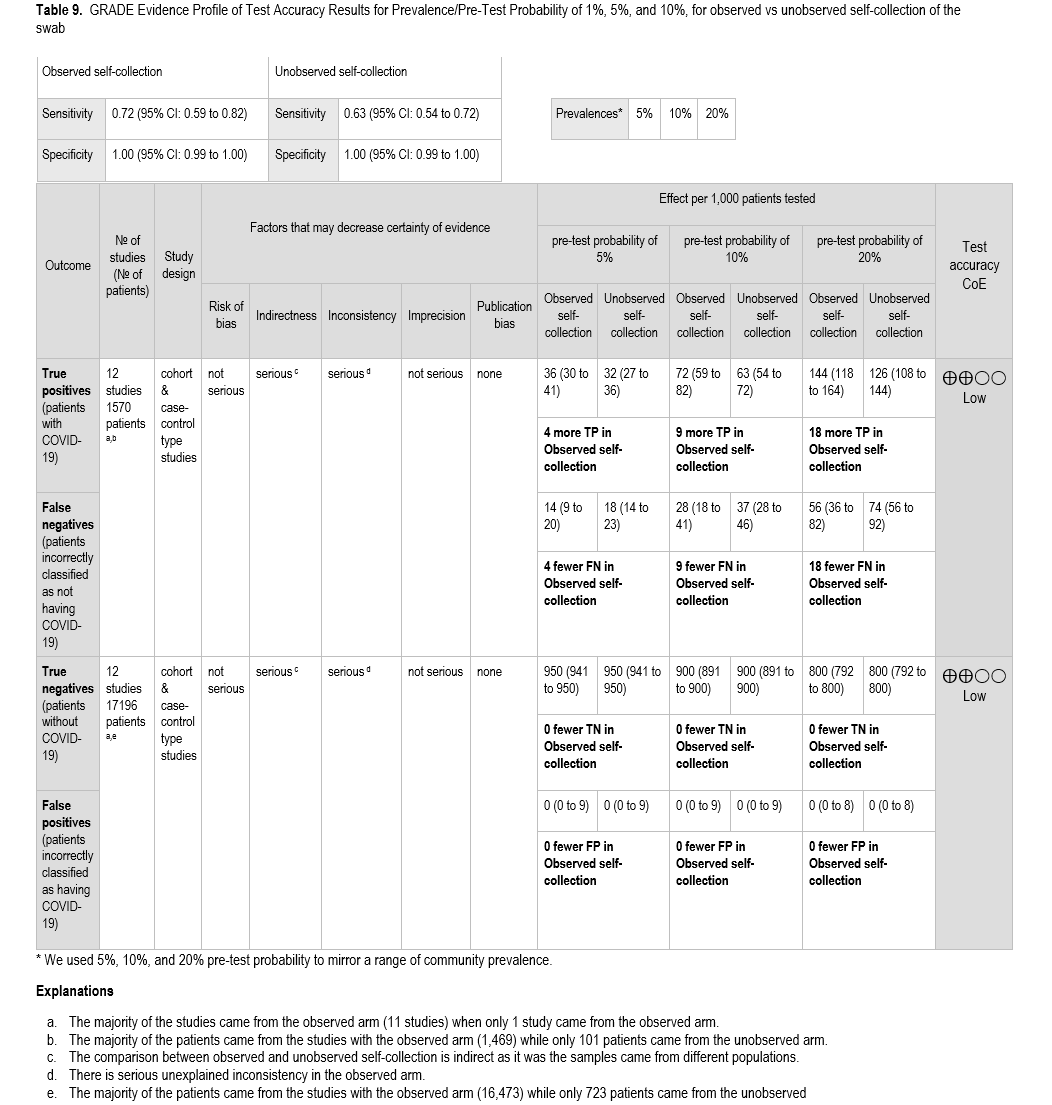
共有 12 项研究为本 PICO 问题提供了信息。其中 11 项研究[4, 8, 21, 27, 38, 57, 58, 64, 123-125]提供了观察下样本自采集的诊断试验准确性信息,1 项研究[117]提供了非观察下样本自采集的诊断试验准确性信息。基于标准核酸扩增检测(NAAT),共有 1570 例阳性结果和 17196 例阴性结果。非观察下自采集样本的研究中,仅有 101 例阳性结果和 723 例阴性结果( 表 9 )。
对观察者采集的自采样本进行抗原检测的汇总敏感性和特异性分别为 72%(95% CI:59% 至 82%)和 100%(95% CI:99% 至 100%)( 图 s16a、s16b )。在唯一一项针对有症状患者未观察者采集的自采样本进行抗原检测的研究中,未观察者采集的自采样本的抗原检测敏感性和特异性分别为 63%(95% CI:54% 至 72%)和 100%(95% CI:99% 至 100%)( 图 s17a、s17b )。本研究采用 10%、20% 和 50% 的 SARS-CoV-2 流行率来评估这些性能特征在不同有症状患者人群中的影响。无论患病率如何,与观察样本采集过程相比,未观察样本采集过程时,假阴性结果更多。
由于证据的间接性,敏感性和特异性的证据确定性均较低。间接性源于缺乏对有症状患者中观察性和非观察性标本自采集的直接比较,因此专家组需要比较两组患者中观察性和非观察性标本自采集的情况。
益处和危害
非监督性抗原检测的潜在优势在于检测资源丰富,且检测更容易进行,速度也更快,相比之下,监督性检测需要提前安排。这对于居住在农村或其他检测机构不便地区的居民,以及不愿前往医疗机构的人士来说,尤其有利。成本也是一个需要考虑的因素;监督性检测会增加患者的医疗成本,无论是直接增加患者的费用,还是增加医疗系统的成本。
抗原检测的潜在危害在于假阴性结果的风险。假阴性结果可能给人以未感染 SARS-CoV-2 的错误印象,如果感染但未确诊的人不采取措施预防传播,则可能助长病毒传播。如果感染者出现症状,假阴性结果也可能导致未能及时治疗本应受益的患者。另一方面,如果人们充分理解阴性检测结果并不能排除感染(并建议进行后续检测),则可以通过提供关于样本采集、检测操作和结果解读的详细说明(书面材料、图示、视频)来减轻此类潜在危害。
其他考虑因素
对于非观察性检测,提供适当的指导说明(例如,视觉辅助工具、视频)可能会影响检测性能,但并未对此进行专门评估[126]。需要开展更多研究,比较同一受试者在观察和非观察状态下进行的抗原检测,并以同一患者同时采集的核酸扩增检测(NAAT)作为参考。所使用的特定抗原检测方法可能会影响诊断敏感性,这取决于检测设计的差异以及对病毒变异株检测的潜在影响[78, 79]。最后,进行检测的目的可能会影响非观察性自取样的敏感性(尽管根据观察的性质,这种情况也可能发生在观察性自取样中);例如,如果预期终点是阴性结果(例如,重返工作岗位或学校,参与自己喜欢的活动),则样本采集的质量可能会被有意降低。
本建议的结论和研究需求
尽管我们没有找到直接证据比较观察下自取样和非观察下自取样抗原检测与有症状或无症状个体参考标准的结果,但 IDSA 专家组建议采用观察下或非观察下采集样本进行检测。理想情况下,应该开展一项研究,直接比较观察下和非观察下自取样抗原检测与医疗机构采集的抗原检测和医疗机构采集的核酸扩增检测(NAAT)参考标准的结果。此外,还需要同行评审的研究来评估居家自测的性能。
讨论与结论
讨论
普及准确的 SARS-CoV-2 检测仍然是全面 COVID-19 防控策略的重要组成部分。快速抗原检测的易得性、简便性和相对较低的成本使得检测范围得以扩大,尤其是在非医疗机构。近期研究表明,在药房、养老院和学校等各种社区场所,无需高素质的实验室人员即可准确进行快速 SARS-CoV-2 抗原检测。实验室抗原检测是另一种方法,可以一次性检测更多样本。然而,由于需要将样本运送到中心实验室,因此在即时检测点(POC)快速提供结果的潜在优势有所降低。虽然快速抗原检测的性能数据比实验室抗原检测更多,但快速即时检测与实验室抗原检测的灵敏度和特异性似乎相当( 图 s14a-s15b )。
本次更新的系统评价的一项重要发现是,快速抗原检测具有极高的特异性。早期关于抗原检测假阳性结果的担忧并未在医学文献中得到证实[127]。值得注意的是,我们分析中纳入的许多研究都采用了非医务人员在现场进行快速抗原检测。尽管尚未找到这两种方法的直接比较,但患者自行采集前鼻孔样本进行检测的结果似乎与有监督的样本采集结果相当。然而,居家自测是否能达到同样的准确性尚待最终确定。本指南文献综述完成后发表的近期研究表明,抗原自测结果的解读准确性可能较差,但可以通过患者教育来提高[126, 128]。鉴于紧急使用授权(EUA)快速抗原检测具有很高的特异性,因此无需对阳性检测结果进行常规确认;阳性结果可立即用于指导治疗、隔离和检疫决策。即使检测前概率或患病率较低(例如 1%),假阳性抗原检测结果的数量预计也非常少,大约每 1000 名受检者中出现 0-10 例假阳性结果( 表 6 ),无论是否存在症状或检测时间与发病时间的关系如何。然而,当检测前感染概率或患病率极低(例如 3% 至 1%)和/或潜在假阳性结果的影响被认为显著时,可以根据具体情况考虑对阳性抗原检测结果进行确认。
目前已获紧急使用授权(EUA)的 SARS-CoV-2 抗原检测的灵敏度低于标准核酸扩增检测(NAAT)。在有症状和无症状人群的比较中,灵敏度差异最为明显。对于在疾病早期(病毒载量预计最高)接受检测的有症状患者,抗原检测的临床灵敏度最高(89%; 图 S2a )。症状出现超过 5 天后,检测灵敏度下降至 54%( 图 S4a )。一些近期发表的个案报道和一项严谨的观察性研究[82](该研究发表于本指南文献检索完成后)报告称,在症状出现后的头一两天内,抗原检测的灵敏度较低,这可能与特定的 SARS-CoV-2 变异株和/或感染者的疫苗接种状况有关。然而,在文献检索期间,IDSA 专家组未能找到报告症状出现后如此早期抗原检测性能的研究。症状出现后 3 天内的抗原检测灵敏度与症状出现后 5 天内的灵敏度相似。无症状感染者的抗原检测敏感性较低(63%; 图 S12a )。关于 COVID-19 患儿的研究较少。在有症状的儿科患者中,抗原检测的总体敏感性为 80%(95% CI:74%至 86%),特异性为 100%(95% CI:97%至 100%),与有症状成人的抗原检测性能相当。
在培养中分离出具有复制能力的病毒已被用作推断临床样本中是否存在感染性病毒的替代方法。在 IDSA 最初发布的关于 COVID-19 诊断中抗原检测的指南中,专家组分析了抗原阳性与具有复制能力的 SARS-CoV-2 之间的关系[83]。这一观察结果支持了抗原检测应能识别出大多数培养阳性个体的观点,由此推断,这部分人群更有可能排出具有感染性的病毒。然而,专家组指出了这种解释的几个重要注意事项。首先,虽然培养阳性的样本也可能是抗原阳性,但培养阴性或抗原阴性并不意味着不可能传播感染。病毒培养是一种相对不敏感的方法,而且容易受到不同实验室分析结果差异的影响。此外,在所有以培养作为对照的研究中都观察到了抗原检测的假阴性结果(抗原检测与培养相比的假阴性率在 3%至 21%之间)[63, 129-131]。一些 SARS-CoV-2 感染者即使抗原检测和/或培养结果为阴性,也可能具有传染性。虽然使用抗原检测来推断传染性和隔离需求很常见,但专家组并未发现任何研究提供直接的实证证据支持这种做法。需要对家庭或其他高传播场所进行细致的流行病学调查,并结合 SARS-CoV-2 的基因组分析,以确定抗原检测结果与传染性的相关性。此外,还需要开发能够准确预测传染性的新型检测方法。
专家组还发现了其他一些显著的证据缺口。尽管单次或多次抗原检测被广泛用于降低学校、大学、工作场所和大型社交聚会前 SARS-CoV-2 的传播风险,但我们未能找到任何实证证据支持这些做法。数学模型表明,重复抗原检测有助于克服快速抗原检测的灵敏度限制,并且在某些情况下,检测频率和结果周转时间可能与检测灵敏度同等重要。我们需要开展精心设计的研究,以评估重复检测策略对不同环境下分析检测性能和传播事件的影响。此外,还需要确定重复抗原检测与频率较低的快速 RT-PCR 检测(或根据流行情况可能不进行检测)相比的成本效益。潜在的有效性指标应包括已确诊的 SARS-CoV-2 病例数、新病例的接触者追踪结果,以及理想情况下,传播事件。除了检测试剂盒(例如试剂和耗材)的价格外,成本评估还应考虑扩大检测规模所需的资源。
关于抗原检测在免疫功能低下者、接种过一剂或多剂新冠疫苗者以及自然感染过新冠病毒者中的表现信息有限。此外,也缺乏抗原检测检测当前 SARS-CoV-2 变异株(包括 Omicron 变异株)的性能数据。在本次系统评价的文献检索完成后,有一项研究采用深度突变扫描来识别 SARS-CoV-2 核衣壳逃逸突变,从而避免快速抗原检测的检出。该报告预测,目前针对核衣壳的抗原检测能够检测到当前和以往的 SARS-CoV-2 变异株[132]。我们需要更多同行评审的研究来评估抗原检测在感染最新变异株人群中的表现。随着更多针对这些人群的检测性能数据,检测建议可能会有所改变。
最后需要指出的是,我们仅纳入了获得 FDA 紧急使用授权(EUA)的抗原检测研究。未获得 EUA 的检测方法可能与 EUA 检测方法性能相当、更优或更差。未来也可能出现新的检测方法,需要进行评估。
结论
应确保所有社区都能公平地获得快速抗原检测等检测资源。与标准核酸扩增检测(NAAT)相比,快速抗原检测操作简便且单次检测价格更低,这些都是其吸引人的特点。总体而言,与单次标准 NAAT 相比,抗原检测在有症状个体中的敏感性为 80%,在无症状人群中的敏感性为 63%,两组人群的特异性均接近 100%。鉴于抗原检测的敏感性较低,标准 NAAT 仍然是检测 SARS-CoV-2 感染的首选诊断方法,尤其是在感染的预检概率为中高和/或假阴性结果的危害显著的情况下。在无法获得、不及时或不可行的标准 NAAT 的情况下,可以使用抗原检测,而无需常规确认阳性结果。然而,阴性抗原检测结果并不能排除 SARS-CoV-2 感染。理想情况下,如果对 COVID-19 的怀疑程度为中高,则应使用标准 NAAT 确认阴性抗原检测结果。当标准核酸扩增检测(NAAT)不可行时,可考虑重复进行抗原检测。值得注意的是,抗原检测结果为阴性并不能排除 SARS-CoV-2 的传染性,但抗原检测结果为阳性则会增加传染性的可能性。
笔记
致谢
专家组感谢美国传染病学会(IDSA)对指南制定工作的支持,尤其感谢 IDSA 理事会执行委员会以及 IDSA 工作人员 Dana Wollins、Sheila Tynes、Genet Demisashi、Jon Heald 和 Hannah Rehm 在整个指南制定过程中给予的持续支持。专家组也对美国卫生经济学会(SHEA)、美国传染病学会(PIDS)和美国微生物学会(ASM)的成员表示感谢,感谢他们提供的周到而全面的审阅。
财政支持
本项目部分资金来源于与美国疾病控制与预防中心(CDC)的合作协议(拨款编号:6 NU50CK000477-04-01)。CDC 是美国卫生与公众服务部(HHS)下属机构。本指南的内容并不一定代表 CDC 或 HHS 的政策,也不应被视为联邦政府的认可。
利益冲突摘要
以下列表显示了已向美国传染病学会 (IDSA) 报告的内容。为确保完全透明,IDSA 要求全面披露所有关系,无论其是否与指南主题相关。此类关系是否构成潜在利益冲突的评估,由审查流程决定,该流程包括董事会联络员对标准与实践指南委员会的评估,以及必要时由利益冲突 (COI) 和伦理委员会的评估。对已披露关系是否存在潜在利益冲突的评估,基于财务关系的相对重要性(即金额)和关系的相关性 (即独立观察者在多大程度上可能合理地将该关联解读为与所考虑的主题或建议相关)。读者在审阅披露列表时应注意这一点。MH 担任赛诺菲临床裁决小组的成员;接受美国疾病控制与预防中心 (CDC) 和 CDC 基金会的研究资助;担任美国医疗保健流行病学学会 ( SHEA ) 董事会成员和 SHEA 教育与研究基金会主席;还从 Sage、Medline 和 Molnylycke 获得了其他编号;并担任 IDSA 诊断委员会主席 。KH曾担任 Quidel、BioFire、辉瑞和武田的顾问;从 Quidel、辉瑞和武田获得其他资助;曾任美国微生物学会 (ASM) 编辑和临床与实验室标准协会抗真菌委员会成员;获得美国国立卫生研究院 (NIH) 的研究资助;曾任美国内科医学委员会考试委员会成员和《开放论坛传染病 》 副主编。JE 担任赛诺菲巴斯德、辉瑞和阿斯利康的顾问;担任 Meissa Vaccines 的顾问;获得美国疾病控制与预防中心 (CDC)、辉瑞、Brotman Baty 研究所、默克、Novavax、葛兰素史克和阿斯利康的研究资助;曾担任梯瓦制药的顾问;曾任儿科传染病学会 (PIDS) 出版委员会和移植传染病委员会成员。 ML 担任赛诺菲、Seqirus、Medicago、葛兰素史克、强生、Novavax、辉瑞和 MD Brief 的顾问;接受加拿大卫生研究院、世界卫生组织(WHO)和英国医学研究理事会的研究经费;曾接受赛诺菲提供的疫苗实物供应;曾因就机构和工作场所疫苗政策提供专家证词而获得报酬;曾担任康希诺生物的数据安全监测委员会(DSMB)成员和默克公司的顾问 。RP拥有百日咳杆菌/副百日咳杆菌 PCR 专利、超声处理装置/方法专利(三星向梅奥诊所支付专利费)以及抗生物膜物质专利;担任 PhAST、Torus Biosystems、Day Zero Diagnostics、Mammoth Biosciences、Netflix、雅培实验室、牛津纳米孔技术公司、CARB-X、Qvella 和 HealthTrackRx 的顾问;获得 NBME、UpToDate 和传染病委员会复习课程的其他编号;获得 CD Diagnostics、默克、和记黄埔生物膜医疗解决方案、Accelerate、ContraFect、TenNor Therapeutics Limited、盐野义制药、美国国立卫生研究院、BIOFIRE、Adaptive Phage Therapeutics、美国国家科学基金会和美国国防部的资助;并曾担任 Curetis、Specific Technologies、NextGen Diagnostics、Pathoquest、Selux Diagnostics 和 1928 Diagnostics 的顾问。SS 是循证基金会的董事会成员,并从循证基金会获得证据审查、方法学支持和教学方面的酬金;担任美国胃肠病学会 (AGA) 指南专家组成员;并获得美国退伍军人事务部证据综合项目的研究经费 。YFY 是循证基金会的董事会成员;并从循证基金会、AGA(证据审查)和临床与经济评价研究所 (ICER)(委员会会议)获得证据审查、方法学支持和教学方面的酬金;担任循证基金会和美国 GRADE 网络的董事;并曾担任 ICER 独立评估委员会成员 。RMMHM 担任循证基金会理事会成员,并因证据审查、方法学支持和教学工作从循证基金会获得酬金。MHM 担任循证基金会理事会成员,并因证据审查、方法学支持和教学工作从循证基金会获得酬金;获得医疗保健研究与质量署、内分泌学会和血管外科协会的研究经费;曾获得美国血液学会和世界卫生组织的研究经费;并曾担任世界卫生组织的指南方法学家 。AB 从 ICER 获得酬金。RAM 担任循证基金会理事会成员,并因证据审查、方法学支持和教学工作从循证基金会和 ICER 获得酬金(用于参加委员会会议);获得美国国立卫生研究院、世界卫生组织、美国风湿病学会、美国血液学会和勃林格殷格翰的研究经费;担任 ICER 中西部比较效果公共咨询委员会主席;担任改善全球肾脏病预后工作组方法委员会成员。担任加拿大肾脏病学会临床指南委员会委员;此前曾任美国内科医师学会(ACP)临床指南委员会委员。所有作者均已提交 ICMJE 利益冲突披露表。编辑认为与稿件内容相关的利益冲突均已披露。其他所有作者均声明无潜在利益冲突。
IDSA 免责声明
必须认识到,指南并非总能考虑到患者个体差异。指南是对当前科学和临床信息的评估,旨在提供教育服务;它们并非持续更新,也可能无法反映最新证据(新的证据可能在信息形成和发布或被阅读之间出现);不应被视为涵盖所有恰当的治疗方法或护理标准的声明;不强制要求任何特定的医疗方案;也不旨在取代医生对特定患者或特殊临床情况的判断。是否遵循指南以及遵循的程度完全出于自愿,最终是否应用指南应由医生根据每位患者的具体情况决定。尽管美国传染病学会 (IDSA) 尽一切努力提供准确、完整和可靠的信息,但这些指南“按原样”提供,不作任何明示或暗示的保证。美国传染病学会(IDSA)(及其官员、董事、会员、员工和代理人)对因本指南或依赖其中提供的信息而导致的任何损失、损害或索赔,包括直接、特殊、间接或后果性损害,概不承担任何责任。本指南为 IDSA 的专有财产,受版权保护。版权所有 © 2022 美国传染病学会。保留所有权利。未经 IDSA 事先书面许可,不得以任何形式或任何方式(包括复印、录音或其他电子或机械方法)复制、分发或传播本指南的任何部分。 仅允许医生和医疗保健提供者复制和使用这些指南用于其专业实践和临床决策。未经 IDSA 事先书面授权,任何个人或实体均不得出售、分发或修改这些指南,或制作其衍生作品或将其纳入任何产品,包括但不限于临床决策支持软件或任何其他软件产品。除上述授权外,任何希望以任何方式使用这些指南的个人或实体,必须联系 IDSA 并获得批准,并遵守第三方使用条款和条件,尤其是在任何软件产品中使用这些指南时。
参考
- 美国食品药品监督管理局 (FDA)。体外诊断紧急使用授权 (EUA) – SARS-CoV-2 抗原诊断测试。网址: https ://www.fda.gov/medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices/in-vitro-diagnostics-euas-antigen-diagnostic-tests-sars-cov-2#Revision 访问日期:2022 年 9 月 25 日。
- 美国疾病控制与预防中心。《使用抗原检测》。网址: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html 访问日期:2021 年 4 月 29 日。
- 美国疾病控制与预防中心。《美国各州、领地和管辖区新冠肺炎病例、死亡和实验室检测(核酸扩增检测)数据》。网址: https://covid.cdc.gov/covid-data-tracker/#cases_positivity7day 访问日期:2022 年 9 月 25 日。
- Tinker SCS, CM: Litvintseva, AP: Drenzek, C.: Voccio, GE: Hunter, MA: Briggs, S.: Heida, DE: Folster, J.: Shewmaker, PL: Medrzycki, M.: Bowen, MD: Bohannon, C.: Bagarozzi, D.: Petway, M.: Rota, PA: Kuhnert-Tallman, W.: Thornburg, N.: Prince-Guerra, JL: Barrios, LC: Tamin, A.: Harcourt, JL: Honein, MA. 针对无症状大学生的 SARS-CoV-2 即时抗原检测。新发传染病 2021 ; 27(10): 2662-5。
- Peacock WF、Soto-Ruiz KM、House SL 等。COVID-19 抗原检测在急诊科的应用。J Am Coll Emerg Physicians Open 2022 ;3(1): e12605。
- Fernández-Rivas G、Barallat J、Gonzalez V 等。DiaSorin Liaison SARS-COV-2 抗原定量检测对无症状人群的分析性能。Front Public Health 2021 ;9:788581。
- Montalvo Villalba MC、Sosa Glaria E、Rodriguez Lay LLA 等。 Elecsys SARS-CoV-2 抗原免疫分析诊断 COVID-19 的性能评估。医学病毒杂志 2021 年 。
- Garciá-Fiñana MH, DM: Cheyne, CP: Burnside, G.: Stockbridge, M.: Fowler, TA: Fowler, VL: Wilcox, MH: Semple, MG: Buchan, I. Innova SARS-CoV-2 抗原快速侧向流动检测在利物浦无症状检测试点中的性能:基于人群的队列研究。《英国医学杂志》 2021 ;374。
- Whiting PF、Rutjes AW、Westwood ME 等。QUADAS-2:诊断准确性研究质量评估的修订工具。Ann Intern Med 2011 ;155(8):529-36。
- Schünemann HJ、Mustafa RA、Brozek J 等。GRADE 指南:21 第 1 部分。研究设计、偏倚风险和间接性在评估检验准确性证据确定性中的应用。J Clin Epidemiol 2020 ;122:129-41。
- Schünemann HJ、Mustafa RA、Brozek J 等。GRADE 指南:21 第 2 部分。检验准确性:不一致性、不精确性、发表偏倚和其他领域,用于评估证据的确定性并在证据概况和结果汇总表中呈现。J Clin Epidemiol 2020 ;122:142-52。
- GRADEpro GDT。GRADEpro 指南制定工具 [软件]。麦克马斯特大学,2020 年(由 Evidence Prime, Inc. 开发)。网址: https://gradepro.org/ 访问日期:2021 年 5 月 1 日。
- Alexander PE、Bero L、Montori VM 等。世界卫生组织的建议往往基于对效果估计的低置信度而过于强烈。J Clin Epidemiol 2014 ;67(6): 629-34。
- Leixner GV-G, A.: Bonner, E.: Kreil, A.: Zadnikar, R.: Viveiros, A. 在医院环境中评估 AMP SARS-CoV-2 快速抗原检测。国际传染病杂志 2021 ;108:353-6。
- Venekamp RP、Veldhuijzen IK、Moons KGM 等。三种常用快速抗原检测方法对普通人群中 SARS-CoV-2 感染的检测:横断面诊断准确性研究。BMC Med 2022 ;20(1):97。
- 对荷兰有症状的社区居民中 SARS-CoV-2 快速抗原检测的准确性进行评估。PLoS One 2021 ;16(5): e0250886。
- Schuit E、Venekamp RP、Veldhuijzen IK 等。唾液和鼻腔快速抗原自检在普通人群中检测 SARS-CoV-2 感染的准确性和可用性:直接比较。2021 年 。
- Allan-Blitz LTK, JD 佛罗里达州 SARS-CoV-2 快速抗原检测与 PCR 检测的真实世界比较。临床微生物学杂志 2021 ;59(10)。
- Almendares O、Prince-Guerra JL、Nolen LD 等。2020 年 11 月社区检测点 Abbott BinaxNOW SARS-CoV-2 抗原检测与实时逆转录 PCR 和病毒培养的性能特征比较。J Clin Microbiol 2022 ;60(1): e0174221。
- Prince-Guerra JL AO、Nolen LD 等。在亚利桑那州皮马县两个社区检测点评估 Abbott BinaxNOW 快速抗原检测对 SARS-CoV-2 感染的检测——2020 年 11 月 3 日至 17 日。MMWR Morb Mortal Wkly Rep 2021 ;70:100-105。
- Ford LW, MJ: Shah, MM: Salvatore, PP: Segaloff, HE: Delaney, A.: Currie, DW: Boyle-Estheimer, L.: O’Hegarty, M.: Morgan, CN: Meece, J.: Ivacic, L.: Thornburg, NJ: Tamin, A.: Harcourt, JL: Folster, JM: Medrzycki, M.: Jain, S.: Wong, P.: Goffard, K.: Gieryn, D.: Kahrs, J.: Langolf, K.: Zochert, T.: Tate, JE: Hsu, CH: Kirking, HL. SARS-CoV-2 社区检测点儿童和成人抗原检测性能。儿科传染病学会杂志 2021 。
- James AE、Gulley T、Kothari A、Holder K、Garner K、Patil N. BinaxNOW 冠状病毒病 2019 (COVID-19) 抗原卡检测相对于严重急性呼吸道冠状病毒 2 (SARS-CoV-2) 实时逆转录聚合酶链反应 (rRT-PCR) 检测在有症状和无症状医护人员中的性能比较。感染控制与医院流行病学 2022 ;43(1): 99-101。
- Shaikh NF, EJ: Tate, PJ: Liu, H.: Chang, CH: Wells, A.: Hoberman, A. 快速 SARS-CoV-2 抗原检测试验在有症状儿童中的表现。儿科学 2021 ; 148(3)。
- Pollock NR、Jacobs JR、Tran K 等。在马萨诸塞州高通量免下车社区检测点对 Abbott BinaxNOW 快速抗原检测进行性能和实施评估。J Clin Microbiol 2021 ;59(5): e00083-21。
- Siddiqui ZK、Chaudhary M、Robinson ML 等。在大型自荐检测点对无症状和有症状人群实施 BinaxNOW 快速抗原 COVID-19 检测的准确性和有效性。微生物光谱 2021 ;9(3): e0100821。
- Quentin O、Sylvie P、Olivier M 等。在儿科急诊科对快速抗原 SARS-CoV-2 免疫层析检测的即时应用进行前瞻性评估。Clin Microbiol Infect 2022 。
- Tonen-Wolyec S、Dupont R、Awaida N、Batina-Agasa S、Hayette MP、Bélec L. 评估 Biosynex 抗原自检 COVID-19 Ag+ 在法国普通人群中检测自采集鼻中甲分泌物中 SARS-CoV-2 核衣壳蛋白的实用性。Diagnostics 2021 ;11(12)。
- Fitoussi F、Tonen-Wolyec S、Awaida N、Dupont R、Bélec L. 即时检测 BIOSYNEX COVID-19 Ag BSS 在鼻咽拭子中检测 SARS-CoV-2 核衣壳蛋白的分析性能:法国 COVID-19 第三波疫情期间的前瞻性现场评估。Infection 2021 :1-9。
- Hagbom M、Carmona-Vicente N、Sharma S 等。SARS-CoV-2 唾液样本快速抗原诊断试验的评估。Heliyon 2022 ;8(2): e08998。
- Pérez-García FR, J.: Gómez-Herruz, P.: Arroyo, T.: Pérez-Tanoira, R.: Linares, M.: Pérez Ranz, I.: Labrador Ballestero, A.: Moya Gutiérrez, H.: Ruiz-Álvarez, MJ: Cuadros-González, J. CerTest 和 Panbio 抗原的诊断性能诊断 SARS-CoV-2 感染的快速诊断测试。临床病毒学杂志 2021 ; 137.
- Merino-Amador PG-D, P.: Domínguez-Fernández, M.: González-Romo, F.: Sánchez-Castellano, MÁ: Seoane-Estevez, A.: Delgado-Iribarren, A.: García, J.: Bou, G.: Cuenca-Estrella, M.: Osteto-Clinas, J. COVID-19 抗原检测用于诊断 SARS-CoV-2 感染:一项多中心评估研究。临床病毒学杂志 2021 ; 143:104961。
- Courtellemont LG, J.: Guillaume, C.: Giaché, S.: Rzepecki, V.: Seve, A.: Gubavu, C.: Baud, K.: Le Helloco, C.: Cassuto, GN: Pialoux, G.: Hocqueloux, L.: Prazuck, T. 一种新型抗原检测方法在鼻咽拭子标本中诊断 SARS-CoV-2 感染的高性能。医学病毒学杂志 2021 ;93(5):3152-7。
- Homza MZ, H.: Janosek, J.: Tomaskova, H.: Jezo, E.: Kloudova, A.: Mrazek, J.: Svagera, Z.: Prymula, R. SARS-COV-2 的五种抗原测试:病毒活力很重要。病毒 2021 ; 13(4)。
- Nörz D、Olearo F、Perisic S 等。全自动高通量 SARS-CoV-2 抗原免疫测定的多中心评估。传染病与治疗 2021 ;10(4): 2371-9 %9 文章 %! 全自动高通量 SARS-CoV-2 抗原免疫测定的多中心评估 %@ 193-6382 2193-8229。
- Aoki KN, T.: Ishii, Y.: Yagi, S.: Kashiwagi, K.: Miyazaki, T.: Tateda, K. 新型冠状病毒抗原检测试剂 Espline® SARS-CoV-2 的临床应用评价。J Infect Chemother 2021 ; 27(2): 319-22。
- Kim DL, J.: Bal, J.: Seo, SK: Chong, CK: Lee, JH: Park, H. 基于免疫层析法的快速抗原检测(GenBody™ COVAG025)在 COVID-19 诊断中的开发和临床评价。病毒 2021 ;13(5)。
- Klajmon A、Olechowska-Jarząb A、Salamon D、Sroka-Oleksiak A、Brzychczy-Włoch M、Gosiewski T. 比较抗原检测和 qPCR 在 SARS-CoV-2 病毒感染快速诊断中的应用。病毒 2022 ;14(1)。
- Chiu RYT、Kojima N、Mosley GL 等。INDICAID COVID-19 快速抗原检测在有症状人群和无症状社区检测中的评估。微生物学光谱 2021 ;9(1): 1-10。
- Aoki KN, T.: Ishii, Y.: Yagi, S.: Okuma, S.: Kashiwagi, K.: Maeda, T.: Miyazaki, T.: Yoshizawa, S.: Tateda, K. 定量 SARS-CoV-2 抗原检测方法在鼻咽拭子中评估 SARS-CoV-2 病毒载量的临床验证。J Infect Chemother 2021 ; 27(4): 613-6。
- Bianco GB, M.: Barbui, AM: Scozzari, G.: Riccardini, F.: Coggiola, M.: Lupia, E.: Cavallo, R.: Costa, C. 评估基于抗原的检测方法在医院即时诊断 SARS-CoV-2 感染中的应用。临床病毒学杂志 2021 ; 139。
- Leli CDM, L.: Gotta, F.: Cornaglia, E.: Vay, D.: Megna, I.: Pensato, RE: Boverio, R.: Rocchetti, A. SARS-CoV-2 抗原快速免疫测定在急诊科入院患者中的性能。国际传染病杂志 2021 ; 110: 135-40。
- Drain PK、Ampajwala M、Chappel C 等。一种快速、高灵敏度的 SARS-CoV-2 核衣壳免疫测定法,用于辅助即时诊断急性 COVID-19:一项临床性能研究。传染病治疗 2021 :1-9 [2021 年 2 月 24 日在线发表]。
- Koskinen JM、Antikainen P、Hotakainen K 等人。自动化快速 mariPOC SARS-CoV-2 抗原测试的临床验证。科学报告 2021 ; 11(1):20363。
- Caruana GC, A.: Kampouri, E.: Kritikos, A.: Opota, O.: Foerster, M.: Brouillet, R.: Senn, L.: Lienhard, R.: Egli, A.: Pantaleo, G.: Carron, PN: Greub, G. 在瑞士大学医院急诊科实施 SARS-CoV-2 快速抗原检测:INCREASE 研究。微生物 2021 ;9(4)。
- Murillo-Zamora ET, X.: Huerta, M.: Ríos-Silva, M.: Mendoza-Cano, O. 基于抗原的检测作为有症状 COVID-19 的一线诊断的性能。Medicina (Kaunas, Lithuania) 2021 ; 57(8)。
- Brihn AC, J.: K, O. Yong: Balter, S.: Terashita, D.: Rubin, Z.: Yeganeh, N. 抗原检测与 RT-PCR 在医院环境中检测 SARS-CoV-2 的诊断性能 – 加利福尼亚州洛杉矶县,2020 年 6 月至 8 月。MMWR Morb Mortal Wkly Rep 2021 ; 70(19): 702-6。
- Regev-Yochay G、Kriger O、Mina MJ 等。SARS-CoV-2 抗原快速诊断测试在各种临床环境中的真实世界性能。感染控制医院流行病学 2022 :1-20。
- Leber WL, O.: Siebenhofer, A.: Redlberger-Fritz, M.: Panovska-Griffiths, J.: Czypionka, T. 比较初级保健中 SARS-CoV-2 即时侧向流动抗原检测与 RT-PCR 的诊断准确性 (REAP-2)。EClinicalMedicine 2021 ; 38: 101011。
- Ifko M、Tkalčić Švabek Ž、Friščić I 等。斯洛文尼亚和克罗地亚医院中两种 SARS-CoV-2 免疫层析试验的诊断验证。克罗地亚医学杂志 2021 ;62(5): 513-7。
- Villaverde SD-R, S.:萨布里多,G.:佩雷斯-豪尔赫,C.:普拉塔,M.:罗梅罗,MP:格拉萨,CD:希门尼斯,AB:赫拉斯,E.:布隆卡诺,A.:努涅斯,MDM:伊兰,M.:梅里诺,P.:索托,B.:莫利纳-阿拉纳,D:贝尔梅霍,A.门多。 P.: 希洪, M.: 佩雷斯-莫内奥, B.: 莫拉莱达, C.: 塔加罗, A.: 卡尔沃, C.: 梅拉多, MJ: 罗德里格斯-莫利诺, P.: 德尔罗萨尔, T.: 桑托斯, M.: 纳瓦罗, M.: 林孔, E.: 圣地亚哥德拉, B.: 萨维德拉-洛, D. 埃帕尔萨, C.: Blázquez-Gamero, D.: Villanueva, S.: Rojo,P.: Calleja,G.: 阿隆索,JA: de la Torre,M.: Sanz-Santaeufemia,FJ: 伊格莱西亚斯,密歇根州: Herrero,B.: 阿隆索,M.: 索里亚诺-阿兰德斯,T.: Pujol,J.: Melendo,S. M. Soler-Palacin,P.: Simó,S.: Fumadó,V.: Lanaspa, M.: Urretavizcaya, M.: Herranz, M.: Pareja, M.: Ara, F.: Cabañas, S.: del Valle, R.: Barrios, A.: Otheo, E.: Vázquez, JL: Falcón, O: Olc, L.: Olbrich, P. Goicoechea, W.: Martín, L.: Figueroa, L.:略伦特,M.:佩宁,M.:加西亚,C.:加西亚,M.:阿尔瓦雷多,T.:奥尔梅多,MI:洛佩斯,A.:科博,E.:托维齐,M.:加兰,P.:吉兰,S.:纳瓦斯,佩雷斯,ML,佩雷斯,ML。 S.:埃尔南德斯,MJ:贝尔索萨,A.:加列戈,N.:洛佩兹,A.:鲁伊斯,B.:阿尔法亚特,S.:梅纳斯瓦斯,A.:塞万提斯,E.:门德斯,M.:乌尔塔多,Á:鲁伊斯,Y.:加西亚,C.:阿米奇,I.:奥尔特拉亚,M.:A.:奥罗尼亚,A.奥卡尼亚。罗梅罗,I.:古兹曼,MF:帕斯夸尔,MJ:桑切斯-科德兹,M.:蒙特西诺斯,E.:詹森,J.:罗德里格斯,M.:卡罗,G.:里乌斯,N.:戈麦斯,A.:布雷顿,R.:罗德里格斯,M.:罗梅罗,J.:坎波斯,A.:加西亚,M.,加西亚, M. RM: Lobato, Z.: Centeno, F.: Pérez, E.: Vidal, P.: Rey, C.: Vivanco, A.: Alonso, M.: Alcalá, P.: de Dios, JG: Solé, E.: Minguell, L.: Astigarraga, I.: Vázquez, M. Á: Sánchez, M.: Día: Día, E.康苏。卡瓦尼利亚斯 (Cabanillas),M.: 佩尼亚 (Peña),L.: 加洛特 (Garrote),E.: 戈伊科切亚 (Goicoechea),M.: 森泰勒斯 (Centelles),I.: 拉佩尼亚 (Lapeña),S.: 古铁雷斯 (Gutierrez),S.Gutiérrez, S.: Cavalle, A.: Olmos, JM: Cobo, A.: Díaz, S.: Jiménez, B.: González, R.: Lafuente, M.: Bustillo, M.: Pons, N.: Morata, J.: Segura, E. Panbio 严重急性呼吸综合征冠状病毒 2 抗原快速检测与鼻咽拭子样本逆转录聚合酶链反应检测在儿科人群中的诊断准确性比较。《儿科学杂志》 2021 ; 232: 287-9.e4。
- Masiá MF-G,M.:桑切斯,M.:卡瓦哈尔,M.:加西亚,JA:冈萨洛-希门尼斯,N.:奥尔蒂斯·德拉塔布拉,V.:阿古洛,V.:坎德拉,I.:吉哈罗,J.:古铁雷斯,JA:德格雷戈里奥,C.:古铁雷斯,F. 鼻咽 Panbio 在护理点进行的 COVID-19 抗原检测对于传播风险较高且年龄较大的有症状和无症状患者具有高敏感性。 2021 年传染病开放论坛; 8(3)。
- Escribano P、Sánchez-Pulido AE、González-Leiva J 等。三种即时 SARS-CoV-2 抗原检测设备在有症状患者和密切无症状接触者中的不同性能:一项真实世界研究。Clin Microbiol Infect 2022 。
- Landaas ETS, ML: Tollånes, MC: Barlinn, R.: Kran, AMB: Bragstad, K.: Christensen, A.: Andreassen, T. SARS-CoV-2 快速抗原测试在挪威大型队列中的诊断性能。临床病毒学杂志 2021 ; 137.
- Albert ET, I.: Bueno, F.: Huntley, D.: Molla, E.: Fernández-Fuentes, MÁ: Martínez, M.: Poujois, S.: Forqué, L.: Valdivia, A.: Solano de la Asunción, C.: Ferrer, J.: Colomina, J.: Navarro, D. 快速抗原检测的现场评估 (Panbio™ COVID-19 Ag 快速测试设备)用于初级保健中心的 COVID-19 诊断。临床微生物感染 2021 ; 27(3):472.e7-.e10。
- Bulilete OL, P.: Leiva, A.: Carandell, E.: Oliver, A.: Rojo, E.: Pericas, P.: Llobera, J. Panbio™ SARS-CoV-2 快速抗原检测在初级卫生保健中的有症状患者中具有可接受的准确性。感染杂志 2021 ; 82(3):391-8。
- Alqahtani M、Abdulrahman A、Mustafa F、Alawadhi AI、Alalawi B、Mallah SI。使用鼻拭子样本评估快速抗原检测在诊断有症状患者的 SARS-CoV-2 中的应用。Front Public Health 2021 ;9:728969。
- Krüger LJG, M.: Tobian, F.: Lainati, F.: Gottschalk, C.: Klein, JAF: Schnitzler, P.: Kräusslich, HG: Nikolai, O.: Lindner, AK: Mockenhaupt, FP: Seybold, J.: Corman, VM: Drosten, C.: Pollock, NR: Knorr, B.: Welker, A.: de Vos, M.: Sacks, JA: Denkinger, CM. Abbott PanBio WHO 紧急使用清单中的 SARS-CoV-2 快速抗原检测即时诊断测试——准确性和易用性评估。PLoS ONE 2021 ; 16(5 May).
- Klein JAFK, LJ: Tobian, F.: Gaeddert, M.: Lainati, F.: Schnitzler, P.: Lindner, AK: Nikolai, O.: Knorr, B.: Welker, A.: de Vos, M.: Sacks, JA: Escadafal, C.: Denkinger, CM. 世界卫生组织认可的 SARS-CoV-2 抗原检测快速诊断测试中,自采鼻拭子与专业采集鼻咽拭子的性能直接比较。医学微生物学与免疫学 2021 ; 210(4): 181-6。
- Merino P、Guinea J、Munoz-Gallego I 等。Panbio COVID-19 快速抗原检测试验在 SARS-CoV-2 感染诊断中的多中心评估。Clin Microbiol Infect 2021 ;27(5):758-61。
- Mboumba Bouassa RSV, D.: Péré, H.: Bélec, L. 即时检测 SIENNA™ COVID-19 抗原快速检测法在检测鼻咽拭子中 SARS-CoV-2 核衣壳蛋白方面的分析性能:法国 COVID-19 第二波疫情期间的前瞻性评估。国际传染病杂志 2021 ;106:8-12。
- Smith RDJ, JK: Clay, C.: Girio-Herrera, L.: Stevens, D.: Abraham, M.: Zimand, P.: Ahlman, M.: Gimigliano, S.: Zhao, R.: Hildenbrand, C.: Barrueto, F.: Leekha, S. Sofia 快速抗原检测法在急诊科入院患者中检测严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 的临床评价。感染控制与医院流行病学杂志 2021 : 1-6。
- Beck ET,Paar W,Fojut L,Serwe J,Jahnke RR。 Quidel Sofia SARS FIA 测试与 Hologic Aptima SARS-CoV-2 TMA 测试在有症状门诊患者中诊断 COVID-19 的比较。临床微生物杂志 2021 ; 59(2):e02727-20。
- Pray IW、Ford L、Cole D 等。2020 年 9 月至 10 月,威斯康星州两所大学校园中基于抗原的 SARS-CoV-2 无症状和有症状检测的性能。MMWR Morb Mortal Wkly Rep 2021 ;69(5152):1642-7。
- Harris DTB, M.: Jernigan, B.: Sprissler, R.: Edwards, T.: Cohen, R.: Paul, S.: Merchant, N.: Weinkauf, CC: Bime, C.: Erickson, HE: Bixby, B.: Parthasarathy, S.: Chaudhary, S.: Natt, B.: Cristan, E.: El Aini, T.: Rischard, F.: Campion, J.: Chopra, M.: Insel, M.: Sam, A.: Knepler, JL: Knox, K.: Mosier, J.: Spier, C.: Dake, MD. 亚利桑那大学校园内有症状和无症状个体的 SARS-CoV-2 快速抗原检测。生物医学 2021 ; 9(5)。
- Mitchell SL、Orris S、Freeman T 等。SARS-CoV-2 抗原检测在有症状和无症状成人中的表现:单中心评估。BMC 传染病 2021 ;21(1)。
- Kahn MS, L.: Bartenschlager, C.: Zellmer, S.: Frey, R.: Freitag, M.: Dhillon, C.: Heier, M.: Ebigbo, A.: Denzel, C.: Temizel, S.: Messmann, H.: Wehler, M.: Hoffmann, R.: Kling, E.: Römmele, C. 抗原检测在 COVID-19 诊断中的性能:侧向流动装置与基于核酸扩增的检测的直接比较。BMC 传染病 2021 ; 21(1)。
- Kim HW、Park M、Lee JH。快速 STANDARD Q COVID-19 Ag 检测在严重急性呼吸综合征冠状病毒 2 筛查中的临床评价。实验室医学年鉴 2022 ;42(1): 100-4。
- Holzner CP, D.: Anastasiou, OE: Dittmer, U.: Manegold, RK: Risse, J.: Fistera, D.: Kill, C.: Falk, M. SARS-CoV-2 快速抗原检测:快速安全还是危险?大学医院急诊科的一项分析。《医学病毒学杂志》 2021 。
- Jakobsen KKJ, JS: Todsen, T.: Tolsgaard, MG: Kirkby, N.: Lippert, F.: Vangsted, AM: Martel, CJ: Klokker, M.: von Buchwald, C. 快速抗原检测与逆转录聚合酶链反应在 SARS-CoV-2 检测中的准确性和成本描述比较。丹麦医学杂志 2021 ; 68(7)。
- Amer RM、Samir M、Gaber OA 等。COVID-19 快速抗原检测的诊断性能以及病毒载量、采样时间、受试者临床和实验室参数对检测准确性的影响。J Infect Public Health 2021 ;14(10):1446-53。
- Rahman MM、Hoque AF、Karim Y 等。基于 SARS-CoV-2 抗原的快速诊断试剂盒在孟加拉国检测 COVID-19 病例的临床评价。Heliyon 2021 ;7(11): e08455 %7 20211122 %8 Nov %! 基于 SARS-CoV-2 抗原的快速诊断试剂盒在孟加拉国检测 COVID-19 病例的临床评价 %@ 2405-8440 (印刷版) 2405-8440。
- Turcato G、Zaboli A、Pfeifer N 等。快速抗原检测识别急诊科收治的 COVID-19 感染患者(有症状和无症状)。Am J Emerg Med 2022 ;51:92-7。
- Kernéis S、Elie C、Fourgeaud J 等。唾液和鼻咽拭子采样在社区筛查中检测 SARS-CoV-2 的准确性:一项多中心队列研究。Eur J Clin Microbiol Infect Dis 2021 ;40(11): 2379-88 %7 20210803 %8 Nov %! 唾液和鼻咽拭子采样在社区筛查中检测 SARS-CoV-2 的准确性:一项多中心队列研究 %@ 0934-9723 (Print) 0934-9723。
- Fourati S、Soulier A、Gourgeon A 等。高通量自动化酶免疫测定法检测 SARS-CoV-2 抗原(包括病毒“关注变异株”)的性能:对临床应用的启示。《临床病毒学杂志》 2022 ;146。
- Carbonell-Sahuquillo S、Lázaro-Carreño MI、Camacho J 等。评估快速抗原检测测试(Panbio™ COVID-19 Ag 快速检测装置)作为儿科急诊科 COVID-19 即时诊断工具。J Med Virol 2021 ;93(12):6803-7。
- González-Donapetry PG-C, P.: Bloise, I.: García-Sánchez, C.: Sánchez Castellano, M. Á: Romero, MP: Gutiérrez Arroyo, A.: Mingorance, J.: De Ceano-Vivas La Calle, M.: García-Rodriguez, J. 为儿童着想:SARS-CoV-2 快速抗原检测的评估儿童人口。儿科传染病杂志 2021 年 :385-8。
- Kolwijck EB-B,M.:Broertjes,J.:van Heeswijk,K.:Runderkamp,N.:Meijer,A.:Hermans,MHA:Leenders,Acap。验证和实施 Panbio COVID-19 Ag 快速检测,用于诊断有症状的医院医护人员的 SARS-CoV-2 感染。 2021 年感染预防实践; 3(2):100142。
- Osterman A、Badell I、Basara E 等。SARS-CoV-2 快速抗原检测对 omicron 的检测受损。Med Microbiol Immunol 2022 ;211(2-3):105-17。
- 美国食品药品监督管理局。《SARS-CoV-2 病毒变异:对 COVID-19 检测的影响》。网址: https ://www.fda.gov/medical-devices/coronavirus-covid-19-and-medical-devices/sars-cov-2-viral-mutations-impact-covid-19-tests 访问日期:2022 年 10 月 29 日。
- Killingley B、Mann AJ、Kalinova M 等。SARS-CoV-2 在年轻人中引发人体感染的安全性、耐受性和病毒动力学。Nat Med 2022 ;28(5):1031-41。
- McKay SL、Tobolowsky FA、Moritz ED 等。养老院疫情期间 SARS-CoV-2 快速抗原连续检测的性能评估。Ann Intern Med 2021 ;174(7):945-51。
- Hakki S、Zhou J、Jonnerby J 等。SARS-CoV-2 传染性的开始和窗口期以及与症状出现的时间相关性:一项前瞻性、纵向、社区队列研究。柳叶刀呼吸医学 2022 ;10(11):1061-73。
- Hanson KE、Altayar O、Caliendo AM 等。美国传染病学会关于 COVID-19 诊断的指南:抗原检测。Clin Infect Dis 2021 。
- Altamimi AMO、DA:Alaifan、TA:Taha、MT:Alhothali、MT:Alzahrani、FA:Albarrag、AM 对 12 个用于检测 SARS-CoV-2 的定性 RT-PCR 商业试剂盒进行评估。医学病毒杂志 2021 ; 93(5):3219-26。
- Kim HN、Yoon SY、Lim CS、Yoon J. 三种 SARS-CoV-2 分子诊断检测方法的比较:分析灵敏度和临床性能的评估。临床实验室分析杂志 2022 。
- Lephart PRB, MA: LeBar, W.: McClellan, S.: Barron, K.: Schroeder, L.: Newton, DW. 对四种 SARS-CoV-2 核酸扩增检测 (NAAT) 平台的比较研究表明,ID NOW 的性能会因患者和样本类型而显著降低。Diagn Microbiol Infect Dis 2021 ; 99(1): 115200.
- Yun J、Park JH、Kim N 等。三种多重实时逆转录 PCR 检测方法在鼻咽拭子中同时检测 SARS-CoV-2、甲型/乙型流感病毒和呼吸道合胞病毒的评价。韩国医学科学杂志 2021 ;36(48):e328。
- Smith E、Zhen W、Manji R、Schron D、Duong S、Berry GJ。三种核酸扩增试验在 SARS-CoV-2 检测中的分析和临床比较。J Clin Microbiol 2020 ;58(9): e01134-20。
- Fourati S、Langendorf C、Audureau E 等。六种 SARS-CoV-2 抗原检测快速诊断试验的性能及其在实际应用中的意义。J Clin Virol 2021 ;142:104930。
- Gili AP, R.: Russo, C.: Cenci, E.: Pietrella, D.: Graziani, A.: Stracci, F.: Mencacci, A. 评估 Lumipulse® G SARS-CoV-2 抗原检测自动化测试在社区和人群筛查中检测鼻咽拭子中 SARS-CoV-2 核衣壳蛋白 (NP) 的性能。国际传染病杂志 2021 ; 105: 391-6。
- Dierks SB, O.: Schwanbeck, J.: Groß, U.: Weig, MS: Mese, K.: Lugert, R.: Bohne, W.: Hahn, A.: Feltgen, N.: Torkieh, S.: Denker, FR: Lauermann, P.: Storch, MW: Frickmann, H.: Zautner, AE 通过抗原检测诊断 sars-cov-2,转录介导的扩增和实时 PCR。临床医学杂志 2021 ; 10(11)。
- Drain P、Sulaiman R、Hoppers M、Lindner NM、Lawson V、Ellis JE。LumiraDx 微流控免疫荧光即时检测 SARS-CoV-2 抗原在无症状成人和儿童中的性能。Am J Clin Pathol 2021 。
- Caruana G、Croxatto A、Kampouri E 等。在瑞士一家大学医院的急诊科实施 SARS-CoV-2 快速抗原检测:INCREASE 研究。微生物 2021 ;9(4):798。
- Ferté TR, V.: Cazanave, C.: Lafon, ME: Bébéar, C.: Malvy, D.: Georges-Walryck, A.: Dehail, P. COVID-19 快速抗原检测与 RT-PCR 在学生人群中的准确性比较:StudyCov 研究。J Clin Virol 2021 ; 141: 104878。
- Baro B、Rodo P、Ouchi D 等。五种 SARS-CoV-2 无症状感染抗原检测快速诊断测试 (Ag-RDT) 的性能特征:直接基准比较。《感染杂志》 2021 ;82(6):269-75。
- Di Domenico MDR,A.:Di Gaudio,F.:Internicola,P.:Bettini,C.:Salzano,N.:Castrianni,D.:Marotta,A.:Boccellino,M。用于 sars-cov-2 检测的新抗原测试的诊断准确性。国际环境研究与公共卫生杂志 2021 ; 18(12)。
- Aranaz-Andrés JM、Chávez ACF、Laso AM 等。医院暴发情况下快速抗原检测 SARS-CoV-2 诊断准确性的分析。Eur J Clin Microbiol Infect Dis 2022 ;41(2): 305-12。
- Winkel B、Schram E、Gremmels H 等。使用 Panbio COVID-19 抗原快速检测(雅培)与 RT-PCR 比较对无症状个体进行 SARS-CoV-2 感染筛查:一项前瞻性队列研究。BMJ Open 2021 ;11(10):e048206。
- von Ahnen TvA, M.: Wirth, U.: Schardey, HM: Herdtle, S. 在无症状群体中对 COVID-19 快速抗原检测的评估:一项前瞻性研究。维也纳医学周报 2021 :1-4。
- von Ahnen T、von Ahnen M、Wirth U、Schardey HM、Herdtle S。无症状群体中 COVID-19 快速抗原检测的评估:一项前瞻性研究。维也纳医学周报 2022 ; 172(3-4):70-3。
- Fernandez-Montero AA, J.: Rodríguez, JA: Ariño, AH: Moreno-Galarraga, L. 验证快速抗原检测作为无症状人群中 SARS-CoV-2 感染筛查工具的有效性。灵敏度、特异性和预测值。EClinicalMedicine 2021 ; 37。
- Peña MA, M.: Garcés, C.: Gaggero, A.: Garcia, P.: Velasquez, MS: Luza, R.: Alvarez, P.: Paredes, F.: Acevedo, J.: Farfan, MJ: Solari, S.: Soto-Rifo, R.: Valiente-Echeverria, F. SARS-CoV-2 快速抗原检测与实时 RT-PCR 的性能比较无症状个体。国际传染病杂志 2021 ; 107:201-4
- Mungomklang A、Trichaisri N、Jirachewee J、Sukprasert J、Tulalamba W、Viprakasit V。用于监测泰国无症状个体的快速 SARS-CoV-2 抗原检测方法的敏感性有限。 Am J Trop Med Hyg 2021 。
- Kumar KKS, UC: Maganty, V.: Prakash, AA: Basumatary, J.: Adappa, K.: Chandraprabha, S.: Neeraja, TG: Guru Prasad, NS: Preethi, B.: Gangasagara, SB: Sujatha Rathod, BL 术前 SARS CoV-2 快速抗原测试和逆转录聚合酶链反应:一个难题在手术决策中。印度眼科杂志 2021 ; 69(6):1560-2。
- Wachinger JO, ID: Horner, S.: Schnitzler, P.: Heeg, K.: Denkinger, CM SARS-CoV-2 抗原检测在无症状人群筛查中的潜力。临床微生物学与感染 2021 。
- Betsch C、Sprengholz P、Siegers R 等。了解有效快速检测 SARS-CoV-2 的人为因素的经验证据。美国国家科学院院刊 2021 ;118(32)。
- COVID-19 治疗指南专家组。《2019 冠状病毒病(COVID-19)治疗指南:抗 SARS-CoV-2 单克隆抗体》。美国国立卫生研究院。网址: https://www.covid19treatmentguidelines.nih.gov/ 访问日期:2022 年 11 月 25 日。
- Deng JZ、Chan JS、Potter AL 等。美国 COVID-19 活动期或已康复期患者行重大择期手术后发生术后并发症的风险。Ann Surg 2022 ;275(2):242-6。
- Collaborative CO, GlobalSurg C. SARS-CoV-2 感染后手术时机:一项国际前瞻性队列研究。麻醉学 2021 ;76(6): 748-58。
- Le ST、Kipnis P、Cohn B、Liu VX。COVID-19 疫苗接种与 COVID-19 感染后手术时机的关系。Ann Surg 2022 ;276(5):e265-e72。
- Baker JM NJ、O’Hegarty M 等。SARS-CoV-2 B.1.1.529 (Omicron) 变种在家庭内的传播——美国四个司法管辖区。MMWR Morb Mortal Wkly Rep 2022 ;2022(71): 341-6。
- Madewell ZJ、Yang Y、Longini IM Jr.、Halloran ME、Dean NE。按变异株和疫苗接种状况划分的 SARS-CoV-2 家庭继发感染率:一项更新的系统评价和荟萃分析。JAMA Netw Open 2022 ;5(4): e229317。
- Young BC、Eyre DW、Kendrick S 等。对 SARS-CoV-2 感染者密切接触者进行每日检测,以及英国中学和学院中 SARS-CoV-2 的出勤和传播:一项开放标签、整群随机试验。柳叶刀 2021 ;398(10307):1217-29。
- 美国疾病控制与预防中心。《接触者追踪——制定 COVID-19 病例调查和接触者追踪计划的临时指南:概述——附录》。网址: https ://www.cdc.gov/coronavirus/2019-ncov/php/contact-tracing/contact-tracing-plan/appendix.html 访问日期:2022 年 9 月 25 日。
- Lyngse FPM,劳斯特·哈瓦斯;丹伍德,马修·J.;克里斯蒂安森,拉塞·恩博;默勒,卡米拉·霍尔滕;斯科夫,罗伯特·利奥;斯皮斯,卡佳;安德斯·福姆斯加德;拉索尼埃,玛丽亚·马格达莱娜;拉斯穆森,莫滕;马克·斯蒂格;尼尔森,克劳斯;拉斐尔·尼克劳斯·西伯;科恩,阿里耶·塞拉;莫勒,弗雷德里克·特里尔;过度瓦德,玛丽亚;莫尔巴克、卡雷;克劳斯,泰拉·格罗夫; Kirkeby,Carsten Thure SARS-CoV-2 Omicron VOC 在丹麦家庭中的传播。 medRxiv 2021 。
- Schultes O、Clarke V、Paltiel AD、Cartter M、Sosa L、Crawford FW。2020-2021 学年康涅狄格州住宿学院学生 COVID-19 检测、病例率和社会接触情况。JAMA Netw Open 2021 ;4(12): e2140602。
- Møller IJB、Utke AR、Rysgaard UK、Østergaard LJ、Jespersen S. 在家进行无人监督的 SARS-CoV-2 快速抗原检测的诊断性能、用户接受度和安全性。国际传染病杂志 2022 ;116:358-64。
- Alghounaim M、Bastaki H、Bin Essa F、Motlagh H、Al-Sabah S. 两种快速抗原检测在人群 SARS-CoV-2 感染筛查中的性能。Front Med (Lausanne) 2021 ;8:797109。
- Ishii TS, M.: Yamada, K.: Kato, D.: Osuka, H.: Aoki, K.: Morita, T.: Ishii, Y.: Tateda, K. 免疫层析和化学发光酶免疫测定法在 COVID-19 诊断中的应用。感染与化疗杂志 2021 ; 27(6): 915-8。
- Osterman A、Iglhaut M、Lehner A 等。比较四种商业化的自动化抗原检测方法检测 SARS-CoV-2 关注的变异株。Med Microbiol Immunol 2021 ;210(5-6): 263-75。
- Paul D、Gupta A、Rooge S、Gupta E. 基于自动化化学发光免疫测定的抗原检测的性能评估——迈向更可靠的 SARS-CoV-2 感染预测方法。J Virol Methods 2021 ;298:114299。
- Petonnet D、Marot S、Leroy I 等。快速和自动化抗原检测测试在 SARS-CoV-2 感染诊断中的比较。Diagnostics (Basel) 2022 ;12(1)。
- Nikolai O、Rohardt C、Tobian F 等。SARS-CoV-2 抗原快速检测中,前鼻腔取样与鼻中甲取样:定位或专业采集是否重要?传染病(伦敦) 2021 ;53(12): 947-52 %7 20210827 %8 11-12 %! SARS-CoV-2 抗原快速检测中,前鼻腔取样与鼻中甲取样:定位或专业采集是否重要? %@ 2374-4235(印刷版)2374-4243。
- Okoye NC、Barker AP、Curtis K 等。BinaxNOW COVID-19 抗原卡在大学环境中筛查无症状个体的性能特征。J Clin Microbiol 2021 ;59(4): e03282-20。
- Currie DW、Shah MM、Salvatore PP 等。SARS-CoV-2 抗原与病毒培养物逆转录 PCR 阳性率的关系。新发传染病 2022 ;28(3): 717-20。
- Denford S、Towler L、Ali B 等。在学校进行每日检测作为与 COVID-19 确诊病例密切接触后自我隔离的替代方案的可行性和可接受性:一项定性分析。BMC 公共卫生 2022 ;22(1): 742。
- 美国食品药品监督管理局。《使用抗原快速检测 SARS-CoV-2 可能出现假阳性结果——致临床实验室工作人员和医疗保健提供者的信函》。可访问以下网址获取: https ://www.fda.gov/medical-devices/letters-health-care-providers/potential-false-positive-results-antigen-tests-rapid-detection-sars-cov-2-letter-clinical-laboratory 访问日期:2021 年 5 月 17 日。
- Papenburg J、Campbell JR、Caya C 等。连续自测 SARS-CoV-2 快速抗原检测在工作场所纵向大规模筛查中的适用性。JAMA Netw Open 2022 ;5(5): e2210559。
- Kohmer N、Toptan T、Pallas C 等。四种 SARS-CoV-2 快速抗原检测的临床性能比较及其与体外感染性的相关性。J Clin Med 2021 ;10(2): 328。
- Pekosz A、Parvu V、Li M 等。抗原检测而非实时聚合酶链式反应与严重急性呼吸综合征冠状病毒 2 病毒培养结果相关。Clin Infect Dis 2021 :ciaa1706。可访问: https://doi.org/10.093/cid/ciaa [2021 年 1 月 20 日在线发表]。
- Prince-Guerra JL、Almendares O、Nolen LD 等。2020 年 11 月 3 日至 17 日,在亚利桑那州皮马县两个社区检测点评估 Abbott BinaxNOW 快速抗原检测对 SARS-CoV-2 感染的检测效果。MMWR Morb Mortal Wkly Rep 2021 ;70(3): 100-5。
- Frank F、Keen MM、Rao A 等。深度突变扫描识别出目前可用的快速抗原检测的 SARS-CoV-2 核衣壳逃逸突变。Cell 2022 ;185(19):3603-16 e13。
补充信息
补充材料 A
表 s3. 纳入研究的 QUADAS-2 偏倚风险评估(95 项研究)
补充材料 B :建议 1
图 s3a. 有症状患者(症状出现后 ≤ 5 天)抗原检测敏感性的森林图
图 s3b. 有症状患者(症状出现后 ≤ 5 天)抗原检测特异性的森林图
图 s4a. 有症状患者抗原检测敏感性的森林图(症状出现后 3E5 天)
图 s4b. 有症状患者抗原检测特异性的森林图(症状出现后 3E5 天)
图 s5a. 有症状患者(症状出现后 ≤ 7 天)抗原检测敏感性的森林图
图 s5b. 有症状患者(症状出现后 ≤ 7 天)抗原检测特异性的森林图
图 s6a. 有症状患者抗原检测敏感性的森林图(症状出现后 7 天内的 3E 百分比)
图 s6b. 有症状患者抗原检测特异性的森林图(症状出现后 7 天内的 3E%)
图 s7a. 有症状患者(症状出现后 ≤ 3 天)抗原检测敏感性的森林图
图 s7b. 有症状患者(症状出现后 ≤ 3 天)抗原检测特异性的森林图
图 s9a. 抗原检测阳性结果与标准 NAAT(快速 RT-PCR 或实验室 NAAT)与病毒培养结果一致性的森林图(所有患者)
图 s9b. 快速抗原检测和标准 NAAT(快速 RT-PCR 或实验室 NAAT)阴性结果与病毒培养结果一致性的森林图(所有患者)
补充 C :建议 2
图 s10a. 所有患者中基于标准实验室的核酸扩增检测 (NAAT) 的敏感性森林图
图 s10b. 所有患者中基于标准实验室的核酸扩增检测特异性的森林图
补充说明 D :建议 3
补充材料 E :建议 4
图 s13a. 无症状患者(儿科)抗原检测总体敏感性的森林图
图 s13b. 无症状患者(儿科)抗原检测总体特异性的森林图
补充文件 F :建议 5
有关抗原检测准确性森林图(无症状),请参阅图 s12a 和图 s12b 。
有关 NAAT 准确度森林图,请参阅图 s10a 和图 s10b 。
补充 G :建议 6
重复测试算法请参见图 s11a 。
补充 H :建议 9
补充说明一 :建议 10
Hits: 30




孟博士您好!抱歉打扰您了,想问一下我全程打完疫苗后,加强过两针。这次过了半年我有点害怕于是又去加强了一针,结果打针的时侯(因为医院在一个绿化比较好的地方,我拿着单去结账的时候感觉有一个水掉在上面,后面护士碰了后又碰了针头)。我的问题是,如果我不打加强针一年内您觉得如果狗咬伤我打针的深度应该两厘米然后上臂三角肌,一年内我也有抗体吗。这算特别严重暴露吗 对于狗咬我来说
不担心