Contents
- 1 执行摘要
- 2 1. 疫苗接种率与公众信任度
- 3 2. 知识缺口
- 4 3. 儿童免疫接种计划的国际对比
- 5 4. 推荐的儿童免疫接种计划
- 5.1 4.1 疫苗接种类别
- 5.2 4.2 所有儿童均需接种的疫苗
- 5.3 4.3 特定高危人群或群体需接种的疫苗
- 5.4 4.4 需通过共同临床决策确定是否接种的疫苗
- 5.4.1 甲型肝炎疫苗
- 5.4.2 乙型肝炎疫苗
- 5.4.3 轮状病毒疫苗
- 5.4.4 脑膜炎球菌疾病疫苗
- 5.4.5 表 3:美国及同等发达经济体脑膜炎球菌疾病年发病率(每 10 万人),及 1998-2002 年至 2023-2024 年的发病率变化百分比。“推荐所有儿童接种脑膜炎球菌疫苗的国家” 包括澳大利亚、奥地利、比利时、加拿大、法国、德国、希腊、爱尔兰、荷兰、葡萄牙、西班牙、瑞士、英国、美国,这些国家的发病率降幅在 – 2% 至 – 92% 之间,平均降幅为 – 78%;“不推荐所有儿童接种脑膜炎球菌疫苗的国家” 包括丹麦、芬兰、挪威、瑞典,发病率降幅在 – 44% 至 – 87% 之间,平均降幅为 – 75%。
- 5.4.6 流感疫苗
- 5.4.7 新冠疫苗
- 6 5. 后续步骤
- 7 作者简介
Assessment of the U.S. Childhood and Adolescent Immunization Schedule Compared to Other Countries
2026 年 1 月 2 日
特蕾西・贝丝・赫格医学博士、哲学博士(美国食品药品监督管理局药品评价与研究中心代理主任,同时担任美国免疫实践咨询委员会食品药品监督管理局当然成员);马丁・库尔多夫哲学博士(美国卫生与公众服务部规划与评估助理部长办公室首席科学与数据官)。本评估报告由上述两位学者在咨询美国疾病控制与预防中心、食品药品监督管理局、国立卫生研究院及医疗保险和医疗补助服务中心专家的基础上撰写而成。
执行摘要
2025 年 12 月 5 日,特朗普总统发布总统备忘录 ¹,指示美国卫生与公众服务部部长及疾病控制与预防中心(以下简称 “疾控中心”)代理主任,参考同等发达经济体在儿童疫苗接种建议及相关科学依据方面的最佳实践。总统要求,若发现国外存在更优实践,需对美国核心儿童疫苗接种计划进行更新。
本评估报告以科学为基础、以证据为支撑、以数据为驱动,旨在响应总统指令,论证调整美国儿童疫苗接种计划的必要性。报告将美国与同等发达经济体进行对比,分析疫苗接种率与公众信任度,探讨临床和流行病学考量因素及知识缺口,剖析疫苗强制接种政策,并提出近期与长期行动建议及后续步骤。
在同等发达经济体中,美国儿童疫苗接种计划涵盖的目标疾病种类及建议接种的疫苗总剂次均处于异常偏高水平 ²。
疾控中心代理主任应立即考虑更新儿童免疫接种计划,将 10 种疾病的疫苗 —— 麻疹、腮腺炎、风疹、脊髓灰质炎、百日咳、破伤风、白喉、B 型流感嗜血杆菌(Hib)、肺炎球菌疾病及人乳头瘤病毒(HPV)疫苗(这些疫苗的接种建议在同等发达经济体中已形成国际共识),以及水痘疫苗(统称 “共识疫苗”),归为所有儿童均需接种的推荐疫苗类别。该类疫苗将构成儿童核心疫苗接种计划的核心内容。本报告暂不对共识疫苗展开深入探讨。目前美国疫苗接种计划中包含的其他所有疫苗(统称 “非共识疫苗”),应针对高危人群和群体,或通过结合个体患者特征的共同临床决策来推荐使用(见图 1)。不应将任何现有疫苗归入 “不推荐接种” 类别。
因此,疾控中心代理主任应更新儿童免疫接种计划,使其明确包含以下三个不同组成部分:
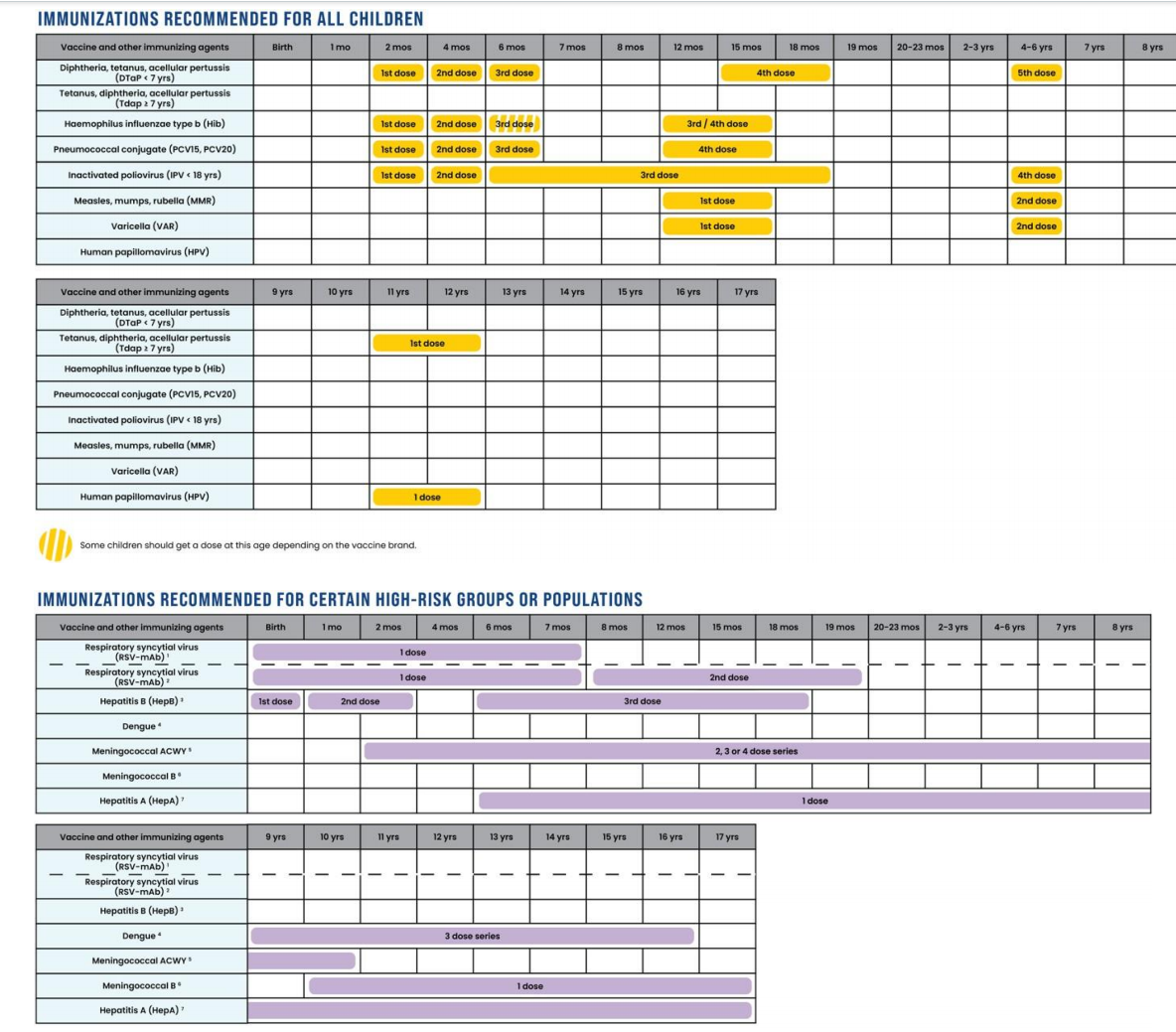
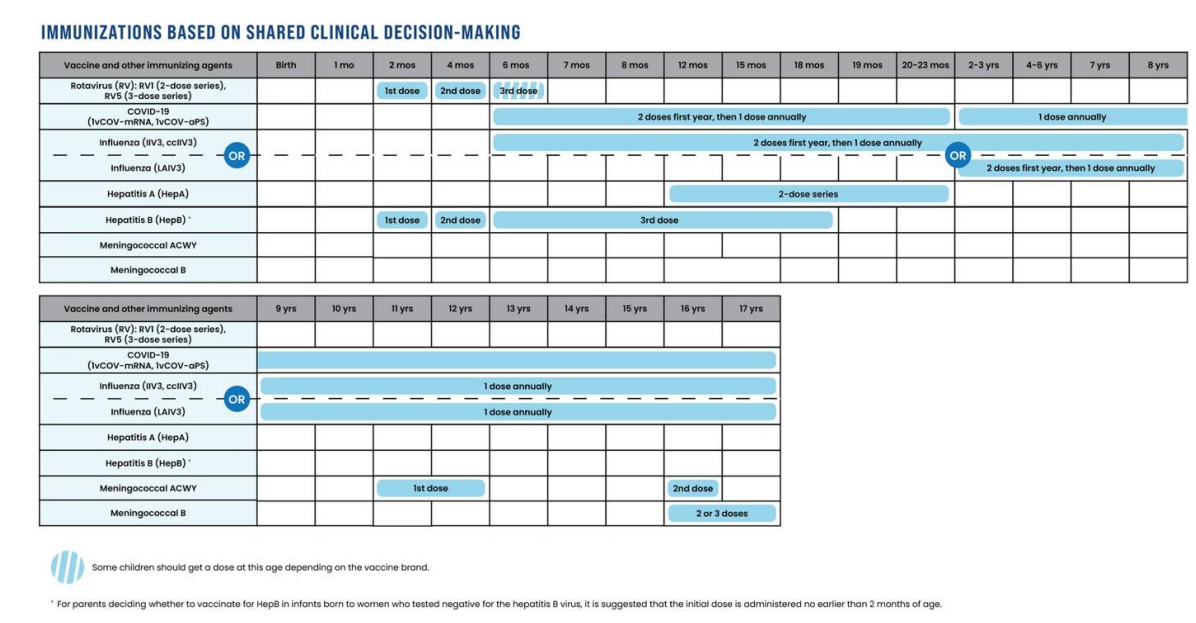
图 1:建议的 0-18 岁免疫接种计划,黄色部分为所有儿童均需接种的推荐疫苗,紫色部分为针对特定高危人群或群体的推荐疫苗,蓝色部分为需通过共同临床决策确定是否接种的疫苗。所有疫苗均面向所有儿童和青少年开放,且纳入保险覆盖范围,无需个人承担费用。
重要的是,截至 2025 年底疾控中心推荐的所有疫苗(且当时已纳入保险覆盖范围的疫苗),均应继续纳入保险覆盖范围且无需个人承担费用,同时保留在接种计划中。这将涵盖 2025 年儿童和青少年免疫接种计划所涉及的全部疾病。相比之下,在许多欧洲国家,未被推荐常规接种的疫苗通常不在保险覆盖范围内。通过将非共识疫苗明确为基于个体风险因素的可选疫苗,我们能更清晰地界定风险因素,进而识别出最有可能从这些疫苗中获得净收益的儿童群体。
2020 年至 2024 年间,美国公众对医疗体系的信任度从 71.5% 骤降至 40.1%³,这一时期恰逢学校停课、其他封锁措施实施、强制佩戴口罩、新冠疫苗强制接种(且事实上否认感染获得性免疫),以及其他缺乏科学依据、违背公共卫生基本原则的公共卫生建议。疫情期间公众对公共卫生机构的不信任感,已蔓延至这些机构提出的其他建议,包括疫苗接种相关建议。同期,美国全国儿童疫苗接种率下降,例如麻疹 – 腮腺炎 – 风疹(MMR)疫苗接种率从 95.2% 降至 92.7%⁴⁵,这增加了麻疹疫情暴发的潜在风险⁶。
与美国不同,大多数同等发达经济体并未推行疫苗强制接种政策,而是通过公众信任和科普教育维持较高的儿童疫苗接种率(见表 1)⁷。在美国,各州可自行制定儿童入学前必须接种疫苗的强制要求。教育对儿童发展至关重要,且与健康状况、收入水平等因素高度相关。新冠疫情期间,许多儿童错失了超过一年的在校学习时间,其学业表现受到负面影响⁵²。
疫苗的初衷是通过预防儿童感染特定传染病为其带来健康益处,但与所有药物一样,疫苗也存在风险,需在收益与风险之间进行权衡 ¹⁵。无论是疫苗获批前还是获批后,生产商对研究疫苗不良反应的积极性都不足;包括美国食品药品监督管理局(以下简称 “食药监局”)和疾控中心在内的监管机构,在上市后研究中发现不良反应的速度有时也较为迟缓 ¹⁶。因此,疫苗的安全性及风险往往缺乏充分的描述、量化分析和认知。目前,几乎没有科学有效的不良反应发生率数据,无法确定美国现行免疫接种计划与美国儿童慢性疾病发病率上升之间是否存在关联(若存在关联,关联程度如何)¹⁷。针对健康儿童、用于预防疾病(而非治疗或治愈疾病)的医疗干预措施,无论在上市前还是上市后,都应遵循最高安全标准 ¹⁸。
为解决儿童和青少年免疫接种计划的安全性问题,美国卫生与公众服务部(以下简称 “卫生与公众服务部”)应资助开展最高标准的科学研究,包括必要时进行大规模安慰剂对照随机试验,研究对象涵盖单一疫苗、联合疫苗及疫苗接种计划。暂且不讨论对未经充分安全性试验的医疗产品进行使用是否符合伦理,我们可通过多种符合伦理的方式开展研究,例如对疫苗接种时间进行随机分组 ¹⁹。此外,卫生与公众服务部还应资助并开展关于单一疫苗及免疫接种计划长期慢性不良反应的观察性研究。这将为患者 / 家长和医生提供更充分的信息,提升公众对公共卫生的信任,并推动全球疫苗科学的发展。
本评估报告仅纳入截至 2024 年底疾控中心建议所有儿童接种的疫苗,未涉及疫苗接种的时间、顺序及剂次(人乳头瘤病毒疫苗除外)。
使美国儿童免疫接种计划与同等发达经济体的共识保持一致,同时为高危人群和群体保留非共识疫苗的接种选择,或通过共同临床决策确定是否接种非共识疫苗,这种平衡的改革方式有助于重建公众对公共卫生的信任。结合对疫苗潜在危害的评估,此次改革有望恢复公众信心,为幼儿家长提供亟需的清晰指导,并维护疫苗接种项目的成效。
1. 疫苗接种率与公众信任度
1980 年,按照疾控中心免疫接种计划,美国儿童需接种 7 种疫苗、共 23 剂,以预防 7 种疾病(包括 1 剂麻疹 – 腮腺炎 – 风疹疫苗、5 剂白喉 – 破伤风 – 百日咳联合疫苗、1 剂破伤风 – 白喉联合疫苗,以及 4 剂口服脊髓灰质炎疫苗)。到 2024 年,建议的常规疫苗已增至针对 17 种疾病的至少 84 剂,需接种至少 57 针,此外还包括呼吸道合胞病毒单克隆抗体注射,共计覆盖 18 种疾病 ²⁰⁻²⁷。这一数量远超其他发达经济体(见表 2)²⁸。
1.1 疫苗接种率
在新冠疫情暴发前的十年间,美国儿童疫苗接种率保持在较高且稳定的水平 ²⁹。但疫情期间实施的封锁措施导致所有年龄段儿童的疫苗接种率均出现下降(见图 2)。尽管此后接种率有所回升,但因疫情造成的接种缺口始终未能通过补种得以填补 ³⁰。
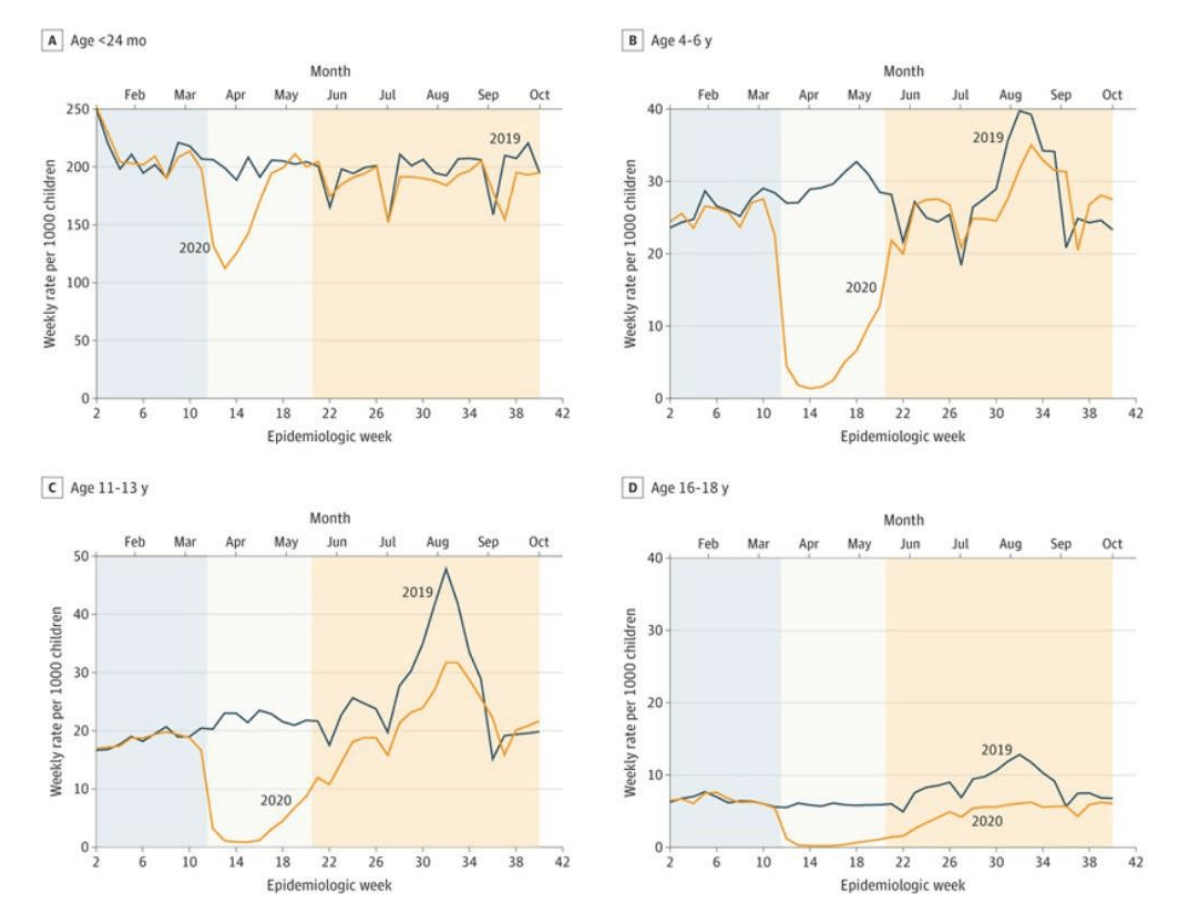
图 2:基于向疾控中心疫苗安全数据链报告数据的医疗计划,对比 2020 年封锁期间与 2019 年各年龄段儿童的疫苗接种率 ³¹。
信任是公共卫生领域的基本原则 ³²。要让公众信任公共卫生机构,这些机构首先需信任公众,包括提供准确信息,并在科学认知存在局限时坦诚告知。而在新冠疫情期间,这一原则的执行出现了严重问题。新冠疫苗强制接种政策、疾控中心关于疫苗获得性免疫优于感染获得性免疫的不实宣称 ³³⁻³⁶,以及声称新冠疫苗可预防感染和传播的说法 ³⁷⁻³⁹,导致公众对新冠疫苗失去信任。例如,尽管疾控中心在 2023 年仍建议所有儿童接种新冠疫苗加强针,但接种率不足 10%⁴⁰。
疫情期间公众信任的丧失不仅影响了新冠疫苗的接种率,还导致公众对疾控中心全套儿童免疫接种计划的依从性下降,包括麻疹、风疹、百日咳、脊髓灰质炎等共识疫苗的接种率也有所降低⁴¹。2019-2020 学年至 2023-2024 学年期间,儿童麻疹 – 腮腺炎 – 风疹疫苗接种率从 95.2% 降至 92.7%⁴²。
即便全国疫苗接种率处于较高水平,部分地区接种率偏低仍可能引发相关疾病病例增加。美国部分州的麻疹和风疹疫苗接种率已低于群体免疫阈值⁴³。2024-2025 学年,有 16 个州的麻疹 – 腮腺炎 – 风疹疫苗接种率低于 90%(见图 3)。风疹的群体免疫阈值为 83%-85%⁴⁴,爱达荷州、威斯康星州等部分州已面临风疹疫情暴发风险。
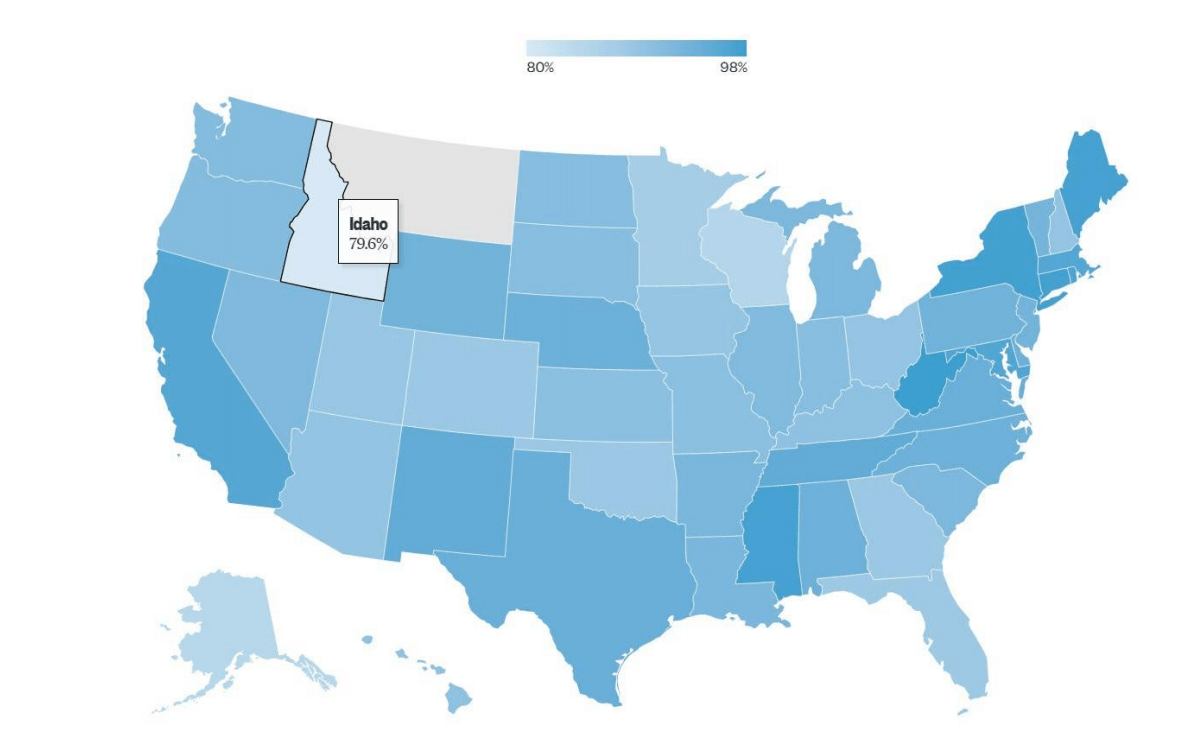
图 3:2023-2024 学年美国各州幼儿园儿童麻疹 – 腮腺炎 – 风疹疫苗第二剂接种率⁴⁵。爱达荷州为 79.6%,最高为 98%。
1.2 麻疹疫情暴发
当特定疾病的疫苗接种率降至社区群体免疫所需比例以下时,可能导致该疾病传播或病例增加⁴⁶。麻疹的最低疫苗接种覆盖阈值估计需超过 90%,低于此比例将增加病例出现的风险⁴⁷⁴⁸。截至 2025 年 12 月 31 日,美国已报告 49 起麻疹疫情(注:“疫情” 定义为 3 例及以上相关病例),在 2065 例确诊病例中,88%(1820 例)与疫情相关⁴⁹(见图 4)。
近期,美国、加拿大及欧洲大部分地区的麻疹病例均呈上升趋势,加拿大已失去麻疹消除状态⁵⁰。
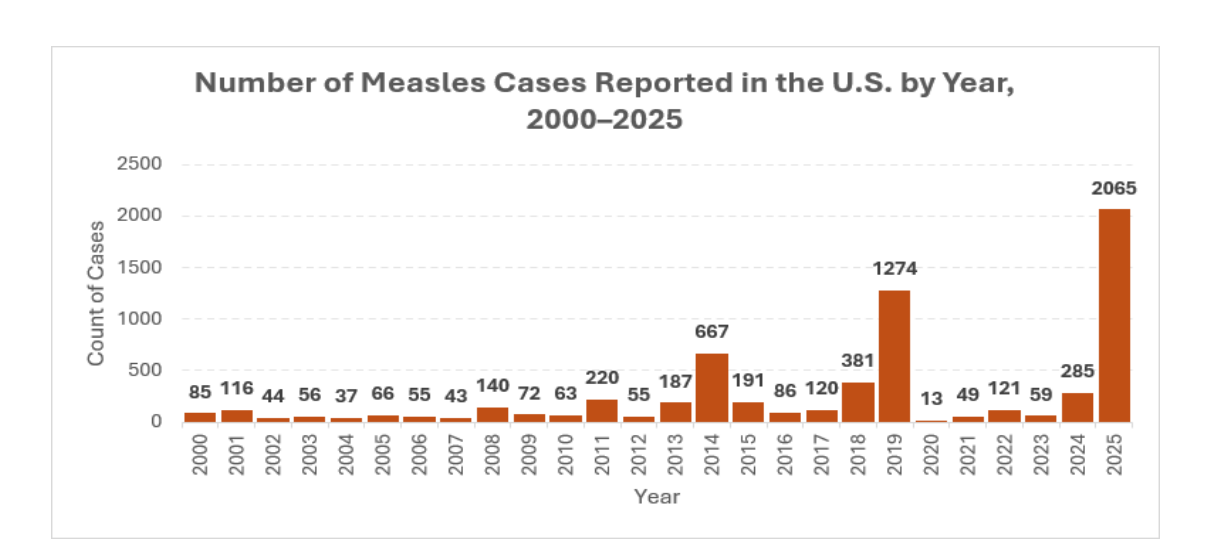
图 4:2000-2025 年美国麻疹报告病例数⁵¹。2025 年报告病例数为 2065 例。
1.3 疫苗强制接种政策与公众信任
除少数例外情况,同等发达经济体均未实施儿童疫苗强制接种政策。这些国家的经验表明,透明、可信的公共卫生机构在尊重知情同意的前提下,能够实现较高的自愿疫苗接种率(见表 1)。而美国是少数实施儿童疫苗强制接种政策(由各州自行制定)的同等发达经济体之一,儿童需接种指定疫苗方可入学(见表 2)。
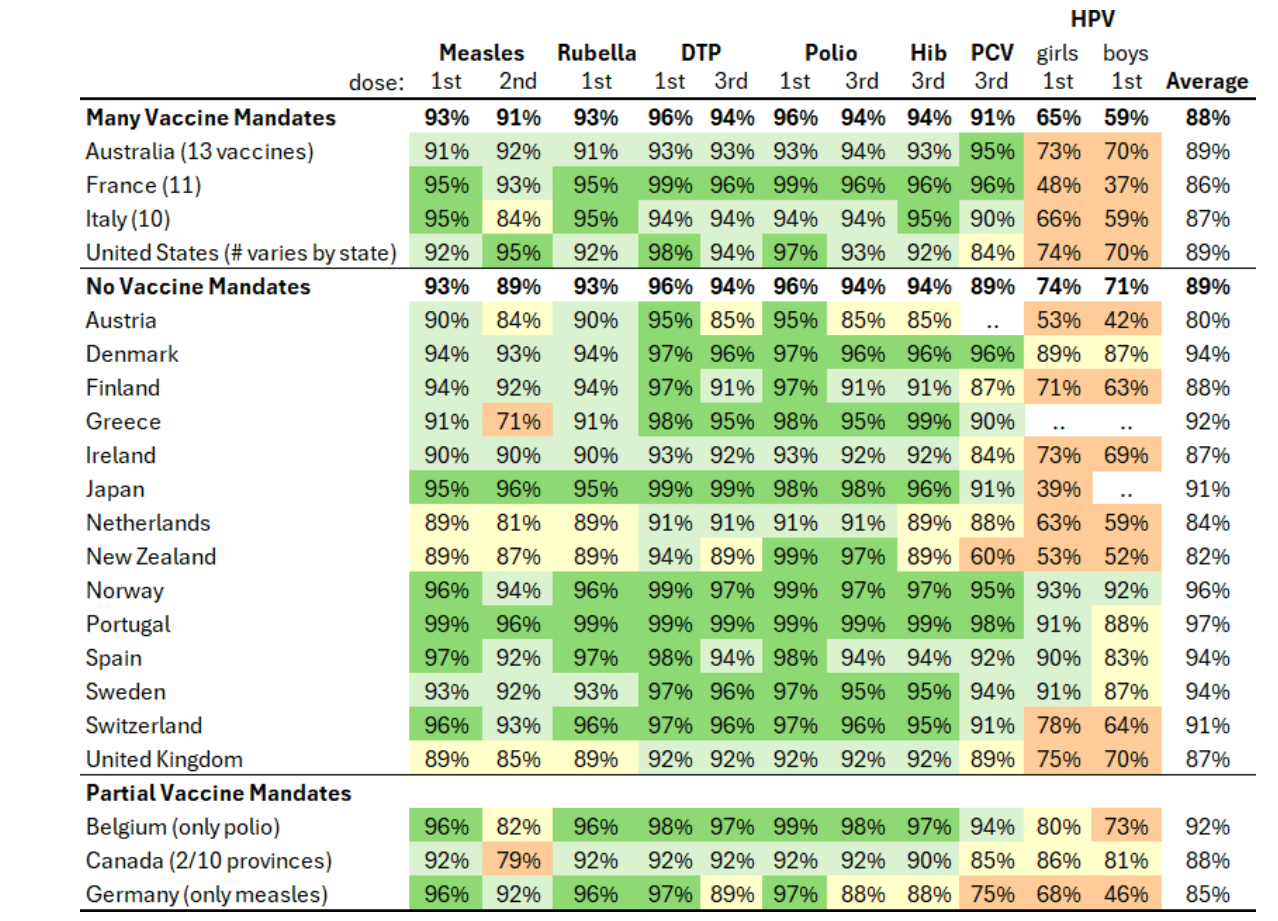
表 1:2024 年部分核心疫苗的国家免疫接种覆盖率估算(世界卫生组织 / 联合国儿童基金会数据)。“强制接种疫苗较多” 的国家包括澳大利亚(13 种疫苗)、法国(11 种)、意大利(10 种)、美国(各州要求不同);“无强制接种疫苗” 的国家包括奥地利、丹麦、芬兰、希腊、爱尔兰、日本、荷兰、新西兰、挪威、葡萄牙、西班牙、瑞典、瑞士、英国。表格中涵盖人乳头瘤病毒疫苗(女孩、男孩)、麻疹疫苗(第一剂、第三剂)、风疹疫苗(第二剂)、白喉 – 破伤风 – 百日咳联合疫苗(第一剂、第三剂)、脊髓灰质炎疫苗(第一剂、第三剂)、B 型流感嗜血杆菌疫苗(第一剂、第三剂)、肺炎球菌结合疫苗(第一剂、第三剂)的接种率数据及平均值。
医学伦理的基本原则之一是禁止强迫或要求他人接受医疗干预,知情同意是美国及全球医疗实践的核心准则⁵⁵。美国医学会《医学伦理法典》指出:“医疗治疗中的知情同意在伦理和法律层面均具有根本性意义。患者有权获取关于推荐治疗方案的信息并提出疑问,以便对医疗护理做出周全决策。医患之间有效的沟通有助于建立信任,为共同决策提供支持。”⁵⁶ 美国公共卫生协会《公共卫生伦理法典》也强调:“公共卫生实践的有效性和伦理性,依赖于尊重个人自主权、自决权、隐私权,以及在人际和机构层面消除各种形式支配的社会文化环境。”⁵⁷
部分同等发达经济体已意识到,每新增一种疫苗都可能削弱公众对整个儿童免疫接种计划的信任,进而导致共识疫苗接种率下降。丹麦卫生部门明确表示,若某种疫苗对非高危人群的益处有限,或相关疾病不致死且不会导致长期残疾,则反对将其纳入常规儿童免疫接种计划⁵⁸。例如,丹麦公共卫生机构在决定不建议所有儿童接种乙型肝炎(乙肝)疫苗时指出:“若将部分人认为非必需的疫苗纳入计划,可能会对公众对疫苗的整体看法产生负面影响,最终导致现有疫苗接种计划的覆盖率下降”,并强调 “高覆盖率疫苗接种计划成功的前提之一,是公众认为接种疫苗是一项有吸引力的选择”⁵⁹。
医患互信是医疗领域的另一个关键要素⁶⁰。在美国,医疗保险公司会根据医生所负责患者群体的疫苗接种率向医生提供经济奖励⁶¹,这种机制可能促使医生采用强制方式推动疫苗接种,既破坏公众对疫苗接种计划的信任,又可能形成不愿质疑疫苗安全性的医疗文化。此外,若家长拒绝为孩子接种某些疫苗,许多儿科医生会将这些儿童从自己的接诊名单中移除,导致这些儿童难以获得医疗服务⁶²。
部分家长对儿童在同一天接种多种独立(非多价联合)疫苗的做法表示担忧⁶³,原因是关于同一接种计划中不同疫苗间相互作用的上市后流行病学研究数据十分有限⁶⁴。丹麦通过多种方式尽量减少同时接种多种疫苗的情况,例如在儿童出生后第一年分三次接种五价疫苗(可预防 5 种疾病)、将麻疹 – 腮腺炎 – 风疹疫苗与白喉 – 破伤风 – 百日咳联合疫苗的接种安排在不同时间、减少儿童需预防的疾病种类⁶⁵。在未实施疫苗强制接种政策的情况下,丹麦的共识疫苗接种率始终保持在较高水平,且未出现严重疾病疫情⁶⁶⁶⁷。
若美国调整儿童疫苗接种计划,不再将非共识疫苗列为常规推荐疫苗,可减少强制接种现象,提升公众信任度。
| 成功的儿童疫苗接种计划需建立在患者 / 家长与医生 / 公共卫生机构之间的互信基础上,这种信任基于四大支柱:
1. 关于疫苗的科学坦诚,包括已知信息与未知信息;
2. 知情同意,而非强制要求;
3. 基于循证科学的疫苗审批流程,以及对疫苗安全性和风险的全面上市后评估;
4. 参考同等发达经济体经验制定的疫苗推荐建议。 |
|---|
2. 知识缺口
美国医学研究院(IOM)2013 年发布的一份报告指出:“与所有药物或医疗干预措施一样,疫苗既非 100% 无风险,也非 100% 有效。”⁶⁸ 因此,建立一套强有力的、以科学为基础的风险监测体系至关重要,该体系应包括上市前安慰剂对照随机试验和上市后观察性药物警戒研究。若上市前试验未能发现问题,需确保在上市后尽快检测到潜在风险⁶⁹⁷⁰。完善的临床试验和安全监测体系是维护公众对推荐儿童疫苗接种计划信任的关键。
2.1 儿童疫苗的证据现状
鉴于美国公众对现行儿童疫苗接种计划的信任度日益下降,亟需开展更多高质量的科学研究,包括最高标准的安慰剂对照随机试验⁷¹,以填补在潜在副作用及风险 – 收益比方面的知识缺口。在更多研究完成之前,儿童疫苗接种建议必须基于现有最佳证据(无论其局限性如何)及同等发达经济体的最佳实践。
为给儿童疫苗接种计划奠定坚实的科学基础,并为全球儿童疫苗接种最佳实践提供参考,卫生与公众服务部下属机构应资助开展最高标准的科学研究,评估共识疫苗和非共识疫苗的整体健康效益、不同疫苗间的相互作用,以及疫苗接种计划的其他相关方面。安慰剂对照随机试验可通过符合伦理的方式开展,例如对疫苗接种年龄进行随机分组(对照组在较小年龄时接种安慰剂,在较大年龄时接种疫苗)⁷²,或针对国际上接种建议尚未达成共识的疫苗进行研究。
坚信疫苗安全的人士会支持开展随机安慰剂对照试验,因为若疫苗确实安全,试验结果将证明这一点;而担忧疫苗潜在副作用的人士也会支持此类试验,因为若存在问题,试验可帮助发现风险。在这些研究完成之前,卫生与公众服务部应继续根据现有最佳证据及同等发达经济体的最佳实践,制定儿童疫苗接种建议。
2.2 疫苗安全监测体系
安全监测体系需具备高度可靠性、最大限度减少偏差,且规模足以有效检测可能使风险 – 收益比向不利于疫苗方向倾斜的风险。对于每种疫苗,需持续计算低危和高危儿童的 “需接种人数”(NNV)和 “需伤害人数”(NNH)—— 随着对疫苗危害的认知不断深入,以及对疫苗预防重症效果的新信息不断获取,这两个指标需及时更新,并为疾控中心的推荐建议提供依据。
美国的上市后监测体系在监测疫苗接种后数天或数周内可能出现的潜在不良反应方面存在局限,相关体系包括疫苗不良事件报告系统(VAERS)⁷³、疾控中心疫苗安全数据链(VSD)⁷⁴及食药监局生物制剂有效性与安全性(BEST)系统⁷⁷⁵。在疫苗获批后一年内,这些系统已确认部分严重危害,例如轮状病毒疫苗相关的肠套叠⁷⁶⁷⁷、麻疹 – 腮腺炎 – 风疹 – 水痘联合疫苗相关的热性惊厥⁷⁸,以及信使核糖核酸(mRNA)新冠疫苗相关的过敏反应⁷⁹和心肌炎⁸⁰。
然而,这些系统存在严重缺陷,且未得到充分利用,尤其在评估疫苗长期影响及疫苗接种计划中多种因素综合作用方面。疫苗可能在接种数月或数年后引发不良反应或被确诊相关疾病。例如,疾控中心疫苗安全数据链 2023 年的一项研究发现,儿童接触的铝佐剂越多,持续性哮喘的发病率越高 —— 每毫克铝的风险比估计为 1.19(95% 置信区间:1.14-1.25)⁸¹。与未接触铝佐剂的儿童相比,接触平均剂量铝佐剂的儿童患哮喘的风险比为 2.0(95% 置信区间:1.7-2.5),风险增加一倍。但此类研究实属罕见,目前尚未针对疫苗与哮喘、过敏、自身免疫性疾病、神经系统疾病、耳部感染或其他感染性疾病等长期健康结局之间的关联开展充分研究⁸²。
2.3 疫苗接种计划
过去四十年间,儿童疫苗接种计划不断扩展,但主流机构从未对整个计划的效果进行全面评估并发布报告。美国医学研究院曾呼吁开展此类研究⁸³⁸⁴。2013 年,美国医学研究院在一份报告中建议卫生与公众服务部 “将儿童免疫接种计划整体安全性研究纳入研究重点设定流程,充分考虑相关利益方的关切,并基于流行病学证据、生物学合理性和可行性确定研究重点”,同时 “继续资助和支持疫苗安全数据链项目,开展推荐免疫接种计划的安全性研究”⁸⁵。尽管已开展部分重要研究(例如上述关于疫苗佐剂与哮喘关联的研究)⁸⁶,但整体进展缓慢。目前仍存在大量知识缺口,美国医学研究院认为可行且有必要开展的众多研究中,仅有少数得以实施。
2.4 填补知识缺口
除随机安慰剂对照疫苗试验外,卫生与公众服务部还应扩大并加强大规模人群观察性研究和数据的应用,以评估疫苗安全性。疫苗接种计划的任何调整都应伴随科学研究,评估更新后的免疫接种计划对目标传染病、其他感染性疾病、急性不良反应及慢性疾病(如哮喘、过敏、自身免疫性疾病、发育障碍(包括注意力缺陷多动障碍、发育迟缓、学习障碍、智力障碍、语言障碍和抽动症)、神经系统疾病、癫痫、糖尿病、生育问题和湿疹)的短期和长期影响。重点研究方向包括:对比接种疫苗与未接种疫苗儿童健康结局的观察性队列研究;若发现问题,进一步评估疫苗的最佳剂次、儿童疫苗接种的时间和顺序、同日接种多种疫苗的相互作用、针对同一疾病的多价疫苗与单价疫苗对比、疫苗佐剂,以及不同免疫接种计划的效果。
为评估疫苗对慢性疾病的长期影响,应采用回顾性和前瞻性队列研究设计,确保样本量充足且随访时间足够长。
在大规模人群样本研究中,可通过复杂的统计方法最大限度减少观察性研究中的偏差,例如倾向得分匹配的多种形式⁸⁷⁸⁸、逆概率加权⁸⁹(可改善暴露组和非暴露组之间的协变量平衡)。自身对照法也是减少观察性疫苗研究偏差的一种方法,可消除个体间的混杂因素⁹⁰。
若样本量足够大,且分析过程严谨、系统,还可识别出不良反应风险较高的特定人群亚组。
| 成功的儿童疫苗接种计划必须以坚实的科学证据为基础,这意味着:
1. 用于大规模接种的新疫苗,其审批应基于双盲安慰剂对照随机试验,但目前这一要求很少得到满足;
2. 对于新疫苗,必须建立上市后监测体系,以快速发现意外不良反应;
3. 除急性不良反应外,还需评估疫苗对免疫系统的长期影响,如哮喘、自身免疫性疾病、神经系统疾病和非目标感染性疾病。目前相关基础设施已部分建成,但未得到充分利用;
4. 除单一疫苗外,还需全面评估免疫接种计划的安全性,包括累积效应、疫苗类型和成分、接种时间和顺序,以及相互作用。美国医学研究院长期以来一直呼吁开展此类研究,但进展缓慢。 |
|---|
3. 儿童免疫接种计划的国际对比
表 2 将美国 2024 年儿童疫苗接种计划⁹¹ 与 20 个同等发达经济体的计划进行了对比,这些国家包括澳大利亚⁹²、奥地利⁹³、比利时⁹⁴、加拿大⁹⁵、丹麦⁹⁶、芬兰⁹⁷、法国⁹⁸、德国⁹⁹、希腊 ¹⁰⁰、爱尔兰 ¹⁰¹、意大利 ¹⁰²、日本 ¹⁰³、荷兰 ¹⁰⁴、新西兰 ¹⁰⁵、挪威 ¹⁰⁶、葡萄牙 ¹⁰⁷、西班牙 ¹⁰⁸、瑞典 ¹⁰⁹、瑞士 ¹¹⁰和英国 ¹¹¹。
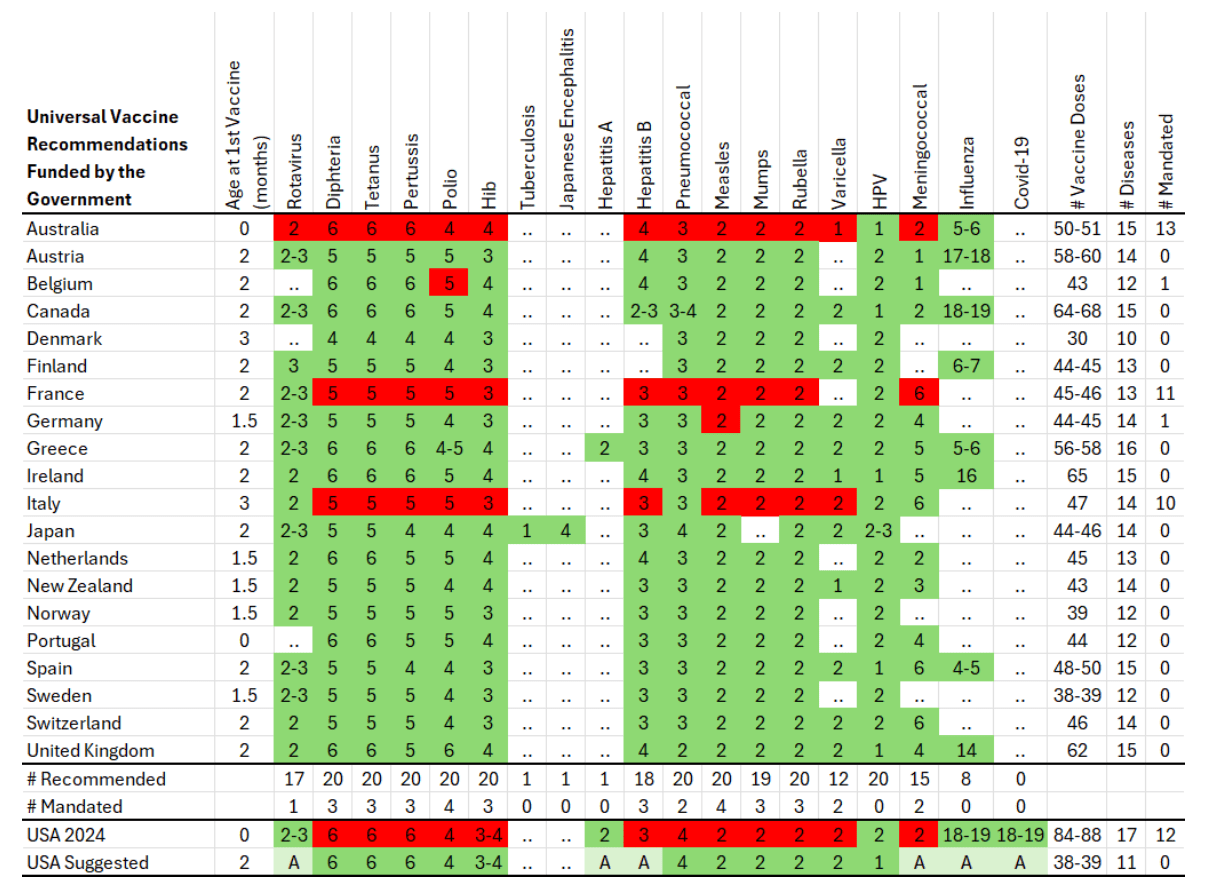
表 2:同等发达经济体针对所有儿童的推荐疫苗数量(不包括单克隆抗体)。疫苗剂次数量多于注射次数或所预防疾病种类数量。例如,麻疹 – 腮腺炎 – 风疹疫苗注射一针包含三种疫苗成分,分别针对麻疹、腮腺炎和风疹。红色标注表示疫苗为入学等场景的强制要求 ¹¹²,深绿色标注表示疫苗推荐所有儿童接种且由政府资助。表格中涵盖各国推荐的疫苗种类数量、剂次数量、注射次数、针对的疾病种类数量,以及是否为强制接种等信息。美国 2024 年推荐针对 17 种疾病的疫苗,剂次为 84-88 剂,注射次数为 57-71 次;若包含呼吸道合胞病毒单克隆抗体注射,则预防疾病种类为 18 种,注射次数为 72 次。丹麦推荐针对 10 种疾病的疫苗,共 30 剂,注射次数为 11 次。
2024 年,美国推荐的儿童疫苗种类多于任何同等发达经济体,剂次数量更是部分欧洲国家的两倍多。其中,丹麦的疫苗接种计划最为精简,仅针对 10 种疾病,推荐接种 30 剂疫苗。通过使用多价疫苗,丹麦的接种计划仅需 11 次注射:3 次五价疫苗(预防白喉、破伤风、百日咳、B 型流感嗜血杆菌感染、脊髓灰质炎)、1 次四价疫苗(预防白喉、破伤风、百日咳、脊髓灰质炎)、3 次肺炎球菌结合疫苗、2 次麻疹 – 腮腺炎 – 风疹疫苗,以及 2 次人乳头瘤病毒疫苗 ¹¹³。
相比之下,2024 年美国推荐常规接种针对 17 种疾病的疫苗,根据疫苗产品和出生日期不同,需接种 84-88 剂,若使用多价疫苗情况不同,需注射 57-71 次(其中轮状病毒疫苗为口服,需 2-3 剂)。若婴儿同时接受呼吸道合胞病毒单克隆抗体注射,则需注射 72 次,以预防 18 种疾病 ¹¹⁴。
各国在制定疫苗接种建议时会考虑多种因素,但如果疾病流行情况相似,且无基础疾病的儿童面临的目标疾病风险相近,那么在疫苗剂次、预防疾病种类和接种时间上的差异,往往反映出医疗界对 “最佳实践” 存在合理不确定性。医疗界内部这种不确定性和分歧被称为 “临床均衡”¹¹⁵。
美国儿童免疫接种计划针对的每种疾病都存在健康风险,但风险水平因疾病而异,有时还会因个体基础风险因素不同而有差异。然而,疫苗的存在并不意味着所有儿童都适合接种,也不必然意味着应将其纳入常规接种计划。
尽管所有同等发达经济体均一致推荐一组共识疫苗,但美国儿童免疫接种计划中目前包含的部分疫苗(甲型肝炎疫苗、水痘疫苗、流感疫苗、轮状病毒疫苗和脑膜炎球菌疫苗)在其他部分发达经济体中,要么推荐范围有限,要么未被纳入推荐计划(见表 2)。另一个显著差异是,大多数国家通过公众对公共卫生机构的信任来维持高接种率,而非依赖疫苗强制接种政策(表 2 中红色部分)。
在多种儿童疫苗的普及使用和接种时间上,全球各国存在差异。这些差异有时反映了不同地区疾病流行病学的独特性,但更多情况下是由于科学证据不足和知识缺口导致的 —— 对风险和收益的评估不够充分,进而产生不同解读。美国各州及专业协会之间在疫苗接种建议上的分歧 ¹¹⁶,进一步凸显了制定更具适应性的儿童免疫接种计划的必要性和可能性。
不同国家在疾病暴露情况和医疗体系方面存在差异。美国通过私人保险、各州医疗补助计划、儿童健康保险计划(CHIP)和儿童疫苗计划(VFC)相结合的方式,为儿童提供医疗服务保障。
免疫接种计划更新后,应继续将共识疫苗和非共识疫苗纳入广泛的保险覆盖范围。明确接种计划中的共识疫苗,可帮助美国民众做出知情决策,同时让希望为孩子接种非共识疫苗的家长也能获得此类疫苗。通过开展适当的疫苗研究,深入了解哪些人群最有可能从特定疫苗中获益,以及哪些情况下可能无需接种疫苗,具有重要意义。
| 成功的儿童疫苗接种计划可借鉴同等发达经济体的成功经验,尤其是:
1. 美国在儿童疫苗接种数量上处于国际异常水平,且共识疫苗接种率已出现下降;
2. 要重建公众对美国儿童免疫接种计划的信任,一种可行方法是使美国的疫苗接种计划与同等发达经济体的共识疫苗组成更好地保持一致,同时不限制民众获取其他疫苗的途径。 |
|---|
4. 推荐的儿童免疫接种计划
为提升公众信任,公共卫生机构应坦诚面对疫苗相关知识缺口。若缺乏样本量充足、随访时间足够长以全面评估安全性的安慰剂对照随机试验,且未开展对比暴露人群与非暴露人群的长期随访上市后队列研究,我们将缺乏评估疫苗潜在危害所需的基础数据。因此,儿童疫苗接种建议必须基于现有最佳证据及同等发达经济体的最佳实践。对于麻疹疫苗等明确具有显著收益的疫苗,只有当风险达到较高水平时,才可能超过收益;而对于甲型肝炎疫苗等收益有限的疫苗,即使是较小的风险也可能使风险大于收益。对于此类疫苗,采取更谨慎的态度更为稳妥。许多同等发达经济体已选择将核心疫苗限定在收益潜力最大的疾病领域。关于如何界定这一范围,不同国家可能存在合理分歧,并据此做出不同决策。
与所有医疗程序一样,疫苗接种决策绝不应涉及强制手段,而应始终基于知情同意,最终决策权归患者 / 家长所有。强制手段会使知情同意失去效力,损害这一基本权利。
4.1 疫苗接种类别
所有儿童均需接种的疫苗
这类疫苗(如麻疹疫苗)的接种建议在同等发达经济体中已形成共识,所有儿童均应接种。所有类型的健康保险都应覆盖此类疫苗,且无需个人承担费用。
特定高危人群或群体需接种的疫苗
与所有医疗产品一样,疫苗对不同人群的风险 – 收益比存在差异,这可能源于个体基础疾病、疾病暴露风险异常升高,或存在疾病传播给他人的风险。例如,前往甲型肝炎流行地区旅行的儿童需接种甲型肝炎疫苗,母亲为乙肝表面抗原阳性的新生儿需在出生时接种乙肝疫苗。本报告未评估针对高危人群的疫苗推荐建议,也未提议对此类建议进行任何调整。所有类型的健康保险都应覆盖此类疫苗,且无需个人承担费用。
需通过共同临床决策确定是否接种的疫苗
共同临床决策建议需结合个体情况,由医疗服务提供者与患者或家长 / 监护人共同讨论后确定 ¹¹⁷。公共卫生机构有时难以清晰界定哪些人能从疫苗中获益、哪些人存在相关风险因素,或哪些人面临疾病暴露风险。而了解儿童情况的家长和医生可能更适合做出此类判断。在共同临床决策过程中,需考虑个体特征,包括疾病暴露可能性、感染疾病后的发病和死亡风险、从疫苗中获益的可能性、发生疫苗不良反应的可能性,以及疾病传播给他人的风险。有时,还需考虑个人和家庭的偏好、信仰和认知,例如患者提供的关于疫苗上市前和上市后安全性数据的特定信息,或家庭接种疫苗的既往经验。
尽管此类疫苗不推荐所有儿童常规接种,但任何有需求的人都应能获得,且医疗补助计划、儿童健康保险计划、儿童疫苗计划及私人健康保险均应覆盖此类疫苗,无需个人承担费用。这与部分同等发达经济体形成对比 —— 在这些国家,此类疫苗需个人自费购买 ¹¹⁸。
不推荐接种的疫苗
目前推荐接种的疫苗均不应归入此类。有些疫苗因效果不佳、存在已知副作用或在美国的疾病流行率较低,不推荐任何人接种。例如,卡介苗(用于预防结核病)在许多国家广泛使用,但美国不推荐儿童接种 ¹¹⁹。此类疫苗即便获得食药监局批准,仍可能需个人自费购买,且不纳入医疗补助计划、儿童健康保险计划或儿童疫苗计划的覆盖范围。
4.2 所有儿童均需接种的疫苗
麻疹、腮腺炎、风疹、白喉、破伤风、百日咳、脊髓灰质炎、B 型流感嗜血杆菌及肺炎球菌疾病疫苗(麻疹 – 腮腺炎 – 风疹疫苗、白喉 – 破伤风 – 百日咳联合疫苗、脊髓灰质炎灭活疫苗、B 型流感嗜血杆菌疫苗、肺炎球菌结合疫苗)
这些疫苗属于共识疫苗,除日本不推荐腮腺炎疫苗外(见表 2),所有 20 个同等发达经济体的儿童免疫接种计划均包含这些疫苗。作为共识疫苗,它们应继续保留在美国免疫接种计划中,推荐所有儿童接种。尽管其安全性 / 风险特征尚未完全明确,仍需进一步研究,但同等发达经济体一致认为这些疫苗针对目标疾病具有显著收益。聚焦此类疫苗,更有可能扭转其接种率下降的趋势 ¹²⁰。
人乳头瘤病毒疫苗
人乳头瘤病毒疫苗的接种建议在国际上也已形成共识,应继续推荐所有儿童 / 青少年接种,但剂次应从两剂减为一剂。研究表明,一剂接种与两剂接种的效果相当或接近 ¹²¹⁻¹²⁴。澳大利亚、加拿大、爱尔兰、西班牙和英国已将推荐剂次更新为一剂(见表 2)¹²⁵⁻¹²⁷。
水痘疫苗
水痘带状疱疹病毒可引起水痘(多见于儿童),感染者在成年后病毒可能再激活引发带状疱疹。部分国家对将水痘疫苗纳入儿童接种计划持谨慎态度,原因之一是担心其对成年人的长期影响 ¹²⁸,但一旦该疫苗已被广泛使用,是否取消接种也需谨慎考量 ¹²⁹。美国儿童水痘疫苗两剂接种率估计为 92%¹³⁰。若仅部分人群(两剂接种率 60%-80%)接种水痘疫苗,可能导致人群自然感染水痘的平均年龄升高,而成年后感染水痘的并发症风险更高。因此,同等发达经济体一致认为,一旦水痘疫苗已实现广泛接种,取消其接种可能引发并发症风险增加 ¹³¹¹³²。基于上述原因,水痘疫苗应继续推荐所有儿童接种。
4.3 特定高危人群或群体需接种的疫苗
呼吸道合胞病毒单克隆抗体,以及甲型肝炎、乙型肝炎、B 群脑膜炎球菌、ACWY 群脑膜炎球菌和登革热疫苗:本报告未评估哪些高危人群或群体应接种这些疫苗,因此不提议调整相关推荐建议。
4.4 需通过共同临床决策确定是否接种的疫苗
甲型肝炎疫苗
目前美国有两种经食药监局批准的甲型肝炎疫苗:1995 年获批的 Havrix 疫苗和 1996 年获批的 Vaqta 疫苗。疫苗获批初期,建议接种人群主要为 “前往疾病流行地区的旅行者、高流行地区的儿童、男同性恋者、静脉注射毒品使用者、直接接触非人类灵长类动物或甲型肝炎病毒的工作人员、30 岁以上患有慢性肝病的患者,以及肝移植受者或等待肝移植的患者”¹³³。对于儿童,该疫苗最初仅推荐高流行社区的儿童接种。到 2006 年,美国的高流行社区已消失,当时疾控中心将 12-23 月龄儿童两剂接种方案纳入全民推荐的儿童免疫接种计划。2006 年,美国甲型肝炎的年发病率已降至约 1/10 万,且此后一直维持在这一较低水平。该病年死亡率为 1/1000 万,其中老年男性死亡率最高 ¹³⁴⁻¹³⁶。
针对 Havrix 疫苗在幼儿中的应用,曾开展一项随机试验(样本量 40119 人),以乙型肝炎疫苗 Engerix-B 作为对照 ¹³⁷;而针对 Vaqta 疫苗在儿童中的 III 期随机试验(样本量 1037 人),则以含铝和汞的稀释剂作为对照 ¹³⁸。因此,由于缺乏正规的安慰剂对照随机试验,该疫苗的可靠安全性数据十分有限。
在同等发达经济体中,仅有希腊将甲型肝炎疫苗纳入儿童常规推荐疫苗(见表 2)。考虑到美国甲型肝炎发病率和死亡率较低,且缺乏随机安慰剂对照安全性数据,该疫苗对大多数儿童的风险 – 收益比充其量仅处于较低水平。对于前往发展中国家高流行地区旅行的儿童,接种该疫苗的收益明确,但风险仍不明确 ¹³⁹。
甲型肝炎疫苗不应推荐所有儿童常规接种,但应通过共同临床决策,为所有家长希望接种的儿童提供该疫苗,且纳入保险覆盖范围,无需个人承担费用。
乙型肝炎疫苗
若母亲为乙肝表面抗原阳性或状态不明,新生儿应在出生时同时接种乙型肝炎疫苗和乙型肝炎免疫球蛋白。若母亲乙肝表面抗原检测为阴性,在 20 个同等发达经济体中,仅有澳大利亚和葡萄牙推荐所有新生儿在出生时接种乙型肝炎疫苗,另有两个国家不推荐新生儿接种该疫苗(见表 2)。在 2025 年 12 月的会议上,美国免疫实践咨询委员会借鉴大多数同等发达经济体的做法,投票决定不再推荐母亲乙肝表面抗原检测为阴性的新生儿在出生时接种乙型肝炎疫苗,而是建议结合每个儿童的风险特征,通过共同临床决策确定是否接种 ¹⁴⁰。
轮状病毒疫苗
轮状病毒感染较为常见,在轮状病毒疫苗问世前,美国及全球几乎所有儿童都会感染该病毒 ¹⁴¹。在发展中国家,许多儿童因感染轮状病毒后出现脱水而死亡,因此接种疫苗的收益更大 ¹⁴²。
在美国,轮状病毒感染可能导致儿童因胃肠炎住院,但该病毒几乎不会导致死亡或慢性疾病。疾控中心数据显示,1999-2005 年期间(当时 RotaShield 疫苗已退出市场,RotaTeq 疫苗尚未获批),美国 15 岁以下儿童中,每年平均有 3.3 人的死亡证明上列出轮状病毒诊断代码 ¹⁴³。RotaTeq 疫苗于 2006 年获批,Rotarix 疫苗于 2008 年获批。这些疫苗被推荐所有儿童接种后,2009-2020 年期间,相关死亡人数降至每年 1.6 人 ¹⁴⁴。这一微小降幅可能由多种与疫苗无关的因素导致,例如医疗水平提升、诊断方式变化或随机波动。
RotaShield 疫苗因与肠套叠风险增加相关而退出市场 ¹⁴⁵。目前使用的新型轮状病毒疫苗虽肠套叠风险较低,但仍有约 1-2/10 万接种儿童会发生该不良反应 ¹⁴⁶。
对于是否推荐所有儿童接种轮状病毒疫苗,不同人士可能持有不同观点。在同等发达经济体中,比利时、丹麦和葡萄牙不推荐该疫苗常规接种。丹麦给出的理由是,该病毒对几乎所有儿童的致死风险和慢性疾病风险都极低 ¹⁴⁷。
轮状病毒疫苗不应作为共识疫苗推荐所有儿童常规接种,但应通过共同临床决策,为所有家长希望接种的儿童提供该疫苗,且纳入保险覆盖范围,无需个人承担费用。
脑膜炎球菌疾病疫苗
在同等发达经济体中,15 个国家推荐所有儿童接种脑膜炎球菌疫苗,5 个国家仅推荐高危人群接种(见表 2)。过去几十年间,无论是否实施儿童常规疫苗接种政策,各国脑膜炎球菌疾病发病率均呈下降趋势,且降幅与接种政策无关(见表 3)。目前美国脑膜炎球菌疾病发病率为 0.12/10 万,即约每百万人口每年 1 例。
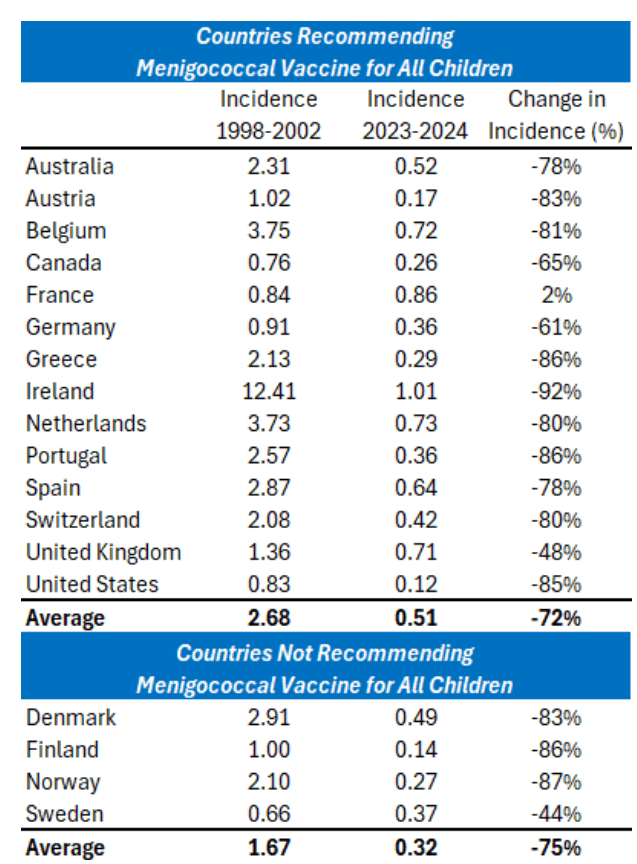
表 3:美国及同等发达经济体脑膜炎球菌疾病年发病率(每 10 万人),及 1998-2002 年至 2023-2024 年的发病率变化百分比。“推荐所有儿童接种脑膜炎球菌疫苗的国家” 包括澳大利亚、奥地利、比利时、加拿大、法国、德国、希腊、爱尔兰、荷兰、葡萄牙、西班牙、瑞士、英国、美国,这些国家的发病率降幅在 – 2% 至 – 92% 之间,平均降幅为 – 78%;“不推荐所有儿童接种脑膜炎球菌疫苗的国家” 包括丹麦、芬兰、挪威、瑞典,发病率降幅在 – 44% 至 – 87% 之间,平均降幅为 – 75%。
世界卫生组织(WHO)在 2011 年的一份立场文件中建议,脑膜炎球菌疾病发病率超过 2/10 万的国家应维持 “大规模脑膜炎球菌疫苗接种计划”,而发病率较低的国家仅需为高危人群接种 ¹⁵⁶。目前美国的发病率为 0.1/10 万 ¹⁵⁷,远低于世界卫生组织建议的阈值。
目前推荐所有儿童接种的脑膜炎球菌疫苗(Menveo、Menquadfi、Penbraya)在获得食药监局批准前,均未开展大规模双盲安慰剂对照随机试验 ¹⁵⁸⁻¹⁶⁰。
考虑到美国脑膜炎球菌疾病发病率较低,该疫苗不应作为共识疫苗纳入推荐接种计划。高危儿童和青少年(如患有特定类型免疫缺陷的儿童)可能更有可能从接种中获益,因此应通过共同临床决策,为所有儿童和青少年提供该疫苗,且纳入保险覆盖范围。
流感疫苗
儿童接种流感疫苗的主要目的是降低儿童住院率和死亡率,并减少向高危人群(如老年人)的传播,但目前尚无随机对照试验证明这些获益 ¹⁶¹⁻¹⁶³。关于流感疫苗,已开展部分随机安慰剂对照试验。2018 年,科克伦协作网(Cochrane Collaboration)开展了最全面的综述研究 ¹⁶⁴,发现 “对于 3-16 岁儿童,减毒活流感疫苗可能降低流感感染风险(中等确定性证据)”,而 “灭活流感疫苗也可降低流感感染风险(高确定性证据)”。仅有少数试验评估了学校缺勤率和家长误工情况,但未发现具有统计学意义的降低。目前尚无证据表明流感疫苗可减少疾病传播,且由于两组均未出现或极少出现住院和死亡病例,试验无法评估疫苗对住院率和死亡率的影响。关于 2 岁以下儿童接种流感疫苗的相关信息也十分有限。
科克伦协作网针对儿童流感疫苗随机试验的系统综述得出结论:“现有证据不支持决策者重点关注幼儿流感疫苗接种。尽管越来越多的证据表明流感对儿童住院和死亡存在影响,但目前尚无令人信服的证据表明疫苗可降低流感相关死亡率、住院率、严重并发症发生率或社区传播率。”¹⁶⁵
已有部分观察性研究,但结果存在差异。一项检测阴性病例对照研究声称儿童接种流感疫苗可降低住院率 ¹⁶⁶,但该研究设计存在明显偏倚 ¹⁶⁷,且结果可信度极低 ¹⁶⁸。
尽管流感疫苗的可靠安全性数据有限,但并非毫无风险。季节性流感疫苗与吉兰 – 巴雷综合征相关 ¹⁶⁹。在 2009/2010 年甲型 H1N1 流感大流行期间,研究发现接种潘德 rix(Pandemrix)大流行流感疫苗的儿童和青少年会发生嗜睡症 ¹⁷⁰¹⁷¹。科克伦协作网的系统综述指出:“令人惊讶的是,针对幼儿灭活流感疫苗的安全性数据极为缺乏,尽管美国和加拿大目前已推荐 6 个月及以上健康儿童接种灭活流感疫苗”,且 “生产商拒绝公开幼儿疫苗试验中的所有安全性结局数据,加之原始研究中存在明显的报告偏倚和不一致性,难以对减毒活疫苗的安全性做出公正评估。”¹⁷²
基于现有证据及证据缺口,不同国家的公共卫生机构对儿童流感疫苗接种持不同态度是合理的。在 20 个同等发达经济体中,仅奥地利和加拿大推荐所有 6 个月及以上儿童和所有青少年每年接种流感疫苗;另有 6 个国家推荐特定年龄段的所有儿童接种;其余 12 个国家均不推荐任何年龄段的所有儿童常规接种流感疫苗(见表 2)。
综合证据和不确定性,流感疫苗不应推荐所有儿童常规接种,但应通过共同临床决策,为所有 6 个月及以上希望接种的儿童提供该疫苗,且纳入保险覆盖范围。
新冠疫苗
2022 年,丹麦成为首个取消所有儿童新冠疫苗常规接种推荐的同等发达经济体,其公共卫生机构负责人表示,儿童接种该疫苗的获益甚微 ¹⁷³。此后,所有其他同等发达经济体均效仿这一做法(见表 2)。在 2025 年 9 月的会议上,美国免疫实践咨询委员会投票决定,美国儿童和青少年新冠疫苗接种应采用共同临床决策模式 ¹⁷⁴。这意味着,与许多同等发达经济体(仅覆盖推荐疫苗)不同,美国的保险将继续覆盖所有儿童的新冠疫苗接种费用。
| 为确保儿童疫苗接种计划的成功,建议更新后的计划应满足以下要求:
1. 推荐所有儿童接种同等发达经济体共识范围内的疫苗;
2. 提高灵活性和选择空间,减少强制接种,将非共识疫苗重新归类为针对特定高危人群或群体的疫苗,或需通过共同临床决策确定是否接种的疫苗;
3. 确保原有免疫接种计划涵盖的所有疾病相关疫苗,仍可通过私人健康保险、医疗补助计划、儿童健康保险计划和 / 或儿童疫苗计划,为所有有需求的人提供。与同等发达经济体相比,美国将继续为希望接种的人群免费提供最多种类的儿童疫苗;
4. 同时加强疫苗研究,在适当情况下开展双盲安慰剂对照随机试验,并增加观察性研究,以评估单一疫苗和疫苗接种计划的长期影响。 |
|---|
5. 后续步骤
在密切监测疫苗安全性和风险、疫苗接种率及传染病发病率的同时,疾控中心及其免疫实践咨询委员会应继续根据最新疫苗进展和科学研究调整推荐建议。例如,对于不再推荐所有儿童常规接种的疫苗,需进一步细化针对特定人群的接种建议。
卫生与公众服务部应与各州及医生团体合作,向家长和医生宣传疾控中心儿童免疫接种计划的调整内容。
作者简介
特蕾西・贝丝・赫格医学博士、哲学博士:现任美国食品药品监督管理局药品评价与研究中心代理主任,同时担任美国免疫实践咨询委员会食品药品监督管理局当然成员。她在威斯康星医学院获得医学博士学位,在哥本哈根大学获得公共卫生与流行病学哲学博士学位,是一名获得专科认证的物理医学与康复科医生,并在加利福尼亚大学戴维斯分校完成住院医师培训。2025 年 3 月加入美国食品药品监督管理局前,她在加利福尼亚州从事临床医疗工作,同时担任麻省理工学院斯隆管理学院访问学者。
马丁・库尔多夫哲学博士:现任美国卫生与公众服务部规划与评估助理部长办公室首席科学与数据官,积极倡导疫苗的重要性。作为生物统计学家和流行病学家,他已发表 200 多篇同行评审科学论文,过去二十年间一直与疾控中心和食品药品监督管理局合作,开发药物和疫苗不良反应的上市后监测与评估方法。2013 年,他为美国医学研究院撰写了一份关于疫苗接种计划安全性评估方法的报告 ¹⁷⁵。2021 年,在新冠疫情高峰期,因反对疾控中心暂停为美国老年人接种强生新冠疫苗的决定 ¹⁷⁷,他被从疾控中心疫苗委员会解雇 ¹⁷⁶,成为美国最坚定支持疫苗的科学家之一。2021 年初,他是首批公开反对新冠疫苗强制接种政策的公共卫生科学家之一,并认为该政策对公众对疫苗和公共卫生的信任造成了极大损害 ¹⁷⁹。
参考文献(节选)
- 白宫。使美国核心儿童疫苗推荐建议与同等发达经济体最佳实践保持一致. 2025 年 12 月 5 日.
- 世界卫生组织。免疫接种数据:疫苗接种计划. 2025 年.
- Perlis RH, Ognyanova K, Uslu A, 等。新冠疫情期间美国成年人对医生和医院的信任度(基于 50 个州的调查). JAMA Network Open. 2024;7:e2424984.
- DeSilva MB, Haapala J, Vazquez-Benitez G, 等。新冠疫情与美国 8 个医疗体系(基于疫苗安全数据链)常规儿童疫苗接种率及及时接种比例的关联. JAMA Pediatrics. 2022;176:68-77.
- 疾病控制与预防中心。麻疹病例与疫情. 2025 年 12 月 31 日.
- 疾病控制与预防中心。麻疹病例与疫情. 2025 年 12 月 31 日.
- 凯泽家庭基金会(KFF). 美国各州儿童疫苗要求. 2025 年.
- 国际护士会(ICN). 国际护士会护士伦理法典. 2021 年.
- 美国医学会。医学伦理法典:知情同意. 2025 年.
- 美国公共卫生协会。公共卫生伦理法典. 2019 年.
- Lee C, Robinson JL. 疫苗强制接种政策对常规儿童疫苗接种率影响的系统综述. Journal of Infection. 2016 年 6 月;72 (6):659-66.
- Neufeind J, Schmid-Küpke N, Rehfuess E, Betsch C, Wichmann O. 广受认可的麻疹疫苗强制接种政策如何可能导致不公平并降低疫苗接种率:基于德国的预注册调查研究. BMC Public Health. 2022 年 10 月 3 日;22 (1):1846.
- Ahmad M, Akande A, Majid U. 医疗服务提供者对疫苗接种的信任度:系统综述与定性元分析. European Journal of Public Health. 2022 年 4 月 1 日;32 (2):207-13.
- Larson HJ, Clarke RM, Jarrett C, Eckersberger E, Levine Z, Schulz WS, Paterson P. 疫苗信任度测量:系统综述. Human vaccines & Immunotherapeutics. 2018 年 7 月 3 日;14 (7):1599-609.
- 美国医学研究院。儿童免疫接种计划与安全性:利益相关方关切、科学证据与未来研究。华盛顿特区:国家科学院出版社;2013 年.
- Gøtzsche PC. 疫苗:真相、谎言与争议。纽约:天马出版社;2021 年.
- Wisk LE, Sharma N. 1999-2018 年美国儿童期发病慢性疾病的患病率与趋势. Academic Pediatrics. 2025 年 5 月 1 日;25 (4):102810.
- Wodi AP, Shimabukuro T. 第 4 章:疫苗安全性。收录于:Hamborsky J, Kroger A, Wolfe S 主编。疫苗可预防疾病的流行病学与预防。第 14 版。华盛顿特区:公共卫生基金会;2021 年.
- Benn CS, Kulldorff M. 具有伦理设计的儿童疫苗上市后随机试验方案. Research Square [预印本]. 2025 年 7 月 25 日.
- 费城儿童医院。疫苗发展史:按年份记录的进展. 2023 年 8 月 21 日.
- Frenck RW. 疫苗接种计划的演变及其原因. 2025 年 7 月 31 日.
- Allred NJ, Darling N, Jacques-Carroll L, 等. 2003 年 1 月 – 2005 年 6 月美国新生儿乙肝疫苗接种覆盖率. Morbidity and Mortality Weekly Report. 2008 年 8 月 1 日;57:825-828.
- 美国医学研究院(美国)免疫接种财政政策与实践委员会。国家免疫接种体系的变化与复杂性。收录于:制定决策:免疫接种财政政策与实践。华盛顿特区:国家科学院出版社;2000 年.
- Wasserman M, Chapman R, Lapidot R, 等. 7 价和 13 价肺炎球菌结合疫苗在美国儿童中 20 年的公共卫生影响. Emerging Infectious Diseases. 2021;27:1627-1636.
- 疾病控制与预防中心。美国 0-18 岁人群推荐免疫接种计划 ——2010 年. Morbidity and Mortality Weekly Report. 2010 年 1 月 8 日;58:1-4.
- 疾病控制与预防中心. 18 岁及以下儿童和青少年推荐免疫接种计划. 2020 年.
- 疾病控制与预防中心。按年龄划分的 18 岁及以下儿童和青少年免疫接种计划推荐建议. 2025 年.
- 欧洲疾病预防控制中心。欧盟 / 欧洲经济区所有国家的疫苗接种计划. 2025 年.
- Seither R, Yusuf OB, Dramann D, 等。美国 2023-24 学年幼儿园儿童部分疫苗接种覆盖率与豁免率. Morbidity and Mortality Weekly Report. 2024 年 10 月 17 日;73:925-932.
- Seither R, Yusuf OB, Dramann D, 等。美国 2023-24 学年幼儿园儿童部分疫苗接种覆盖率与豁免率. Morbidity and Mortality Weekly Report. 2024 年 10 月 17 日;73:925-932.
- DeSilva MB, Haapala J, Vazquez-Benitez G, 等。新冠疫情与美国 8 个医疗体系(基于疫苗安全数据链)常规儿童疫苗接种率及及时接种比例的关联. JAMA Pediatrics. 2022;176:68-77.
- Anderson RT, Atlas SW, Bell D, 等。公共卫生伦理原则。科学与自由学院;2022 年 8 月 23 日.
- 疾病控制与预防中心。疾控中心新研究:疫苗接种比既往新冠感染提供更强保护. 2021 年 8 月 6 日.
- Bozio CH, Grannis SJ, Naleway AL, 等. 9 个州 2021 年 1-9 月期间,感染诱导或信使核糖核酸疫苗诱导新冠病毒免疫的成年人因新冠样疾病住院情况. Morbidity and Mortality Weekly Report. 2021;70 (44):1539-1544.
- Gazit S, Shlezinger R, Perez G, Lotan R, Peretz A, Ben-Tov A, Cohen D, Muhsen K, Chodick G, Patalon T. 新冠病毒自然免疫与疫苗诱导免疫的比较:再感染与突破性感染. MedRxiv [预印本]. 2021 年 8 月 25 日.
- Kulldorff M. 两项新冠免疫研究的综述与分析。布朗斯通研究所;2021 年 11 月 2 日.
- Brueck H, Haroun A. 疾控中心今日数据显示,接种疫苗者不会携带病毒,也不会患病。商业内幕;2021 年 3 月 30 日.
- 美国众议院新冠疫情特别小组委员会。调查疫情免疫:自然免疫、治疗性免疫或两者兼具. 2023 年 5 月 11 日.
- Kampf G. 新冠疫苗是否能降低新冠病毒传播风险?收录于:Rezaei N 主编。新冠疫情的后续影响。施普林格出版社;2024 年.
- Chatham-Stephens K, Carter R, Duggar C, Woodworth K, Carnes CA, Bhatt A, Ottis C, Voegeli C, Stokley S, Vogt T. 美国儿童新冠疫苗接种项目概述 ——6 个月至 17 岁儿童接种经验. Vaccine. 2024;42:125702.
- Seither R, Yusuf OB, Dramann D, 等。美国 2023-24 学年幼儿园儿童部分疫苗接种覆盖率与豁免率. Morbidity and Mortality Weekly Report. 2024 年 10 月 17 日;73:925-932.
- 疾病控制与预防中心。麻疹病例与疫情. 2025 年 12 月 31 日.
- 疾病控制与预防中心。幼儿园儿童疫苗接种覆盖率与豁免率. 2025 年 7 月 31 日.
- Fine PE. 群体免疫:历史、理论与实践. Epidemiologic Reviews. 1993 年 1 月 1 日;15 (2):265-302.
- 疾病控制与预防中心。图片由阿什・雷诺兹制作。全国广播公司新闻.
- Fine PE. 群体免疫:历史、理论与实践. Epidemiologic Reviews. 1993 年 1 月 1 日;15 (2):265-302.
- 约翰・霍普金斯大学暴发应对创新中心。风险评估方法:美国麻疹情景化人群健康风险评估. 2024 年 9 月 19 日.
- 疾病控制与预防中心。麻疹病例与疫情. 2025 年 12 月 31 日.
- 疾病控制与预防中心。麻疹病例与疫情. 2025 年 12 月 31 日.
- 加拿大政府。加拿大公共卫生署关于加拿大麻疹消除状态的声明. 2025 年 11 月 10 日.
- 疾病控制与预防中心。麻疹病例与疫情(截至 2025 年 12 月 30 日的数据). 2025 年 12 月 31 日.
- Hammerstein S, König C, Dreisörner T, Frey A. 新冠疫情相关学校停课对学生成绩的影响 —— 系统综述. Frontiers in Psychology. 2021 年 9 月 16 日;12:746289.
- 世界卫生组织。免疫接种数据:疫苗覆盖率. 2025 年.
- 世界卫生组织。免疫接种数据:疫苗覆盖率. 2025 年.
- 国际护士会。国际护士会护士伦理法典. 2021 年.
- 美国医学会。医学伦理法典:知情同意. 2025 年.
- 美国公共卫生协会。公共卫生伦理法典. 2019 年.
- Himmelstrup N, Engen CH, Østergaard L, Benfield TL. 脑膜炎球菌疾病的疫苗接种. Ugeskr Laeger. 2019 年 1 月 14 日;181.
- 丹麦卫生署。丹麦儿童疫苗接种计划中纳入乙肝疫苗(第 82-84 页). 2023 年.
- 美国医学会。医学伦理法典. 2025 年.
- 安森蓝十字蓝盾公司。新冠疫苗提供者激励计划. 2021 年 10 月.
- O’Leary ST, Cataldi JR, Lindley MC, Beaty BL, Hurley LP, Crane LA, Kempe A. 美国儿科医生对延迟或拒绝接种疫苗患者的处理政策. JAMA. 2020 年 9 月 15 日;324 (11):1105-7.
- Edwards KM, Hackell JM, 传染病委员会,实践与门诊医学委员会,Byington CL, Maldonado YA, Barnett ED, Davies HD, Edwards KM, Lynfield R, Munoz FM, Nolt D. 应对疫苗犹豫. Pediatrics. 2016 年 9 月 1 日;138 (3):e20162146.
- 美国医学研究院。儿童免疫接种计划与安全性:利益相关方关切、科学证据与未来研究。国家科学院出版社;2013 年.
- 丹麦血清研究所。儿童疫苗接种计划. 2019 年 8 月 20 日.
- 世界卫生组织。免疫接种数据,丹麦:疫苗覆盖率. 2025 年.
- 世界卫生组织。疾病暴发新闻,丹麦:1990-2025 年.
- 美国医学研究院。儿童免疫接种计划与安全性:利益相关方关切、科学证据与未来研究。华盛顿特区:国家科学院出版社;2013 年.
- Lieu TA, Kulldorff M, Davis RL, Lewis EM, Weintraub E, Yih K, Yin R, Brown JS, Platt R, 疫苗安全数据链快速周期分析团队。实时疫苗安全监测:及时发现不良反应. Medical Care. 2007 年 10 月 1 日;45 (10):S89-95.
- Yih WK, Kulldorff M, Fireman BH, Shui IM, Lewis EM, Klein NP, Baggs J, Weintraub ES, Belongia EA, Naleway A, Gee J. 不良反应主动监测:疫苗安全数据链项目经验. Pediatrics. 2011 年 5 月 1 日;127 (Suppl 1):S54-64.
- Hariton E, Locascio JJ. 随机对照试验 —— 有效性研究的黄金标准:研究设计:随机对照试验. BJOG. 2018 年 12 月;125 (13):1716.
- Benn CS, Kulldorff M. 具有伦理设计的儿童疫苗上市后随机试验方案. Research Square [预印本]. 2025 年 7 月 25 日.
- Chen RT, Rastogi SC, Mullen JR, Hayes SW, Cochi SL, Donlon JA, Wassilak SG. 疫苗不良事件报告系统(VAERS). Vaccine. 1994 年 5 月 1 日;12 (6):542-50.
- McNeil MM, Gee J, Weintraub ES, Belongia EA, Lee GM, Glanz JM, Nordin JD, Klein NP, Baxter R, Naleway AL, Jackson LA. 疫苗安全数据链:疫苗安全性监测的成效与挑战. Vaccine. 2014 年 9 月 22 日;32 (42):5390-8.
- 食品药品监督管理局。生物制剂有效性与安全性(BEST)计划. 2025 年.
- 疾病控制与预防中心。美国轮状病毒疫苗接种者中的肠套叠病例 ——1998-99 年. Morbidity and Mortality Weekly Report. 1999;48:577-81.
- Yih KW, Lieu TA, Kulldorff M, Martin D, McMahill-Walraven CN, Platt R, Selvam N, Selvan M, Lee GM, Nguyen M. 美国婴儿接种轮状病毒疫苗后的肠套叠风险. New England Journal of Medicine. 2014;370:503-512.
- Klein NP, Fireman B, Yih WK, 等。麻疹 – 腮腺炎 – 风疹 – 水痘联合疫苗与热性惊厥风险. Pediatrics. 2010;126:e1-e8.
- 疾控中心新冠应对团队与食品药品监督管理局。美国 2020 年 12 月 21 日 – 2021 年 1 月 10 日期间接种首剂 moderna 新冠疫苗后的过敏反应(包括过敏性休克). Morbidity and Mortality Weekly Report. 2021 年 1 月 29 日;70 (4):125.
- Rosenberg D, Kumova OK, Stratton K, Bass AR (主编). 新冠疫苗接种与肌肉注射疫苗不良反应的证据综述。华盛顿特区:国家科学院出版社;2024 年.
- Daley MF, Reifler LM, Glanz JM, Hambidge SJ, Getahun D, Irving SA, Nordin JD, McClure DL, Klein NP, Jackson ML, Kamidani S, Duffy J, DeStefano F. 24 月龄前疫苗铝暴露与 24-59 月龄持续性哮喘的关联. Academic Pediatrics. 2023 年 1 月 1 日;23 (1):37-46.
- 疾病控制与预防中心。儿童免疫接种计划安全性研究白皮书. 2016 年 4 月 7 日.
- Kulldorff M. 不同儿童疫苗接种计划安全性评估的研究设计。国家科学院出版社;2013 年.
- Glanz JM, Newcomer SR, Jackson ML, 等。儿童免疫接种计划安全性研究白皮书。疫苗安全数据链,疾病控制与预防中心;2014 年.
- 美国医学研究院。儿童免疫接种计划与安全性:利益相关方关切、科学证据与未来研究。华盛顿特区:国家科学院出版社;2013 年.
- Daley MF, Reifler LM, Glanz JM, Hambidge SJ, Getahun D, Irving SA, Nordin JD, McClure DL, Klein NP, Jackson ML, Kamidani S, Duffy J, DeStefano F. 24 月龄前疫苗铝暴露与 24-59 月龄持续性哮喘的关联. Academic Pediatrics. 2023;23:37-46.
- Seeger JD, Williams PL, Walker AM. 倾向得分匹配在索赔数据中的应用. Pharmacoepidemiology and Drug Safety. 2005 年 7 月;14 (7):465-76.
- Schneeweiss S, Rassen JA, Glynn RJ, Avorn J, Mogun H, Brookhart MA. 高维倾向得分调整在基于医疗索赔数据的治疗效果研究中的应用. Epidemiology. 2009 年 7 月 1 日;20 (4):512-22.
- Bettega F, Mendelson M, Leyrat C, Bailly S. 多类别治疗逆概率加权在医学研究中的应用与报告:系统综述. Journal of Clinical Epidemiology. 2024 年 6 月 1 日;170:111338.
- Nie X, Xu L, Bai Y, Liu Z, Liu Z, Farrington P, Zhan S. 自身对照病例系列设计在疫苗安全性研究中的应用:系统综述. Expert Review of Vaccines. 2022 年 3 月 4 日;21 (3):313-24.
- 疾病控制与预防中心。免疫接种计划.
- 澳大利亚政府。国家免疫接种计划时间表. 2025 年 9 月.
- 奥地利劳动、社会事务、卫生、护理和消费者保护部。奥地利疫苗接种计划. 2025 年 10 月 10 日.
- Vaccination-Info.be. 疫苗接种时间表. 2025 年 8 月 26 日.
- 加拿大政府。推荐免疫接种计划:加拿大免疫指南. 2025 年 4 月.
- 丹麦血清研究所。儿童疫苗接种计划. 2025 年.
- 芬兰健康与福利研究所。婴幼儿疫苗接种指南. 2025 年.
- 法国公共卫生局。简化疫苗接种时间表. 2025 年.
- 德国罗伯特・科赫研究所。免疫接种计划. 2025 年.
- 希腊卫生部. 2025 年国家儿童和青少年疫苗接种计划 —— 时间表与建议. 2025 年.
- 爱尔兰卫生服务执行局。当前免疫接种计划. 2024 年 12 月 27 日.
- 意大利高级卫生研究所。意大利免疫接种计划. 2025 年.
- 日本儿科协会。日本儿科协会推荐的疫苗接种计划. 2025 年 5 月 19 日.
- 荷兰国家公共卫生与环境研究所. 2025 年疫苗接种计划. 2025 年.
- 新西兰免疫咨询中心。新西兰国家免疫接种计划. 2024 年 7 月.
- 挪威公共卫生研究所。儿童疫苗接种计划. 2025 年 7 月 1 日.
- 葡萄牙国家卫生服务局。国家疫苗接种计划. 2025 年 4 月 15 日.
- 西班牙卫生部长,地区间系统。全生命周期疫苗接种与免疫联合时间表. 2026 年推荐时间表.
- 瑞典公共卫生局。儿童疫苗接种计划. 2025 年.
- 瑞士联邦,联邦公共卫生局。瑞士疫苗接种时间表 —— 通常推荐的疫苗接种与被动免疫. 2024 年 9 月.
- 英国卫生安全局。常规儿童免疫接种. 2026 年 1 月.
- 欧洲疾病预防控制中心。欧盟 / 欧洲经济区所有国家的疫苗接种计划. 2025 年.
- 丹麦血清研究所。儿童疫苗接种计划. 2025 年.
- 疾病控制与预防中心。免疫接种计划.
- Freedman B. 临床研究中的均衡性与伦理. New England Journal of Medicine. 1987 年 7 月 16 日;317 (3):141-5.
- Jenco M. 美国儿科学会将继续发布独立疫苗推荐建议,此前疾控中心顾问引发信任危机。美国儿科学会新闻. 2025 年 6 月 26 日.
- 疾病控制与预防中心。美国免疫实践咨询委员会共同临床决策推荐建议. 2025 年 1 月 7 日.
- 丹麦血清研究所。非政府资助疫苗. 2025 年 12 月 18 日.
- 疾病控制与预防中心。卡介苗(BCG)结核病疫苗. 2025 年 1 月 31 日.
- Seither R, Yusuf OB, Dramann D, 等。美国 2023-24 学年幼儿园儿童部分疫苗接种覆盖率与豁免率. Morbidity and Mortality Weekly Report. 2024 年 10 月 17 日;73:925-932.
- Montroy J, Salvadori MI, Forbes N, Dubey V, Almasri S, Jirovec A, Yan C, Gusic K, Stevens A, Young K, Tunis M. 简化人乳头瘤病毒疫苗接种方案的有效性、效果与免疫原性:现有证据综述. Canada Communicable Disease Report. 2024 年 6 月 28 日;50 (6):166.
- Kreimer AR, Porras C, Liu D, 等。人乳头瘤病毒疫苗 1 剂与 2 剂接种的非劣效性. New England Journal of Medicine. 2025;393:2421-2433.
- Watson-Jones D, Changalucha J, Maxwell C, Whitworth H, Mutani P, Kemp TJ, Kamala B, Indangasi J, Constantine G, Hashim R, Mwanzalima D. 坦桑尼亚 9-14 岁女孩接种 1 剂与人乳头瘤病毒疫苗后 5 年免疫原性持久性比较:DoRIS 随机试验长期随访结果. The Lancet Global Health. 2025;13:e319-28.
- Basu P, Malvi SG, Joshi S, Bhatla N, Muwonge R, Lucas E, Verma Y, Esmy PO, Poli UR, Shah A, Zomawia E. 印度女孩接种 1 剂、2 剂和 3 剂四价人乳头瘤病毒疫苗后 10 年预防持续性人乳头瘤病毒 16/18 感染的疫苗效力:多中心前瞻性队列研究. The Lancet Oncology. 2021;22:1518-29.
- 加拿大政府。人乳头瘤病毒疫苗更新建议. 2024 年 7 月 24 日.
- 爱尔兰卫生服务执行局。学校人乳头瘤病毒疫苗接种计划. 2024 年.
- 英国国家医疗服务体系(NHS). 人乳头瘤病毒疫苗. 2023 年 9 月 1 日.
- 布里松 M, 盖伊 NJ, 埃德蒙兹 WJ, 安德鲁斯 NJ. 水痘病毒暴露可增强对带状疱疹的免疫力:水痘大规模疫苗接种的意义 [J]. 疫苗,2002, 20 (19-20): 2500-2507.
- 129 梁 J, 杜林 K, 马林 M, 安德森 TC, 哈帕兹 R. 美国全民水痘疫苗接种对带状疱疹发病率的影响:疫苗接种项目实施前后出生队列的对比研究 [J]. 传染病杂志,2022, 226 (增刊 4): S470-S477.
- 130 塞特 R, 优素福 OB, 德拉曼 D, 等。美国 2023-2024 学年幼儿园儿童多种疫苗接种率与接种豁免率调查 [J]. 发病率与死亡率周报,2024, 73: 925-932.
- 131 范霍克 AJ, 梅莱加罗 A, 扎盖尼 E, 埃德蒙兹 WJ, 盖伊 N. 水痘 – 带状疱疹联合疫苗接种项目对英格兰水痘 – 带状疱疹病毒流行病学影响的模型研究 [J]. 疫苗,2011, 29: 2411-2420.
- 132 武茨勒 P, 博南尼 P, 伯吉斯 M, 格尔森 A, 萨法迪 MA, 卡萨博纳 G. 水痘疫苗接种的全球应用经验 [J]. 疫苗专家评论,2017, 16: 833-843.
- 133 达夫 B, 达夫 P. 甲型肝炎疫苗:已具备大规模应用条件 [J]. 妇产科学,1998, 91 (3): 468-471.
- 134 菲奥雷 AE, 沃斯利 A, 贝尔 BP. 主动或被动免疫预防甲型肝炎:免疫实践咨询委员会(ACIP)建议 [J]. 发病率与死亡率周报,2006, 55 (建议报告 7): 1-23.
- 135 霍夫迈斯特 MG, 尹 S, 纳尔逊 NP, 翁 MK, 古普塔 N. 1976-2020 年美国甲型肝炎病毒感染、血清阳性率及疫苗接种率的趋势与机遇 [J]. 公共卫生报告,2023-07-21.
- 136 美国疾病控制与预防中心. 2023 年病毒性肝炎监测报告:甲型肝炎监测 [R]. 2025-04-15.
- 137 英尼斯 BL, 斯里特班 R, 库纳索尔 P, 劳拉克蓬塞 T, 普帕塔纳库尔 W, 科齐克 CA, 孙塔亚孔 S, 素坤塔蓬 T, 萨法里 A, 邓 DB, 博斯莱戈 JW. 灭活疫苗预防甲型肝炎的效果研究 [J]. 美国医学会杂志,1994, 271: 1328-1334.
- 138 韦茨伯格 A, 门希 B, 库特 B, 布朗 L, 刘易斯 J, 西特林 R, 米勒 W, 舒瓦尔 D, 维恩斯 B, 卡兰德拉 G, 等。福尔马林灭活甲型肝炎疫苗在健康儿童中的对照试验 [J]. 新英格兰医学杂志,1992, 327: 453-457.
- 139 菲奥雷 AE, 沃斯利 A, 贝尔 BP. 主动或被动免疫预防甲型肝炎:免疫实践咨询委员会(ACIP)建议 [J]. 发病率与死亡率周报,2006, 55 (建议报告 7): 1-23.
- 140 美国疾病控制与预防中心。免疫实践咨询委员会会议资料 [R]. 2025-12.
- 141 帕拉沙尔 UD, 胡梅尔曼 EG, 布里西 JS, 米勒 MA, 格拉斯 RI. 轮状病毒病导致的全球儿童患病与死亡情况 [J]. 新发传染病,2003, 9 (5): 565.
- 142 同前引
- 143 美国疾病控制与预防中心. CDC Wonder 数据库:1999-2020 年多重死因统计 [DB/OL].
- 144 美国疾病控制与预防中心. CDC Wonder 数据库:1999-2020 年多重死因统计 [DB/OL].
- 145 墨菲 TV, 加久洛 PM, 马苏迪 MS, 纳尔逊 DB, 朱曼 AO, 奥科罗 CA, 扎纳尔迪 LR, 塞蒂亚 S, 费尔 E, 勒巴伦 CW, 施瓦茨 B. 口服轮状病毒疫苗接种婴儿的肠套叠发病情况 [J]. 新英格兰医学杂志,2001, 344 (8): 564-572.
- 146 易 WK, 廖 TA, 库尔多夫 M, 马丁 D, 麦克马希尔 – 沃尔雷文 CN, 普拉特 R, 塞尔瓦姆 N, 塞尔万 M, 李 GM, 阮 M. 美国婴儿接种轮状病毒疫苗后的肠套叠风险研究 [J]. 新英格兰医学杂志,2014, 370 (6): 503-512.
- 147 丹麦国家卫生局。轮状病毒疫苗接种的医药技术评估报告 [R]. 2012.
- 148 美国人口普查局。国际数据库(IDB)[DB/OL]. 2025.
- 149 美国疾病控制与预防中心。美国法定传染病监测概要 [R]. 1998, 1999, 2000, 2001, 2002.
- 150 美国疾病控制与预防中心。脑膜炎球菌病监测与趋势报告 [R]. 2025.
- 151 欧盟委员会健康与消费者保护总局。脑膜炎球菌病报告 [R]. 2009-03.
- 152 澳大利亚卫生、残疾与老年事务部。澳大利亚脑膜炎球菌病监测项目年度报告 [R]. 1998, 1999, 2000.
- 153 伯吉斯 M. 脑膜炎球菌疫苗 [J]. 澳大利亚处方集,2003, 26: 56-58.
- 154 丹麦血清研究所。脑膜炎球菌病年度报告 [R]. 2023-2024.
- 155 世界卫生组织。世卫组织 / 联合国儿童基金会免疫接种联合报告表(JRF)[R]. 2025.
- 156 世界卫生组织。脑膜炎球菌疫苗:世卫组织立场文件概要 [R]. 2011-11-18.
- 157 美国疾病控制与预防中心。脑膜炎球菌病监测与趋势报告 [R]. 2025-05-09.
- 158 曼福(MENVEO)疫苗说明书 [Z]. 美国北卡罗来纳州达勒姆市:葛兰素史克公司;发布日期不详.
- 159 四联流脑(MENQUADFI)疫苗说明书 [Z]. 美国宾夕法尼亚州斯威夫特沃特市:赛诺菲巴斯德公司;2025.
- 160 喷鼻式流脑(PENBRAYA)疫苗说明书 [Z]. 美国纽约州纽约市:辉瑞公司;2024.
- 161 杰斐逊 T, 里韦蒂 A, 迪彼得兰托尼 C, 德米凯利 V. 健康儿童流感疫苗预防效果的系统综述 [J]. 考克兰系统综述数据库,2018, (2): CD004879.
- 162 德米凯利 V, 杰斐逊 T, 迪彼得兰托尼 C, 费罗尼 E, 索宁 S, 托马斯 RE, 里韦蒂 A. 老年人流感疫苗预防效果的系统综述 [J]. 考克兰系统综述数据库,2018, (2): CD004876.
- 163 杰斐逊 TO, 里韦蒂 D, 迪彼得兰托尼 C, 里韦蒂 A, 德米凯利 V. 健康成人流感疫苗预防效果的系统综述 [J]. 考克兰系统综述数据库,2018, (2): CD001269.
- 164 杰斐逊 T, 里韦蒂 A, 迪彼得兰托尼 C, 德米凯利 V. 健康儿童流感疫苗预防效果的系统综述 [J]. 考克兰系统综述数据库,2018, (2): CD004879.
- 165 同前引,第 25-26 页
- 166 费迪南兹 JM, 奥尔肖 LE, 阿甘 AA, 巴特 N, 沙利文 RM, 霍尔 M, 穆拉尼 PM, 汤普森 M, 伦道夫 AG. 2010-2012 年美国儿童流感疫苗预防 RT-PCR 确诊重症流感的有效性研究 [J]. 传染病杂志,2014, 210 (5): 674-683.
- 167 库尔多夫 M. 两项新冠免疫研究的回顾与深度分析 [R]. 布朗斯通研究所,2021-11-02.
- 168 格茨切 PC. 疫苗:真相、谎言与争议 [M]. 纽约:天马出版社,2021.
- 169 莱维森 LS, 汤姆森 RW, 安德森 H. 流感疫苗接种后吉兰 – 巴雷综合征发病情况:一项为期 15 年的全国性人群病例对照研究 [J]. 欧洲神经病学杂志,2022, 29 (11): 3389-3394.
- 170 萨尔卡宁 TO, 阿拉库伊亚拉 AP, 多维利耶 YA, 帕尔蒂宁 MM. 甲型 H1N1 流感感染及疫苗接种后发作性睡病的发病率:系统综述与荟萃分析 [J]. 睡眠医学综述,2018, 38: 177-186.
- 171 多希 P. 潘德米克斯疫苗:为何早期预警信号未告知公众?[J]. 英国医学杂志,2018, 362.
- 172 杰斐逊 T, 里韦蒂 A, 迪彼得兰托尼 C, 德米凯利 V. 健康儿童流感疫苗预防效果的系统综述 [J]. 考克兰系统综述数据库,2018, (2): CD004879. 第 26 页.
- 173 哈伯・林加德 E. 布罗斯特伦承认:回顾过往,儿童接种疫苗收效甚微 [EB/OL]. 丹麦电视二台,2022-06-22.
- 174 美国疾病控制与预防中心。免疫实践咨询委员会会议资料 [R]. 2025-12.
- 175 库尔多夫 M. 不同儿童疫苗接种程序安全性评价的研究设计 [M]. 美国国家科学院出版社,2013.
- 176 普尔曼 J. 美国疾控中心惩罚 “明星” 科学家 —— 其提出的新冠疫苗建议 4 天后被疾控中心采纳 [EB/OL]. 《联邦党人》网站,2021-04-28.
- 177 普尔曼 J. 恐惧氛围?疾控中心报复试图避免疫苗 “暂停” 风波的 “明星” 科学家,同僚集体噤声 [EB/OL]. 《联邦党人》网站,2021-05-07.
- 178 库尔多夫 M. 暂停强生疫苗接种的隐患 [EB/OL]. 《国会山报》, 2021-04-17.
- 179 库尔多夫 M, 巴塔查里亚 J. 疫苗护照将延长封锁时间 [EB/OL]. 《华尔街日报》, 2021-04-06.
Assessment of the U.S. Childhood and Adolescent Immunization Schedule Compared to Other Countries
Hits: 2
