Contents
Vaccination in pregnancy to protect the newborn
维多利亚·梅尔 1 和 克里斯廷·E·琼斯 2,3
摘要
传染病对新生儿构成特殊风险,全球都有保护这一脆弱群体的需求。由于开发对新生儿有效的疫苗存在挑战,因此在出生后的前28天只接种乙型肝炎和结核病疫苗,即便如此,这些疫苗也主要只提供给高风险群体。母体的抗体通过胎盘传递,能够为新生儿提供一定程度的保护,因此一种替代策略是在孕期接种疫苗。这种方法已被成功用于保护新生儿免受破伤风和百日咳的侵害,而主要用于在孕期保护母亲的疫苗,如流感和COVID-19疫苗,也能为新生儿提供一定程度的保护。最近已批准一种呼吸道合胞病毒疫苗用于孕期,以保护新生儿,而且一种新的疫苗即将在孕期提供,用于预防婴儿B族链球菌感染。本文讨论了目前孕期及新生儿接种的疫苗、未来针对这些群体开发的疫苗以及关于疫苗分发和接种仍存在的挑战。
引言
新生儿由于免疫系统尚未发育成熟,特别容易受到传染病的侵害。特别是,他们缺乏因先前有限接触病原体而产生的保护性免疫记忆。2015年,全球约有61万名新生儿死于传染病,死亡率为每10万次活产4.4例。绝大多数死亡发生在低收入和中等收入国家。在较高收入国家,传染病更可能导致住院而非死亡,但这仍对家庭和医疗系统造成重大负担,并可能对婴儿产生长期后果。因此,全球需要保护新生儿免受传染病的侵害。
在这篇综述中,我们将讨论孕期和出生时接种疫苗如何通过预防感染或在无法预防感染时减轻病情来保护新生儿免受传染病的侵害。我们在这里的重点是开发用于保护新生儿的疫苗(28天以下的婴儿)。关于较大婴儿的疫苗接种计划的讨论已在其他地方进行了近期回顾。然而,同样重要的是要注意,许多针对新生儿的方法将在出生后的前3至6个月继续提供一定程度的保护。
孕期接种疫苗的免疫学
新生儿对感染的脆弱性部分源于其新生儿免疫系统的功能“不成熟”。越来越多的人达成了共识,认为“不成熟”这一术语可能不够准确,这最好被视为一种机制,保护新生儿免受出生后首次遇到的无害环境抗原和共生生物的过度免疫反应。尽管如此,这给新生儿的疫苗接种带来了挑战,他们相比年龄较大的儿童和成人,对多种疫苗产生的免疫反应较弱。母体抗体通过胎盘传递并分泌到母乳中,为新生儿提供一定程度的保护,使其免受母亲所遇到的抗原挑战。因此,一种策略是在怀孕期间接种疫苗,依赖母体抗体来保护新生儿。由于理论上存在减毒病原体能够感染胎盘和胎儿的风险,活疫苗在怀孕期间是禁忌的,所以当唯一可用的疫苗含有活减毒病原体(如卡介苗(BCG)用于结核病)时,更倾向于给新生儿接种疫苗。当母体来源的抗体不能为新生儿提供保护时(例如,乙型肝炎病毒(HBV)疫苗的情况),也倾向于给新生儿接种疫苗。
孕期接种疫苗的反应
尽管怀孕不是一个免疫抑制的状态,但它以全身免疫反应的微妙变化为特征。因此,疫苗接种项目的目标是通过胎盘转移抗体来保护新生儿时,确认所使用的疫苗能引发恰当的抗体反应是很重要的。
百白破疫苗(Tetanus, Diphtheria, Acellular Pertussis,简称Tdap)通常在怀孕期间接种,以保护婴儿免受破伤风和百日咳的侵害,但关于这种疫苗对孕妇特定反应的证据并不一致。一些研究发现,接种Tdap后,孕妇和非孕妇之间的抗体滴度没有差异。然而,其他研究报告称,尽管在怀孕期间接种Tdap能够激发保护性抗体滴度,但这种反应仍然低于非孕期所见的水平。对于流感疫苗和新型冠状病毒肺炎(COVID-19)疫苗而言,孕期接种疫苗所诱导产生的抗体滴度与非孕期接种所产生的抗体滴度相似。然而,系统血清学研究方法揭示了孕期与非孕期人群接种 COVID-19 疫苗后的一些细微差异:与非孕期接种者相比,孕期接种者在接种第一剂 COVID-19 信使核糖核酸(mRNA)疫苗后,诱导产生的具有 Fc 受体(FcR)结合能力的抗体及其效应功能的动力学略延迟。一项针对孕期接种三种不同 COVID-19 疫苗的研究还发现,与孕早期或孕晚期接种相比,孕中期接种 COVID-19 疫苗后,抗体介导的效应功能略有降低。
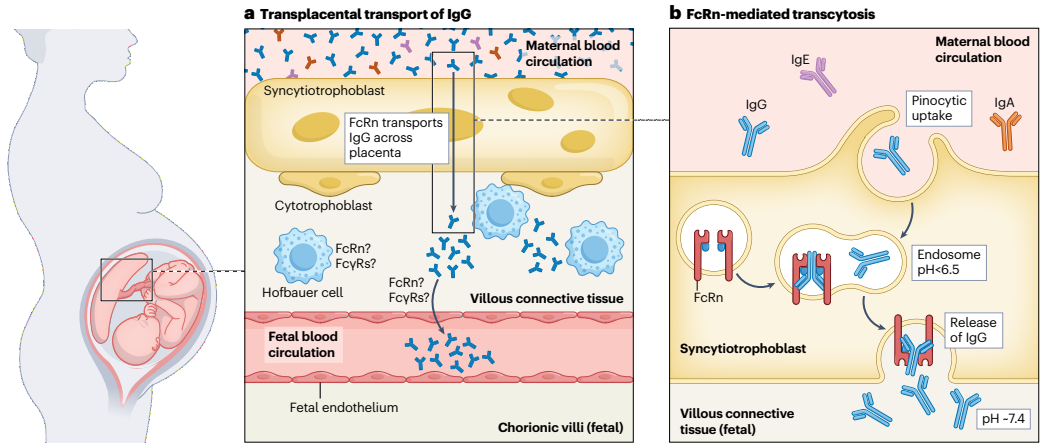
图 1 | IgG 的胎盘转运。
a,母体循环与胎儿循环由绒毛滋养层细胞、胎儿结缔组织及胎儿内皮细胞分隔。IgG 通过新生儿 Fc 受体(FcRn)介导的转胞吞作用穿过绒毛合体滋养层(细节见图 b)。目前尚不清楚 IgG 如何通过结缔组织和胎儿内皮细胞,但胎盘巨噬细胞(霍夫鲍尔细胞)和胎儿内皮细胞表达的 FcRn 及其他 Fcγ 受体(FcγRs)可能发挥作用。b,合体滋养层细胞通过胞饮作用摄取母体 IgG。含 IgG 的囊泡与含 FcRn 的内体融合,FcRn 可在低 pH 环境下保护 IgG 免受蛋白水解降解。当内体与合体滋养层的胎儿侧融合时,pH 值升高促使 FcRn 将其结合的 IgG 释放到绒毛结缔组织中。
因此,在某些情况下,妊娠期间的疫苗接种可能会引发质量上不同的抗体反应。然而,诱导出的抗体反应足以提供保护,由于抗体滴度随时间降低,因此在妊娠期间接种疫苗以最大化新生儿的保护仍然是首选,而不是依赖在受孕前接种疫苗。
胎盘转移抗体
将疫苗接种作为妊娠期保护新生儿的策略,其基础在于母体抗体通过胎盘的有效转移。在五种抗体类别中,只有IgG能够通过胎盘,这一过程由新生儿Fc受体(FcRn)23-25特异性介导(见图1)。为了从母血进入胎儿血液循环,抗体必须首先穿过覆盖胎盘绒毛的滋养层细胞,然后是绒毛结缔组织,最后通过内皮细胞进入胎儿毛细血管。FcRn被绒毛滋养层细胞26-28明确表达,而且已经使用表达FcRn的滋养层衍生细胞或工程细胞系确定了FcRn介导IgG通过绒毛滋养层转运的机制29,30。绒毛滋养层通过胞饮作用从母血中摄取IgG。在内体中,FcRn在低pH值下结合IgG,保护其在向细胞胎儿侧转运过程中不被蛋白酶降解。随着内体与滋养层胎儿侧融合,pH值的升高导致FcRn释放其IgG货物进入绒毛结缔组织。至于IgG如何通过结缔组织并进入胎儿血管,目前尚不清楚。胎盘巨噬细胞(Hofbauer细胞)表达FcRn和其他Fcy受体,这可能使它们能够支持这一过程31,32。同时,关于绒毛内皮细胞是否表达FcRn尚无共识,其他IgG受体可能介导IgG进入胎儿毛细血管26,28,33。IgG1的转移效率最高,其次是IgG4,然后是IgG2和IgG3。因此,疫苗提高这些亚类的程度可能会影响它们保护新生儿的有效性。
在第一孕期,胎盘对IgG的转移很少,随着第二孕期的到来逐渐建立:在怀孕的第12至22周,脐带血中IgG的滴度是母亲滴度的-10%,到第二孕期结束时,约为母血中滴度的50%。到了第三孕期,转移率显著增加,到足月时,胎儿的IgG浓度通常超过母亲4。因此,在怀孕26至34周之间接种疫苗可以最大化足月婴儿脐带血中的抗原特异性IgG,尽管在13至34周之间的任何时间接种疫苗,对任何程度的血清阳性的婴儿比例都是相似的。在一项随机试验中,在23至32周之间的任何时间接种疫苗,导致婴儿体内针对评估的三种百日咳抗原中的两种具有等同浓度的IgG抗体。在32至34周后接种疫苗会导致新生儿体内抗原特异性IgG水平较低,因为没有足够的时间。
框1 | 影响孕期接种疫苗时间的因素
主要目标是在出生后保护婴儿:
●疫苗在23至34周给予时效果最佳38-40。在2016年之前,英国的百日咳疫苗供应大多覆盖了这个时间段(28-38周)。
● 然而,将疫苗接种限制在怀孕后期可能会阻止早产婴儿受益。这就是为什么在2016年,英国开始建议在孕16至32周之间接种百日咳疫苗。那些将呼吸道合胞病毒疫苗的供应限制在孕32周后或分娩后的国家可能会限制对早产婴儿的保护。
● 将疫苗接种限制在怀孕早期可能意味着一些孕妇会错过接种疫苗的机会。因此,在英国,如果在推荐的接种窗口期间未接种百日咳疫苗的个人仍可在以后接种。
当主要目标是在怀孕期间保护母亲和胎儿时:
● 针对季节性病毒的疫苗可以作为季节性项目进行接种。在英国,会在预测病毒传播高峰之前提供“秋季加强”流感疫苗。
● 对于快速变异的病毒,一旦有针对新变种的疫苗可用,可能会建议接种加强剂。目前美国对COVID-19疫苗接种采用这种方法。
一般考虑因素:
● 当疫苗短缺时,可能需要在疫苗上市后提供。
● 随着越来越多的用于怀孕期间的疫苗开发出来,越来越需要考虑它们共同使用时安全性和有效性。
英国的怀孕期间疫苗接种时间表、美国的疫苗接种时间表以及印度的疫苗接种时间表见图3,英国的详细情况见表1。
母亲在分娩前产生抗体并通过胎盘传递给婴儿。研究检查孕期接种疫苗对婴儿疾病预防的有效性,大多数发现孕晚期接种疫苗更具保护作用4144,但如果主要目标是预防孕期严重疾病,可能会选择在孕早期接种疫苗,但这会牺牲后续婴儿的保护。影响孕期接种疫苗时间的因素在方框1中进行了总结。
转移至婴儿体内的IgG半衰期估计在28.7天(参考文献45)到48.4天46之间,这取决于抗原特异性。对于针对破伤风类毒素的IgG1,其滴度在出生后4个月降至出生时滴度的10%,在6个月时为3%46。因此,由母亲提供的疾病保护在婴儿出生后的前6个月内逐渐下降9,43,44,47。这也影响婴儿的疫苗接种计划,因为转移的IgG调节婴儿对疫苗的反应。在对7630名婴儿进行的荟萃分析中,母亲抗体水平高出两倍的婴儿,接种灭活脊髓灰质炎疫苗后,婴儿的抗体浓度较低,介于20%至28%之间,百日咳毒素为11%,破伤风毒素为13%48。这种效应在年长婴儿中不太明显,一旦母体抗体减弱。因此,在婴儿疫苗接种计划中,目标是在母体来源的抗体降至干扰免疫反应的阈值以下后尽快接种疫苗。
母乳中的抗体
另一种母体免疫力可以保护新生儿的方式是通过将抗体转移到母乳中,使其能够中和婴儿肠道中的病原体。这主要由IgA组成,尽管在母乳中也可以检测到低浓度的IgG和IgM49。乳腺中的浆细胞产生IgA和IgM,然后通过肠道进行转运{50-52}。这使得母乳能够为婴儿的肠道提供最为相关的抗体,但这确实表明优化穿过胎盘运输的疫苗53可能在通过母乳向婴儿传递保护作用方面能力有限。
乳腺中分泌IgA的细胞主要来源于肠道,相应地,乳腺浆细胞的库与肠道相同。这使得母乳能够为婴儿的肠道提供最为相关的抗体,但这确实表明优化引发母亲循环中IgG反应的疫苗可能在通过母乳向婴儿传递保护作用方面能力有限。尽管如此,仍有一些证据表明母乳喂养可以提供有限的保护。在对孕妇接种流感疫苗的一项随机对照试验中,出生后纯母乳喂养与流感疫苗接种组相比,呼吸道疾病显著减少54。
通过接种疫苗中断病原体传播
除了通过转移母源性抗体给新生儿而提供的直接抗菌保护之外,母体免疫还可以通过中断病原体传播间接保护新生儿免受感染。该策略有时会扩展至包括对新生儿的其他密切接触者接种疫苗(称为“包裹式”接种),已被证明能有效保护婴儿免受流感侵袭{5,56}。包裹式疫苗策略也试图保护婴儿免受百日咳感染,但在百日咳发病率低的地区,需要接种疫苗的人数过多,以至于成本效益不高57。因此,包裹式疫苗接种策略在保护婴儿方面的有效性将取决于一个地区的总体疾病发病率。
图2总结了怀孕期间接种疫苗保护新生儿的机制。
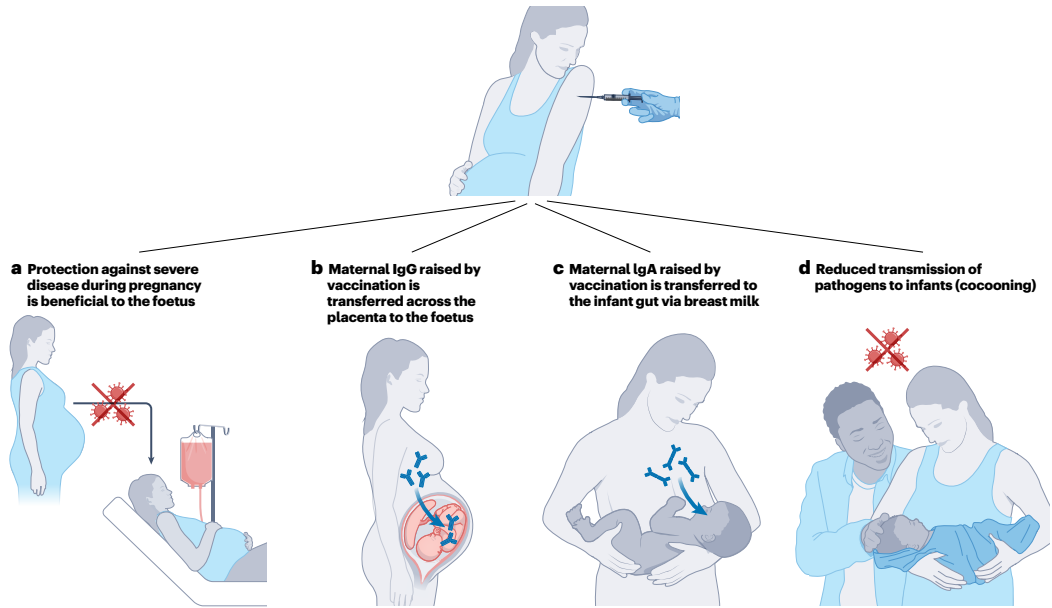
图 2 | 孕期接种疫苗保护新生儿的机制。
孕期接种疫苗通过四种方式保护新生儿免受感染性疾病侵害。a,预防孕期重症可减少可能对胎儿造成危害的并发症。流感和新冠疫苗的接种即出于此目的。b,疫苗诱导母体产生的 IgG 可通过胎盘,在新生儿出生后为其提供保护。百日咳和呼吸道合胞病毒疫苗的接种即出于此目的。c,疫苗诱导母体产生的 IgA 会转移到母乳中,进而进入婴儿肠道。有证据表明,孕期接种流感疫苗可通过此途径为新生儿提供额外保护。d,接种过疫苗的父母及其他照护者感染风险降低,从而减少将病毒传染给婴儿的可能性(即 “茧式保护”)。
已建立的疫苗接种计划
妊娠期间接种疫苗以保护新生儿源远流长。早在1877年,便有报道称,母亲在妊娠期间接种过牛痘疫苗的婴儿,自己也能免受天花的侵害。自二十世纪中叶起,妊娠期间的疫苗接种逐渐成为保护新生儿的重要工具。下面,我们讨论目前广泛提供的妊娠期疫苗(参见图3和表1,了解英国、美国和印度当前的妊娠期疫苗接种计划)。
妊娠期间破伤风疫苗接种
破伤风由细菌Clostridium tetani的孢子引起,这种细菌通过开放性伤口进入人体,而新生儿在资源匮乏的环境中尤其容易感染破伤风,因为可能会使用未经消毒的工具来剪脐带。新生儿破伤风通常出现在出生后的第三至二十八天之间,感染的婴儿会失去吸吮能力并出现肌肉痉挛。如果没有医疗治疗,新生儿破伤风是普遍致命的,即便有医院护理,感染新生儿中仍有10%至60%死亡。
首个获批的破伤风疫苗是将破伤风类毒素吸附到铝盐上制成,在第二次世界大战期间被广泛使用。1959年,一项关于母亲破伤风疫苗接种的观察性研究显示,几乎有95%的保护效果能预防新生儿破伤风。首个随机对照试验报告称,在怀孕期间接种了两剂或三剂破伤风疫苗的母亲所生的婴儿中,没有新生儿死于破伤风,相比之下,对照组的破伤风死亡率为7.8%。后续试验发现,怀孕期间接种2-3剂破伤风疫苗能够以98%的有效率降低新生儿破伤风死亡人数(95%置信区间:70-100%),且不会增加母亲或婴儿严重不良事件的风险。
1988年,估计有78.7万名新生儿死于破伤风。因此,1989年世界卫生大会决定,将每个地区的新生儿破伤风发病率降至每千活产儿不到一例。2018年,约有2.5万名新生儿死于新生儿破伤风,比1988年的死亡率降低了97%,这在很大程度上归功于免疫接种的扩大。
孕期百日咳疫苗接种
百日咳(百日咳)是由百日咳杆菌引起的高度传染性疾病,其特征是伴有吸气性喘息的阵发性咳嗽。在1940年至1948年间,美国的百日咳致死人数几乎是麻疹、腮腺炎、风疹、猩红热、白喉、脊髓灰质炎和脑膜炎合计的三倍。百日咳每年仍导致全球8.59万名婴儿死亡,使其成为疫苗可预防死亡的主要原因之一。
全细胞百日咳疫苗于1914年开发出来,1943年的一项观察性研究显示,在孕期接种这些疫苗后,抗体可以通过胎盘转移,并能对新生产生一定的保护作用。在怀孕期间接种百日咳疫苗的活动并未立即展开,部分原因是对全细胞疫苗的致敏性表示担忧,还因为婴儿疫苗接种活动的成功使得临床需求很少。20世纪70年代和80年代开发的无细胞百日咳疫苗,加上21世纪初该病的大幅回升,促使美国和英国分别在2010年(参考文献67)和2012年(参考文献5)开始建议孕妇接种百日咳疫苗。自从引入孕期接种百日咳疫苗后,英国婴儿病例减少了78%。在孕期引入百日咳疫苗后,英国 3 个月以下婴儿的百日咳病例减少了 78%⁵。据估计,该疫苗对 3 个月以下婴儿因百日咳住院的保护效力在 66% 至 94% 之间,且围产期不良结局并未增加⁴。
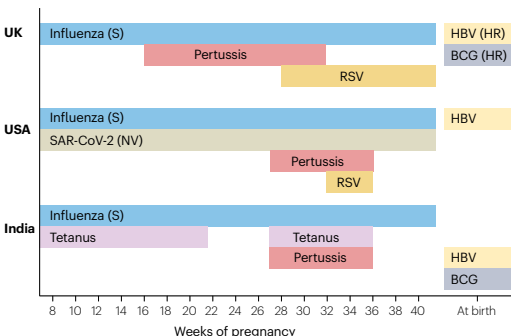
图 3 | 英国、美国和印度的孕期推荐接种疫苗时间表。
季节性提供的疫苗标注为(S),针对新变异株的疫苗配方上市时提供的疫苗标注为(NV),仅为高风险婴儿提供的疫苗标注为(HR)。在英国,2025 年春季前新冠疫苗是作为季节性活动提供的,但目前成本效益分析不支持继续提供该疫苗 ¹³⁵。在美国,流感疫苗通常在秋季提供,但对于孕晚期在夏季的孕妇,可考虑在夏季接种以保护新生儿⁸³。在印度,第二剂破伤风疫苗可与百日咳加强针联合接种,即接种破伤风 – 白喉 – 百日咳联合疫苗。BCG:卡介苗;HBV:乙型肝炎病毒;RSV:呼吸道合胞病毒。
自该计划引入以来,关于怀孕期间使用疫苗的时间和类型建议已经发生了变化。在英国,最初建议在怀孕28至38周接种百日咳疫苗,但从2016年起,建议延伸至16至32周。这主要是为了扩大接种疫苗的时间窗口,早期接种意味着早产儿更有可能得到保护。2016年的一项研究报告指出,在怀孕早期进行免疫接种可以最大化婴儿对百日咳抗原的血清阳性率,这也是一个考虑因素,随后发表的一项随机试验显示,在23至32周之间的任何时间接种疫苗都会产生相当的婴儿抗体滴度,这也支持了在怀孕早期接种疫苗的政策。
针对使用含有灭活脊髓灰质炎病毒(IPV)组分的多价白喉、破伤风和百日咳疫苗(DTaP/IPV)在怀孕期间可以减少婴儿接种脊髓灰质炎疫苗后的血清转化率的研究结果,从2024年7月起,英国孕妇被提供不含有IPV组分的DTaP疫苗。怀孕期间接种百日咳疫苗可能会减弱婴儿对初次百日咳疫苗接种的后续反应,这一效应 特别是在接受全细胞疫苗而非无细胞疫苗作为基础免疫系列的一部分的婴儿中观察到48,69。然而,目前的流行病学证据并未表明免疫钝化对保护有临床影响,而且母亲免疫接种对新生儿的益处大于可能增加幼儿和儿童的疾病风险70。
表 1 | 英国孕期推荐接种的疫苗
孕期接种流感和新冠病毒疫苗
孕期会增加因病毒性肺炎导致重症疾病的风险。因此,提供流感病毒和新冠病毒疫苗是为了在孕期保护母亲及胎儿。孕期接种疫苗可以预防流感病毒感染的有效性为49%(95%置信区间:14-71%)6,并且可以预防住院治疗COVID-19的有效性为94%(95%置信区间:29-99%)8。这些疫苗与任何增加的不良围产期结果无关6,8,有些研究甚至报告称接种疫苗的妊娠中早产和死产的比率有所下降8,72,这可能是因为预防了感染导致的这些并发症。尽管这些疫苗主要是为了预防孕期重症疾病而提供的,但越来越被认识到的是,保护新生儿也是一个重要的额外好处。
在低收入国家进行的随机对照试验一致报告称,孕期接种季节性流感疫苗可以在预防2个月以下的婴儿实验室确认的流感病毒感染方面达到56%的有效性(95%置信区间:28-73%),在预防6个月以下的婴儿感染方面的有效性为35%(95%置信区间:19-47%)7。在高收入国家,观察性研究发现孕期接种季节性流感疫苗在预防婴儿实验室确认的流感病毒感染方面的有效性介于41%到71%之间73,74,并且在预防住院治疗方面的有效性为39-92%73-76。妊娠期间接种COVID-19疫苗的有效性在预防婴儿感染SARS-CoV-2方面为21-84%,在降低婴儿因COVID-19住院的风险方面为32-95%,其中与当前病毒变异株匹配并在妊娠20周后接种的疫苗效果最佳。
这种明显的保护作用,加上婴儿特别容易受到流感和COVID-19侵害的证据,促使人们呼吁修改接种时间表,以最大化对新生儿的保护,而不是在妊娠期间保护母亲和胎儿。妊娠期间的流感疫苗作为季节性活动广泛提供,以预防预测的冬季病毒感染波。在英国,当有针对新变种的疫苗可用时,也作为季节性活动提供COVID-19疫苗接种(在2025年春季之前)。为了最大化对婴儿的保护,加强剂将在与百日咳疫苗接种类似的窗口期提供。据我们所知,尚未计划实施这些变更,但美国有更新的建议,认为可以考虑在孕期的第三孕期进行夏季疫苗接种,以最大化对新生儿的保护。澳大利亚药品监管机构最近的一项举措是专门针对新生儿保护而进行的妊娠期间流感疫苗接种,这表明一些国家可能在不久的将来会考虑这一点。
出生时接种乙型肝炎疫苗
乙型肝炎病毒(HBV)可引起急性或慢性感染,85-90%的母亲在妊娠期检测出HBV病毒抗原阳性时出生的婴儿会发展成慢性感染,使他们面临发展为肝硬化、肝衰竭或肝癌的风险。由于围产期传播是全球HBV传播的主要途径之一,若要实现世卫组织到2030年根除HBV的目标,预防这一传播至关重要。
几乎没有证据表明胎盘转移抗乙型肝炎病毒抗体可以保护新生儿免受感染。另一方面,出生后立即给婴儿接种乙型肝炎疫苗可以减少婴儿感染风险73%(95%置信区间:60-82%),而将乙型肝炎疫苗接种与被动免疫(使用抗乙型肝炎免疫球蛋白)结合使用可以减少婴儿感染风险92%(95%置信区间:83-97%)。无论是试验还是药物警戒数据,均未出现出生时接种乙型肝炎疫苗的安全问题。
因此,世卫组织建议所有婴儿出生后立即接种乙型肝炎疫苗。几乎所有美洲和亚洲国家都采纳了这一建议,但许多欧洲国家,包括英国在内,选择在妊娠期筛查HBV,并且只对高风险婴儿出生时接种疫苗,其中大多数作为婴儿免疫计划的一部分接种含有乙型肝炎病毒的多价疫苗。然而,这一方法的成功依赖于识别大量感染HBV的孕妇的能力——即使在高收入国家,这也并非总是能够做到的事情。
在疫区接种结核病和口服脊髓灰质炎疫苗
在结核病和脊髓灰质炎是地方病的国家,这两种疾病是婴儿和儿童死亡的主要原因。因此,世卫组织建议在撒哈拉以南非洲、南亚和东南亚地区一旦出现病例就尽快接种脊髓灰质炎疫苗。
目前唯一可用的结核病疫苗是卡介苗(BCG)。作为一种减毒活疫苗,卡介苗在怀孕期间是禁忌的,所以目前无法针对结核病制定孕期接种策略。
然而,一份婴儿剂量的卡介苗对预防五岁以下儿童死于结核病的有效性为80%(95%置信区间:31-94%)。推荐额外接种一剂口服脊髓灰质炎疫苗,因为它能增强后续完成三剂婴儿免疫程序后的血清转换率,而单靠这一程序不足以在病毒呈地方性流行的地区预防脊髓灰质炎。98-100。
由于卡介苗和口服脊髓灰质炎疫苗都是减毒活疫苗,它们有可能引发疾病,尤其是在免疫功能低下的婴儿中。在英国,只建议给高风险婴儿接种卡介苗,并且在提供严重联合免疫缺陷筛查的地区,会推迟接种卡介苗直到结果出来。101。接种卡介苗可能带来的危害,加上该疫苗相对较低的有效性,意味着开发一种新的结核病疫苗是优先事项。对于口服脊髓灰质炎疫苗,出生时接种被认为能降低疫苗相关疾病的风险,因为婴儿在一定程度上仍受到母传抗体的保护。随着全球根除该疾病的临近,口服疫苗将完全被淘汰。
防止呼吸道合胞病毒的新兴项目
呼吸道合胞病毒(RSV)是导致儿童急性下呼吸道感染(LRTI)的主要原因。2019年全球估计有3300万例与RSV相关的LRTI(RSV-LRTI)发生。
表 2 | 呼吸道合胞病毒(RSV)免疫规划的考量因素
框2 | 影响孕妇接种疫苗接受度的因素
获取途径
愿意在怀孕期间接种疫苗的人可能因财务或后勤障碍而延迟或未能参加疫苗接种。计划应确保在分娩时提供免费疫苗接种,并在多个医疗保健环境中提供,包括产前预约136。
信息
一些愿意在怀孕之外接受疫苗接种建议的人在怀孕期间犹豫不决,因为担心对胎儿的安全造成影响。认为疾病风险低也降低了个体接种疫苗的意愿。提供关于对胎儿/新生儿的风险和收益的证据会增加这些个体的接种率137。
信任
一些人在怀孕期间拒绝接种疫苗,这是对疫苗、卫生当局和医疗专业人员更广泛的不信任的一部分137。动机式访谈可以成为建立良好关系的有效工具,增加对新信息的接受度138,但这需要对培训提供结构性支持,并在产前预约中增加额外时间。
5岁以下儿童,其中95%的病例和100,000例死亡发生在低收入和中等收入国家102,103。在高收入国家,RSV是住院的主要原因,也是一个重要的医疗保健资源问题。婴幼儿患严重疾病的几率不成比例地高,尤其是在出生后28天至3个月之间的婴儿住院率最高。早产儿因呼吸道合胞病毒(RSV)下呼吸道感染(LRTI)而住院的比例占25%。因此,开发安全、有效且负担得起的策略来预防包括早产儿在内的RSV相关发病率和死亡率是全球的优先事项。最近,已可以在孕期接种以及在婴儿中普遍接种含有抗RSV融合(F)蛋白单克隆抗体的疫苗。这两种策略都旨在通过延迟首次RSV感染至儿童年龄较大时(此时患严重疾病的风险较低),以保护新生儿和首次进入RSV季节的婴儿。
孕期接种RSV疫苗
最近开发了一种用于孕期的RSV融合前F(RSV pre-F)蛋白疫苗,并在多个国家获得批准,商品名为Abrysvo。在一项III期试验中,该疫苗对90天以下的婴儿出现需医学干预的重度RSV LRTI的有效性为81.8%(99.5%置信区间:40.6-96.3%),对90至180天以下的婴儿的有效性为69.4%(97.58%置信区间:44.3-84.1%)。自2023年起,阿根廷和美国已将Abrysvo作为季节性项目开展接种,英国则从2024年开始将其作为全年项目进行接种。
值得注意的是,Abrysvo的III期试验报告了在南非和巴西,但并非在高收入国家,早产儿的出生率出现了非统计学显著的不平衡——但未报告与死亡率有关的情况。在许可过程中,尤其是在另一种呼吸道合胞病毒(RSV)预融合蛋白疫苗的第三阶段试验的背景下,这个信号已经得到了仔细的考量。该疫苗因疫苗组和安慰剂组之间的早产儿出生率存在显著差异而在2022年2月被暂停(疫苗组有237例(6.8%)而安慰剂组有86例(4.9%);相对风险为1.37,95%置信区间为1.08-1.74),这一差异是由低收入和中等收入国家特定时期观察到的不平衡所驱动的。这一信号可能反映了低收入环境特有的流行病学特征,但在多个地点进行严格试验的挑战,这些地点的产前护理标准可能有所不同,也可能是导致这种情况的一个因素。疫苗接种到分娩的时间间隔在各组之间是相似的,而且在专门针对高风险妊娠的第三阶段试验中也没有观察到不平衡现象。
在高收入国家没有出现任何信号表明,在这些国家,怀孕期间接种RSV疫苗的好处超过了风险,但为了确保对项目的信心,早产率正在被密切监测。来自美国的新数据显示,接种RSV疫苗后的早产率与历史数据一致。为了降低任何潜在的早产风险增加,美国选择在孕32周后提供RSV疫苗。阿根廷也从孕32周开始提供RSV疫苗,英国则从孕28周开始。这意味着,最早产儿——即在疫苗接种前出生的早产儿——将无法从经胎盘转移的母源性呼吸道合胞病毒(RSV)特异性IgG中获益,但他们可能仍能从阻断RSV传播和母乳中转移的RSV特异性抗体中获益。在美国和阿根廷,这种提供的季节性进一步限制了潜在益处,因为在流感季节怀孕时间超出孕周限制的人将不会获得RSV疫苗。
一种编码稳定前F糖蛋白的信使RNA疫苗(mRNA-1345,莫德纳公司)目前正在全球范围内进行妊娠期的三期临床试验(NCT06143046),并且最近已被授权用于其他适应症。
出生时对RSV的被动免疫
自1990年代以来,在高收入国家,已建议对高风险严重RSV病情的婴儿在RSV流行季节每月使用帕利韦单抗(一种人源化抗RSV F蛋白单克隆抗体)进行预防。最近开发的尼西韦单抗是一种长效抗RSV F蛋白单克隆抗体,半衰期长达79天,只需单次肌内注射即可给药,这一突破性进展使得在欧洲和北美更广泛地实施被动免疫以保护新生儿成为可能。
在三期研究中,尼西韦单抗(现已被授权作为Beyfortus使用)显示对医疗照顾的RSV下呼吸道感染(LRTI)的有效性,在健康足月和早产婴儿(>35孕周)中达到150天的有效性为74.5%(95%置信区间:49.6-87.1%),在早产婴儿(29至<35孕周)中为70%。1%(95%置信区间:52.3-81.2%)112. 自那以来,nirsevimab的高效力已在旨在模拟现实世界条件的多国临床试验中得到证实,对于12个月以下的婴儿,在他们的第一个呼吸道合胞病毒(RSV)季节开始时接种,且胎龄至少达到29周,其效力为83.2%(95%置信区间:67.8-92.0%)针对RSV相关住院治疗,以及75.7%(95%置信区间:32.8-92.9%)针对RSV相关的极严重下呼吸道感染(LRTI)。
自nirsevimab获得许可并实施以来,多个国家已显示出高效的广泛覆盖。继2023年9月在西班牙引入婴儿普及计划后,三个地区的覆盖率在78.7%到98.6%之间,对于RSV下呼吸道感染(LRTI)住院治疗的效力为70.2%(95%置信区间:38.3-88.5%)。这些数据在西班牙加利西亚地区和法国随后的研究中也得到了证实,研究表明,为了预防一次RSV相关住院,需要进行被动免疫的婴儿数量介于25(参考文献115)到39(参考文献116)之间。在卢森堡,2023年因RSV下呼吸道感染住院的5岁以下儿童中,婴儿接种率为84%,平均入院年龄增加(14.4个月对比2022年的7.8个月),而6个月以下婴儿的住院时间缩短(3.4天对比5.6天)117。在关键的第二阶段试验中观察到,需要入住儿科重症监护病房的重度RSV疾病减少。
在法国的真实世界数据中已证实,尼司韦单抗接受者的研究结果,其有效性为75.9%(95% CI:48.5-88.7%)118。美国新疫苗监测网络观察到的覆盖率显著低于欧洲的研究结果(4-12%)119。然而,在接受尼司韦单抗的婴儿中,针对呼吸道合胞病毒相关住院的有效性为90%(95% CI:75-96%)119。
给新生儿接种抗呼吸道合胞病毒单克隆抗体是一种极具吸引力的策略,可以保护至多6个月大的婴儿,特别是在对孕期接种疫苗持犹豫态度的人群中。然而,在大多数国家,家庭没有选择权,该策略由国家级别决定(表2)。此外,这一策略的成本目前限制了全球供应。额外长效呼吸道合胞病毒单克隆抗体的批准将改善全球供应和韧性,并可能降低成本。为此,正在进行III期研究(MK-1654,NCT04767373)的clerovimab疫苗,该疫苗与呼吸道合胞病毒融合蛋白上的另一个部位结合。
孕妇接种呼吸道合胞病毒疫苗以及给新生儿接种单克隆抗体可保护最年幼和最脆弱的婴儿,而给较大婴儿和幼儿接种的呼吸道合胞病毒疫苗最近已进入临床试验阶段。然而,美国食品药品监督管理局已暂停所有针对2岁以下儿童的呼吸道合胞病毒疫苗试验[21]。预计6个月以下的婴儿将无法获得呼吸道合胞病毒疫苗。因此,当前母婴被动免疫之间的干扰不太可能出现。
近期,疫苗和婴儿免疫接种将成为考虑因素。
未来预防B群链球菌感染的项目
B群链球菌(GBS)是全球新生儿和婴儿败血症和脑膜炎的主要病因之一122。在东南亚地区,有8.9%(下限)到24.2%(上限,北非和西亚地区)的孕妇被GBS定植,这是母婴感染的前提条件123。全球每年约有46,200例死产,518,100例早产和91,900例婴儿死亡是由GBS引起的123。目前,产时抗生素预防是减少早期发病(出生后7天内发生)的唯一策略,但对迟发型疾病、死产或早产没有效果。疫苗接种有可能影响GBS病的所有这些方面,并减少产时使用抗生素的需求,这可能对新生儿的微生物群产生长期影响12。
患侵袭性GBS病的新生儿母亲体内GBS血清型特异性荚膜抗体的滴度较低125,因此最初专注于开发荚膜多糖蛋白疫苗120,即将完成覆盖与疾病相关的主要血清型,在I期/II期研究(C1091002)中显示出可接受的安全性,并且在怀孕期间和通过胎盘转移抗体,浓度与降低婴儿侵袭性GBS风险相关126-128。正在计划一项III期全球关键研究(C1091009)。
含有所有GBS菌株结构保守蛋白的蛋白质疫苗是一种替代方法。Minervax开发了一种基于GBS表面蛋白融合的疫苗,称为Alpha样。
框3| 孕期或受孕前疫苗接种的未来目标
与重大先天性异常相关的感染
巨细胞病毒
先天性巨细胞病毒感染是导致听力损失、视力障碍和神经发育迟缓的主要原因。由于病毒采用了广泛的免疫逃逸策略,疫苗研发受到阻碍,但目前有一种候选mRNA疫苗正在成人(NCT04232280)和青少年女孩(NCT05085366)中进行三期试验139。
寨卡病毒
寨卡病毒是一种由蚊子传播的病毒,在赤道非洲和亚洲呈地方性流行。其传播至美洲后,在2015年至2016年间引发了一场疫情,超过3500例婴儿因先天性感染出现小头症和脑异常。目前,有四种疫苗候选物正在进行或已进入二期临床试验140。
妊娠期病情更严重的感染
拉沙病毒
拉沙病毒是一种在西非地方性的动物源性传染病,可引起出血热。妊娠与拉沙病毒感染导致的死亡风险增加2.86倍有关141。一种由水泡性口炎病毒作为载体的疫苗候选物于2024年进入二期试验(NCT05868733)。
戊型肝炎病毒
戊型肝炎病毒通过粪口途径传播,可引起急性肝炎。妊娠期感染与死亡风险增加六倍有关。一种针对戊型肝炎的类病毒颗粒疫苗已在中国获得批准使用。由于关于安全性和有效性的信息不足,世界卫生组织尚未推荐其广泛采用,但2024年发表的一项十年期III期试验结果可能会改变这一状况。
对新生儿更严重的感染
结核病
婴儿患结核病的风险更大,但由于接种卡介苗可能带来的伤害以及该疫苗相对较低的有效性,因此开发一种新疫苗成为优先事项。一种新型佐剂亚单位疫苗(M72/AS01E)在南非的非孕成人中进行试验,若在怀孕前接种疫苗,可能为新生儿提供一定程度的保护。
预测能覆盖超过99%临床分离株的蛋白质。一项全球II期研究已完成(NCT05154578),在南非和乌干达还完成了一项包括HIV感染者及非感染者的孕妇在内的进一步研究(NCT04596878)。计划进行一项III期研究,该研究很可能基于免疫学终点。
通过III期临床试验推进这些疫苗并获得批准的主要障碍是需要纳入大量母亲和婴儿以进行临床疗效研究,这使得此类研究在商业上不可行。基于血清保护性相关指标的免疫学终点是一个更有吸引力的选择。然而,必须针对每个GBS血清型进行定义,并且使用标准化参考血清的标准化检测方法至关重要。GBS疫苗接种的最大收益可能会在低收入国家实现,但在此类环境中孕前保健的标准不一也给提供稳健临床试验带来了挑战。尽管存在这些障碍,过去几年已经取得了重大进展和投资,这为全球抗击GBS出现有效疫苗带来了希望。
前景展望
开发用于孕妇和新生儿的新疫苗因在这些群体中进行试验的额外后勤和伦理挑战而复杂化,而且历史上一直受到忽视。新方法即将到来,但所有层面仍需更大程度地参与孕期和新新生儿疫苗的开发与测试。
即便是成熟的计划也继续面临成功的障碍。在低收入环境中,获取和物流可能构成特殊挑战,财政、结构和组织支持对于确保公平获取至关重要。鉴于新生儿死亡率较高,以及相应地在这些环境中母亲免疫接种的价值较高,克服这些障碍至关重要。即便在高收入环境中,确保供应也并非没有困难。在法国,供应问题导致可用的尼西韦单抗剂量被转移给产房的新生儿,而在美国,从2023年10月到2024年1月,一些医疗机构也出现了暂时短缺。即使一种针对传染病的疫苗已获得批准,继续对其他疫苗进行试验以确保全球供应和韧性也是至关重要的。疫苗接种在怀孕期间最有效的有限时间框架也给项目带来了挑战:随着更多疫苗被纳入接种计划,关于联合使用的考虑将变得越来越重要。
另一个挑战是接受度。对怀孕期间推荐的疫苗接种率低是一个问题:COVID-19大流行期间,产前百日咳和流感疫苗的覆盖率下降,分别从71%降至61%,从44%降至35%,并且尚未恢复。提高接种率的策略需要卫生当局、科学社团和医疗专业人员的协调,以确保产前医疗指导中完全涵盖疫苗接种,并充分解决特定群体的关切(框2)。这一过程要求严格,但确保我们能够从已承诺用于开发新策略以保护新生儿免受传染病影响的更大资源中获得最大收益至关重要(框3)。
Male V, Jones CE. Vaccination in pregnancy to protect the newborn. Nat Rev Immunol. 2025 Sep;25(9):649-661. doi: 10.1038/s41577-025-01162-5. Epub 2025 Apr 23. PMID: 40269273.
Hits: 0
